- Accueil
- D.Sciences biologiques
- III.Biologie générale
- 2. Organisation chimique fondamentale de la vie
- 7.Métabolisme 1 bioénergétique et enzymes
7.Métabolisme 1 bioénergétique et enzymes
Thermodynamique-bioénergétique et métabolisme
- INTRODUCTION
L’Energie vitale
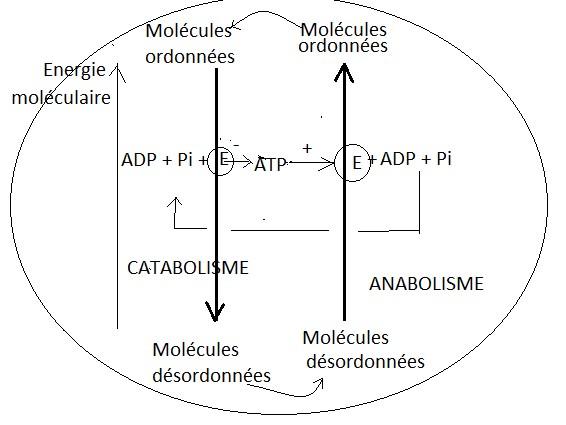
ANABOLISME
Ex : Conversion de glucides en acides aminés à polymérisation : protéines
|
Les petites molécules se combinent pour former des polymères Consommation d’énergie chimique
|
CATABOLISME
|
Hydrolyse des polymères avec pour résultat la décomposition en petites molécules Production d’énergie chimique Production d’énergie
|
Ou à l’inverse hydrolyse des protéines en acides aminés à conversion en glucides
Anabolisme + catabolisme = métabolisme
Chez les organismes pluricellulaires les nombreuses cellules exportent des produits chimiques d’une partie de l’organisme vers d’autres parties.
La respiration cellulaire produit de l’énergie qui permet à la cellule de fonctionner en dégradant et utilisant l’énergie emmagasinée dans les monosaccharides et autres molécules – sources d’énergie.
Cette énergie servira à accomplir différentes fonctions comme le transport de solutés à travers la membrane plasmique. Parmi d’autres fonctions plus spectaculaires on trouve le phénomène de bioluminescence de certains champignons ou insectes.
B. CONCEPTS
|
I.1 Métabolisme, généralités
Métabolisme semblable à un réseau de voies suivies par des millier de réactions biochimiques d’un organisme (carte routière). Ce sont des interactions entre molécules se trouvant dans l’environnement de la cellule
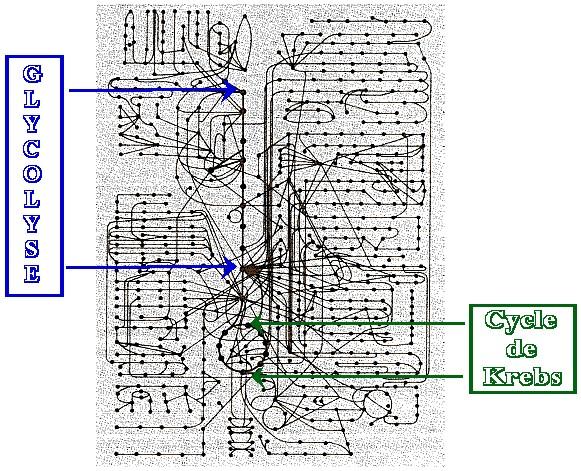
|
Une voie métabolique est une séquence d’étapes au cours desquelles une même molécule est modifiée jusque l’obtention d’un produit donné – chaque étape de la voie est catalysée par une enzyme spécifique |

L’image des feux de signalisation illustre bien les mécanismes de régulation enzymatique qui équilibrent les besoins et les apports métaboliques évitant carences et excès de molécules cellulaires importantes
|
But du métabolisme : gérer les ressources énergétiques et matérielles de la cellule |
CATABOLISME (exemple 1)
La respiration cellulaire est une voie très importante du métabolisme : en présence d’oxygène, les monosaccharides et autres molécules sont dégradées en CO2 et en H2O avec production d’énergie notamment sous forme d’ATP
Cette énergie pourra alors servir à fournir un travail dans la cellule : battement ciliaire, passage de substances à travers la membrane etc…
ANABOLISME (exemple 2)
La synthèse de protéines à partir d’acides aminés est un exemple d’anabolisme
L’énergie libérée par les réactions cataboliques peut être emmagasinée et ainsi servir aux réactions anaboliques
L’énergie joue un rôle fondamental dans les processus métaboliques, il faut connaître ces processus et leurs lois pour comprendre le fonctionnement de la cellule. C’est un cas particulier des lois générales de la thermodynamique : la bioénergétique.
I.2 Les formes d’énergie
Energie à capacité de causer un changement
Diverses formes d’énergie à production d’un travail, c’est-à-dire imprimer un mouvement à la matière pour contrer les forces opposées qui s’exercent sur elle (gravitation, friction…)
Exemples, tourner les pages d’un manuel, transporter une charge, passage de substances au travers d’une membrane
Différentes formes d’énergie : la vie dépend de la capacité des cellules à transformer l’énergie d’une forme à l’autre.
L’énergie est liée au mouvement relatif des objets : énergie cinétique
Ex l’eau qui coule d’un barrage et actionne des turbines, la lumière = mouvement de photons, ces types d’énergie peuvent servir à produire un travail. Ainsi la lumière produit de l’énergie chimique (énergie lumineuse ß> énergie chimique) par la photosynthèse.
La chaleur ou énergie calorifique ou encore énergie thermique résulte du mouvement désordonné d’atomes ou de molécules entrant en collision.
Un corps immobile peut posséder une énergie, cette énergie non cinétique est appelée énergie potentielle, il s’agit de l’énergie que possède un corps en raison de sa position ou de sa structure.
- L’eau au sommet d’un barrage possède une énergie potentielle qui peut être transformée en énergie cinétique par sa chute au bas du barrage
Les molécules possèdent de l’énergie potentielle par la disposition de leurs atomes, la décomposition de cette molécule libèrera cette énergie sous forme chimique au cours d’une réaction chimique. C’est le principe du catabolisme le long de voies biochimiques complexes au cours de ces réactions de type catabolique, les molécules sont dégradées en d’autres composés structurés autrement et possédant moins d’énergie que la molécule de départ, cette différence d’énergie est l’énergie produite. Les molécules qui subissent le catabolisme sont issues des aliments pris par l’organisme.
L’origine de toutes les énergies rendues disponibles à l’organismes proviennent de la lumière issue du soleil. Les organismes transforment l’énergie.
I .3 les principes de la transformation de l’énergie.
I.3.1 définitions
En thermodynamique, les scientifiques appellent système la portion de matière étudiée
L’environnement fait référence à ce qui est extérieur au système, dans l’absolu, l’univers entier.
Le système peut être ouvert ou fermé
Dans un système fermé, le système est isolé de son environnement, il ne peut y avoir d’échange de matière ni d’énergie avec l’environnement (Bouteille thermos contenant de l’eau et fermée).
Dans un système ouvert, il peut y avoir échange de matière et d’énergie avec l’environnement.
Les organismes sont des systèmes ouverts qui absorbent de l’énergie (énergie lumineuse, énergie chimique des molécules organiques), dégagent de la chaleur (énergie) et éliminent dans leur environnement des déchets métaboliques tel le dioxyde de carbone (matière).
La transformation de l’énergie dans les organismes et dans toute matière obéit à deux principes de la thermodynamique
L’énergie n’est donc jamais consommée, elle est transformée… d’une forme à l’autre en donnant ou en captant de l’énergie (rappelle toi l’enthalpie de Debaille)
La plante qui change l’énergie lumineuse en énergie chimique joue le rôle de convertisseur et non de producteur
I.4 La dégradation de l’énergie et le second principe de la thermodynamique
Si l’énergie n’est jamais consommée, pourquoi les organismes ne la recycle-t-il pas simplement au fur et à mesure ? A chaque transformation ou transfert d’énergie, une certaine quantité de celle-ci devient inutilisable, non disponible pour effectuer un travail. Il n’existe pas de processus énergétique dont l’efficacité soit de 100 % (moteur diesel ou essence, entre 35 et 40 % de rendement énergétique).
Dans la plupart des transformations énergétiques, les formes d’énergie utilisée sont converties au moins partiellement en chaleur, énergie causée par le mouvement aléatoire des atomes ou des molécules. Lorsqu’un organisme supérieur actionne ses muscles (course des fauves par exemple …) seule une part réduite de l’énergie, fournie par les aliments, est convertie en énergie cinétique de mouvement, le reste est converti en chaleur qui se disperse rapidement dans l’environnement.
Lors des réactions chimiques qui transforment l’énergie pour effectuer un travail cellulaire (Utilisation de l’ATP pour le transfert membranaire actif par des pompes et des perméases, battement de cils ou flagelles de, spermatozoïdes etc…), une partie de l’énergie est transformée en chaleur.
Malgré que la chaleur soit une énergie de « mauvaise qualité », elle peut être utilisée s’il existe une différence de chaleur, un pôle plus chaud et un pôle plus froid entre lesquels elle peut circuler. Si la température est uniforme, la chaleur ne peut servir qu’à réchauffer le milieu, c’est-à-dire une portion de matière (gaz, liquide ou solide). Dans une pièce bondée, l’élévation de température peut rapidement rendre celle-ci inconfortable en raison de la multitude de réactions chimiques qui se déroulent dans un organisme, les réactions qui produisent de la chaleur ne peuvent transmettre cette chaleur pour produire un travail puisque la température de l’organisme est uniforme.
Cette perte de chaleur (énergie désordonnée) accroît le désordre du milieu dans lequel elle est transmise, l’univers en général.
Les scientifiques utilisent la notion d’entropie (fonction entropie) pour mesurer le degré de désordre
Plus un système tend vers le désordre, plus son entropie est élevée.
Selon le second principe de la thermodynamique tout échange d’énergie augmente l’entropie de l’univers
L’univers tend irrémédiablement vers un accroissement du désordre, vers une augmentation de l’entropie, ce principe est global, car localement, l’inverse peut se produire (accroissement de l’ordre).
Dans certains cas, ce principe est évident visuellement :
- Dégradation physique de la structure organisée d’un système à l’exemple la désorganisation d’un immeuble abandonné ou d’une chambre qui n’est jamais rangée.
Elle l’est moins dans d’autres cas, à l’exemple du guépard qui convertit l’énergie chimique en énergie cinétique et qui rejette de la chaleur et des petites molécules d’excrétion (produits de dégradation des éléments digérés).
Pour qu’un processus ait lieu sans consommation d’énergie, c’est-à-dire de manière spontanée, il faut qu’il se déroule avec une augmentation de l’entropie de l’univers ou du système fermé dans lequel il se trouverait
I.5 ordre et désordre biologique
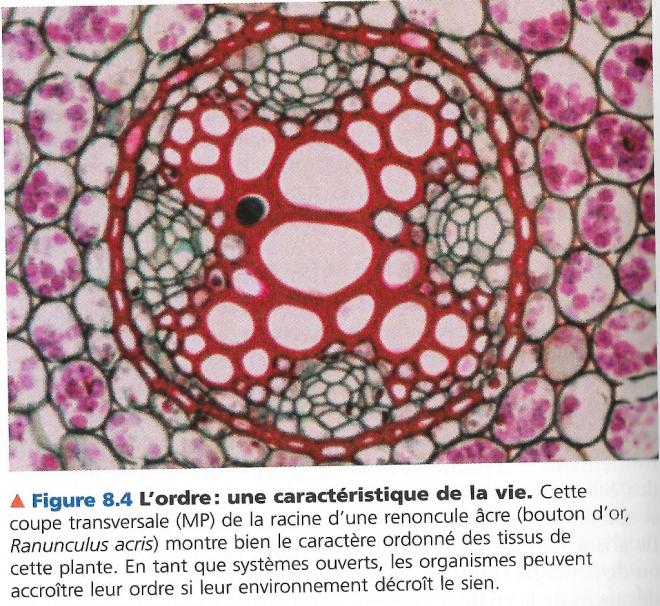
Comme le second principe de la thermodynamique l’enseigne, les êtres vivants accroissent l’entropie de l’univers
Ex : les acides aminés s’agencent en une structure spécifique polypeptidique.
Ex observation de l’extrême symétrie d’une racine de plante formée par des processus biologiques à partir de matériaux plus simples.
Les cellules créent des structures organisées à partir de matériaux moins organisés ( bio-synthèses, anabolisme) avec consommation d’énergie
Cependant un organisme peut également puiser dans son environnement des formes organisées de matière et d’énergie et les transformer en formes moins ordonnées.
En consommant, un animal obtient de l’amidon, des protéines et des molécules complexes de toutes sortes, en les dégradant il libère du dioxyde de carbone et de l’eau, de petites molécules simples qui contiennent moins d’énergie que les molécules de départ C’est la chaleur libérée par ces réactions biochimiques qui explique cette réduction de l’énergie chimique.
A l’échelle de l’écosphère, l’énergie entre dans l’écosystème sous forme d’énergie lumineuse et en ressort sous forme de chaleur ;
Les cellules dégradent des structures organisées en matériaux moins organisés (catabolisme) avec production d’énergie
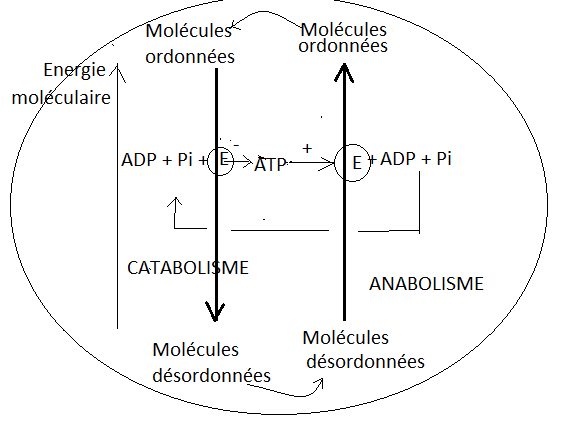
Anabolisme et catabolisme sont couplés par l’intermédiaire d’une molécule « transporteuse d’énergie comme » l’ATP
La question consiste à savoir maintenant quelles sont les réactions qui se réalises spontanément avec production d’énergie.
I.6 La variation du niveau d’énergie libre Δ G
Une fonction très utile a été définie par J.W Gibbs, nommée Energie libre. Il s’agit de l’énergie utilisable d’un système sans considérer son environnement. Cette fonction est symbolisée par « G ». L’énergie d’un système est caractérisée par l’énergie totale, l’énergie libre et l’énergie non utilisable et est liée à la température.
Globalement on a Energie totale = énergie libre + énergie non utilisable : Et = El+Enu
L’énergie non utilisable est fonction de la différence d’entropie à une température donnée lors d’une transformation et on a :
ΔH = différence d’enthalpie (différence d’énergie totale à température et pression constantes lors d’une transformation) en joules
ΔG = différence d’énergie libre (différence d’énergie utilisable lors d’une transformation à température et pression constantes) en joules.
ΔS = différence d’entropie (différence d’ordre)
T = température absolue en Kelvin
|
La connaissance de ΔG permet de prédire si la transformation d’un système est spontanée.
|
La condition température et pression constantes est celle qui est réalisée dans une cellule ou un organisme.
|
Seules les transformations accompagnées d’un ΔG négatif se font de manière spontanée
|
Pour calculer l’énergie libre, on transforme l’équation précédente et on obtient :
ΔG= ΔH - TΔS
Pour qu’un processus se déroule spontanément, il faut qu’il perde de l’enthalpie (ΔH<0, voir Debaille) , l’entropie doit augmenter (TΔS<0) ou les deux. Ce qui implique que dans les cas des réactions spontanées, l’énergie libre doit diminuer (ΔG<0), c’est-à-dire une perte de l’énergie libre du système. Les processus où ΔG>0 sont jamais spontanés.
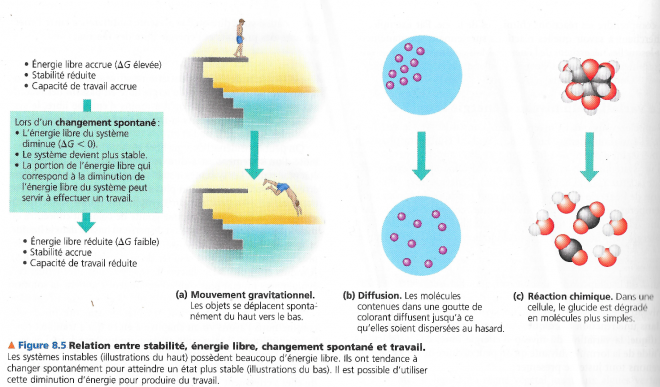
1.7 Energie libre, stabilité et équilibre
On peut également considérer que la variation d’énergie libre correspond à la différence d’énergie libre entre les produits finaux et les réactifs initiaux :
ΔG = ΔGproduits – ΔGréactifs
Une réaction ne sera donc spontanée que si l’énergie libre des produits est plus faible que l’énergie libre des réactifs. Les substances à G élevé on une tendance à l’instabilité à l’inverse des produits à faible G qui ont une tendance à la stabilité. Dès lors les réactions spontanées ont toujours lieux avec accroissement de la stabilité du système à l’image de la molécule de glucose qui est moins stable que ses produits de dégradation et également du cas de la dispersion d’un colorant dans un liquide, l’état dispersé étant plus stable que l’état initial (faible G).
Tout système chimique à l’état d’équilibre est à son maximum de stabilité
La plupart des réactions chimiques sont réversibles et évoluent naturellement dans un état où les réactions inverse et directe ont la même vitesse
L’équilibre chimique est lié de manière fondamentale à l’énergie libre :

ΔG°’ exprime que nous sommes dans un système biologique et que les conditions sont « standards »
Les conditions standard pour les biochimistes sont :
- Un pH de 7 et donc une concentration [H+] = 10-7 M
- Une concentration de l'eau (55,5 M) qui est considérée comme constante et dont le terme n'apparaît pas dans l'expression des constantes d'équilibre
Lorsque l’équilibre est atteint, les concentrations des produits et des réactifs reste constante puisque les vitesses sont égales, ΔG est alors constant et minimum. Si peu que l’on se trouve dans un état où le système est éloigné de son équilibre, celui si a tendance à y revenir car dans ce cas ΔG positive et correspond à un état non spontané.
Si peu que l’on modifie les concentrations du système par exemple en enlevant des produits, le système va sortir de son équilibre et son ΔG ne sera plus minimum, il va alors tendre à revenir à son équilibre en régénérant des produits.
Remarque importante : l’énergie libre d’un système dépend des concentrations, on obtiendra la même valeur de G si on a une forte concentration de substances très peu ordonnées ou une très faible concentration de substances très ordonnées.
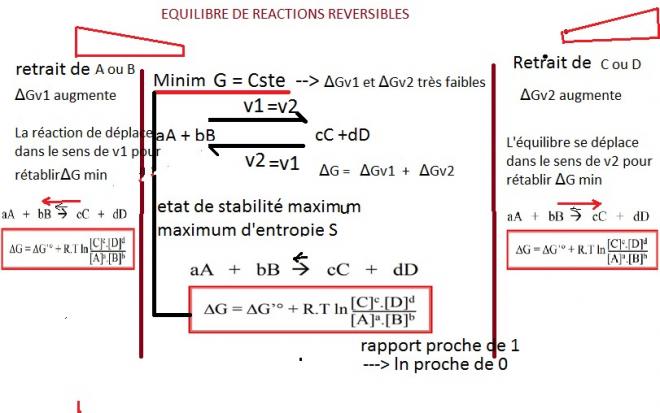
- I.8.1 Réactions exergoniques et endergoniques dans le métabolisme
La valeur de la variation de l’énergie libre lors d’une transformation en général et dans le cas particulier d’une réaction biochimique peut être positive ou négative.
Si ΔG < 0, les produits finaux ont moins d’énergie libre que les réactifs de départ et la réaction est dite exergonique et le système perd de l’énergie libre, dans ce cas la réaction est spontanée. La valeur de ΔG correspond à la quantité maximum de travail que la réaction peut produire. Plus la perte d’énergie libre est grande, plus la capacité du système à produire du travail est grande.
 Si ΔG>0, le système chimique prend de l’énergie libre à son environnement, les produits finaux ont plus d’énergie libre que les réactifs et la réaction n’est pas spontanée. La valeur de ΔG correspond au minimum d’énergie libre dont le système à besoin pour que la réaction puisse se faire
Si ΔG>0, le système chimique prend de l’énergie libre à son environnement, les produits finaux ont plus d’énergie libre que les réactifs et la réaction n’est pas spontanée. La valeur de ΔG correspond au minimum d’énergie libre dont le système à besoin pour que la réaction puisse se faire
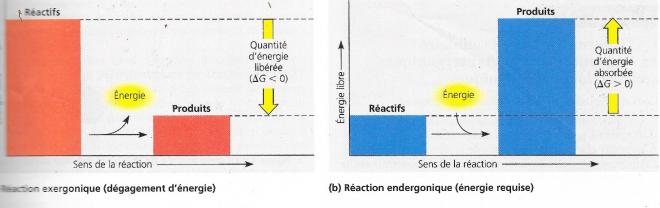
Si une réaction chimique est exergonique dans un sens elle est obligatoirement endergonique dans le sens inverse.
Une réaction réversible ne peut libérer de l’énergie dans les deux sens.
Par exemple si ΔG = -2870 kJ par môle dans le cas de la respiration cellulaire qui convertit le glucose en dioxyde de carbone et en eau, alors le processus inverse qui transforme le dioxyde de carbone et l’eau en glucose doit être fortement endergonique et ΔG = +2870 kJ/mol, cette transformation n’aura jamais lieu spontanément. Cette réaction a lieu chez les plantes lors de phénomène de photosynthèse, l’énergie nécessaire à la réaction provient de la lumière.
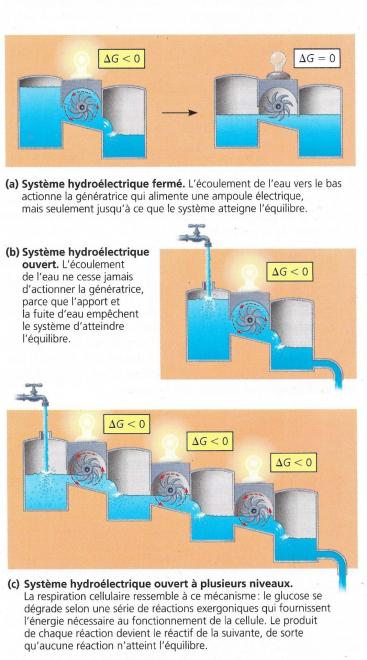
- I.8.2. Equilibre et métabolisme
- Réactions dans un système fermé, tendance à l’équilibre et au maximum d’entropie G est minimum et la production de travail est impossible
- Dans un système ouvert, il y a échange entre l’environnement et le système, , le système ne peut atteindre l’équilibre, la production de travail est possible, c’est le cas des organismes et des cellules ; si ce n’était pas le cas, la cellule mourrait
Voir figure suivante, centrales hydroélectriques
 II. L’ATP permet le travail cellulaire en couplant les réactions exergoniques aux réactions endergoniques
II. L’ATP permet le travail cellulaire en couplant les réactions exergoniques aux réactions endergoniques
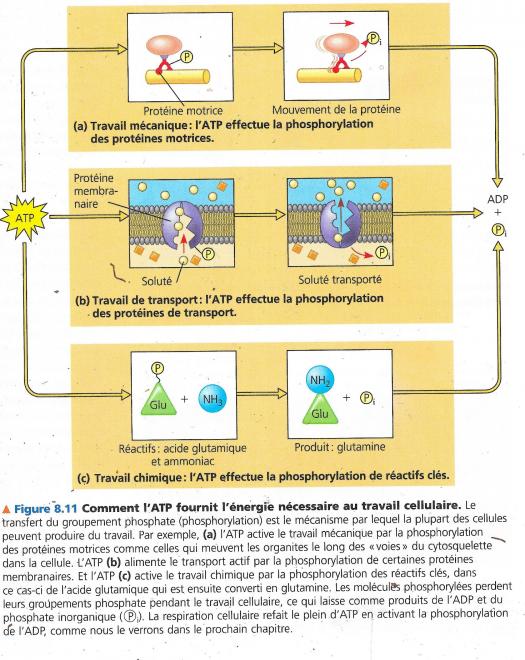
La cellule produit trois types de travaux :
- Travail mécanique : contraction de la cellule, mouvement des chromosomes …
- Travail de transport : passage de substances au travers de la membrane plasmique dans le sens inverse du mouvement spontané
- Travail chimique : déclenchement de réactions endergoniques non spontanées comme la synthèse de polymères
II.2 Structure et hydrolyse de l’ATP
ATP signifie acide désoxyribonucléique
C’est-à-dire une molécule de ribose liée à la base azotée adénine et à une chaîne de trois groupements phosphate
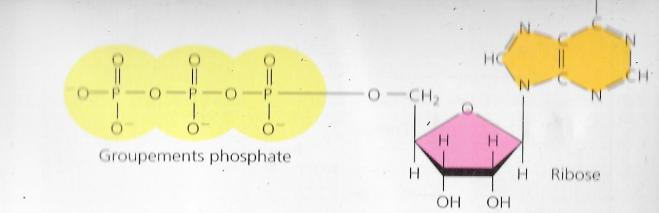
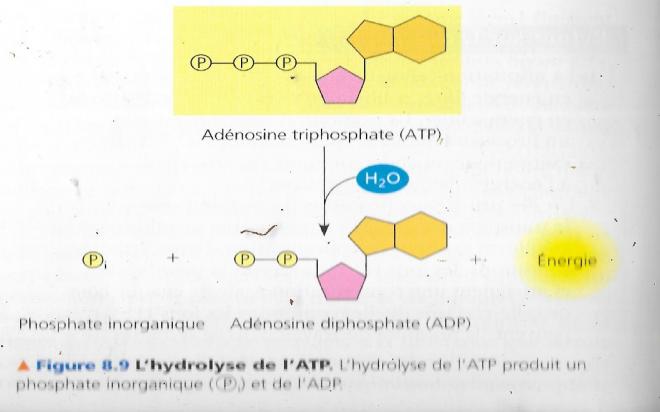
Une hydrolyse peut rompre les liaisons qui existent entre les groupements phosphate, elle se réalise dans la cellule grâce à l’action d’une enzyme appelée ATPase.
Si cette action est menée sur le phosphate terminal, une molécule de phosphate inorganique Pi est libérée
L’ATP devient alors l’adénosine diphosphate ou ADP selon la réaction :
ATP +H2O à ADP + Pi ---- G = - 30 kJ/mol CN
Dès lors, si une réaction endergonique se fait avec une consommation d’énergie libre inférieure au ΔG d’hydrolyse de l’ATP alors les réactions peuvent être couplées en manière telle que dans l’ensemble le processus est exergonique.
Lorsque l’hydrolyse de la liaison phosphate terminale a lieu, les électrons se réorganisent d’une manière correspondant à la structure chimique de l’ADP, ils se déplacent sur une orbitale telle que leur niveau d’énergie baisse pour atteindre un maximum de stabilité. De cette manière l’énergie libre des produits sera inférieure à l’énergie libre des réactifs et il y aura un dégagement de cette énergie libre perdue par le système.
De manière générale, la réaction d’hydrolyse de l’ATP libère un peu plus d’énergie que l’ensemble des autres réactions d’hydrolyse. La raison en est que les divers groupements phosphate liés possèdent une charge partielle négative, dans la molécule ils ont tendance à se repousser, mais cette tendance est contenue par les liaisons ester entre les phosphates. L’hydrolyse libère cette tension et l’énergie est dégagée à l’image d’un ressort comprimé qui se détend
II.3 Comment l’ATP produit du travail
Lorsque l’ATP est hydrolysée dans une éprouvette, l’énergie libérée ne peut que réchauffer l’eau contenue dans l’éprouvette. Dans un organisme, ce phénomène a également lieu en même temps que la libération d’énergie chimique.
Ce phénomène peut être utile (ΔH = ΔG + TΔS), TΔS représentant la part d’énergie calorifique. Cette énergie est par exemple libérée par le frisson qui est mu par l’hydrolyse de l’ATP, mais de manière générale, dans la cellule, la production de chaleur seule reviendrait à utiliser inefficacement une source d’énergie précieuse et l’élévation de température serait dangereuse.
La présence d’enzymes sert à utiliser efficacement l’énergie de l’hydrolyse de l’ATP pour des processus endergoniques (couplage). Ce sont les enzymes kinases qui transfèrent le groupement phosphate sur une autre molécule qui s’en trouve ainsi phosphorylée.
Cette molécule phosphorylée possède plus d’énergie et est plus réactive (moins stable) que la molécule originale non phosphorylée, ce qui explique sa plus grande tendance à réagir avec d’autres molécules des voies métaboliques.
Les trois types de travail cellulaire : mécanique, chimique et de transport sont presque toujours alimentés par l’ATP (aussi GTP, UTP…). Il y a transfert d’un phosphate sur une molécule qui s’en trouve phosphorylée, subit donc un changement et peut ainsi produire du travail.
La synthèse de la glutamine à partir de l’acide glutamique et de l’ammoniac est un exemple de ce mécanisme. Dans cette réaction l’acide glutamique est phosphorylé par l’ATP grâce à une kinase et devient moins stable. Cette instabilité provoque la réaction selon laquelle le phosphate est remplacé par l’ammoniac, ce qui correspond à la molécule de glutamine
Si l’on prend le système regroupant l’hydrolyse de l’ATP et la synthèse de la glutamine, la somme des deux variations de l’énergie libre est négative, le processus est globalement exergonique et se produit spontanément, comme la figure suivante le montre.

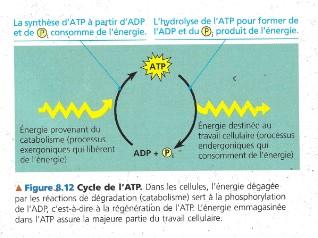
II.4 La régénération de l’ATP
Un organisme au travail utilise continuellement l’ATP
L’ATP est une ressource renouvelable qui peut être régénérée par ajout d’un Phosphate à l’ADP
Les réactions exergoniques de dégradation (catabolisme) fournissent l’énergie libre nécessaire à la phosphorylation de l’ADP
Ces processus de phosphorylation et de déphosphorylation correspondent à ce que l’on appelle le cycle de l’ATP
Dans une cellule, les processus endergoniques consommateurs d’énergie sont couplés aux processus exergoniques producteurs d’énergie (couplage)
Une cellule musculaire au travail reforme son ATP à partir d’ATP et de Pi en totalité en moins d’une minute, ce qui correspond à 10 millions de molécules régénérées et utilisées par seconde
Un processus réversible, ne peut libérer d’énergie dans les deux sens ce qui implique que la réaction de régénération d’ATP à partir d’ADP est nécessairement endergonique :
ADP + Pi à ATP + H20
ΔG = + 30,5 kJ/mol en conditions standard
- pH7
- [H2O] = 55,5 mol/l
Comme on le voit, cette réaction est endergonique, non spontanée et nécessite une dépense d’énergie libre. Ce sont les voies cataboliques exergoniques comme la respiration cellulaire qui fournissent l’énergie nécessaire. Les végétaux, eux, utilisent l’énergie lumineuse pour produire l’ATP
III.Les enzymes accélèrent les réactions métaboliques en abaissant les barrières énergétiques
La thermodynamique nous renseigne sur la spontanéité des réactions dans certaines conditions, mais pas sur leur vitesse. Une réaction spontanée se réalise sans apport énergétique, mais peut être très lente au point d’être imperceptible. L’hydrolyse du saccharose en glucose et en fructose est exergonique, elle a lieu spontanément et est accompagnée d’un important dégagement d’énergie (ΔG = -29,3 kJ/mol).
III.1 Introduction
Cependant des années peuvent passer sans qu’une solution de saccharose ajoutée à l’eau stérile et placée à la température ambiante ne soit hydrolysée de façon appréciable. Si nous versons de l’enzyme appelée saccharase tout le saccharose peut s’hydrolyser en quelques secondes.
- Comment l’enzyme intervient-elle de la sorte ?
L’enzyme est un catalyseur biochimique, comme tout catalyseur elle reste inchangée au cours de son action
- Comment reste-t-elle inchangée ?
- L’enzyme est une protéine globulaire catalytique
- Elle peut accélérer la réaction d’un facteur 106 à 109
- Sans elles, les réactions du métabolisme resteraient interminables, ce qui ne permettrait pas la vie
Nous allons voir maintenant pourquoi les réactions sont si lentes et comment les enzymes résolvent-elles le problème
III.2 L’énergie d’activation
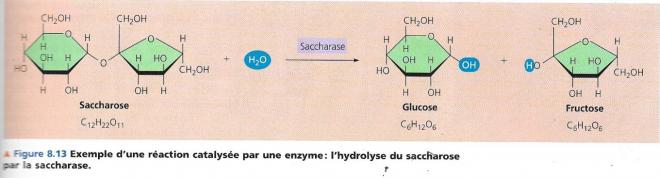
Dans une réaction chimique, il y a : rupture de liaisons dans les réactifs et formation de nouvelles pour donner les produits ;
Lors de l’hydrolyse du saccharose selon l’image ci-dessus :
- Rupture d’une liaison d’une molécule d’eau et rupture de la liaison entre glucose et fructose.
- Etablissement de nouvelles liaisons
Pour ce faire, il faut que la molécule de départ se déforme pour devenir très instable, imaginez un ressort tendu au maximum de son élasticité, il et est instable, dès qu’il est lâché, il reprend sa forme plus stable. Pour atteindre cet état, la molécule doit capter de l’énergie pour que ses liaisons puissent se déformer et se rompre de manière à s’organiser autrement. Lorsque les liaisons du nouveau produit se forment, la molécule redevient plus stable – moins riche en énergie - et libère l’excès de celle-ci sous forme de chaleur
L’énergie pour atteindre l’état de déformation appelé état activé, se nomme énergie d’activation ou énergie libre d’activation et est symbolisée par EA
L’énergie d’activation est « l’énergie qui suffit à pousser les réactifs au delà d’une barrière » dont l’image peut être l’escalade d’une colline. La réaction qui se déroule plus bas, vers l’autre flanc peut ainsi se réaliser. La portion de réaction qui ramène le système à un niveau moins énergétique peut ainsi être réalisée.
Un graphique représente l’évolution de ce système
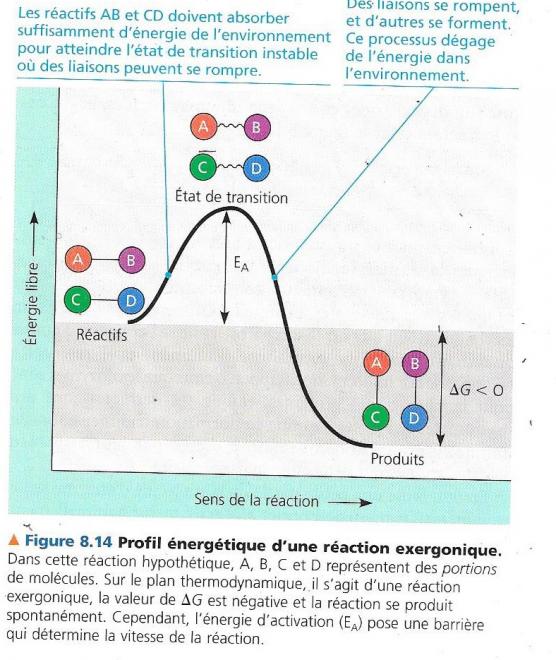
Sur cette figure, globalement, la réaction est exergonique car l’énergie libre des réactifs est supérieure à l’énergie libre des produits : ΔG>0.
|
AB + CD <=> AC + BD |
La partie croissante de la courbe correspond à l’activation des réactifs dont l’énergie libre augmente jusqu’au stade où ceux-ci l’état de transition, instable. A ce niveau, les liaisons peuvent se rompre et commencer à se réorganiser d’une autre manière.
La portion descendante correspond à la formation des nouvelles liaisons, avec perte d’énergie libre.
L’énergie d’activation provient souvent de la chaleur présente dans l’environnement des réactifs Les réactifs absorbent cette chaleur et si elle l’est suffisamment, ils vont atteindre l’état activé riche en énergie donc instable, au sommet de la pente.
L’énergie captée par les réactifs augmente leur vitesse, ils se rencontrent plus souvent et se choquent plus fortement. De plus l’agitation thermique des atomes qui composent les molécules des réactifs rendent les liaisons faciles à rompre.
Pendant que les molécules se stabilisent pour former de nouvelles liaisons, la réaction dégage de l’énergie qui est en fait la somme de l’énergie d’activation plus la différence d’énergie entre les réactifs et les produits (Eréactifs – Eproduits) dans le cas d’une réaction exergonique. Globalement dans une réaction exergonique, l’énergie d’activation sera plus que « remboursée » et l’énergie libérée depuis l’état activé jusqu’aux réactif est grande en module que l’énergie d’activation.
Il arrive souvent que la barrière de EA est tellement élevée et l’état de transition si rarement atteint que la réaction ne s’amorcera pas. Les réactifs ont ainsi besoin d’énergie calorifique pour que la réaction se réalise à une vitesse perceptible. (exemple des bougies des moteurs automobiles qui réchauffent le mélange combustible + comburant).
III.3 Les enzymes et l’énergie d’activation
Sans la barrière d’activation
- Les composés riches en énergie libre (protéines, ADN, autres molécules complexes) pourraient se décomposer spontanément.
- Heureusement, peu de ces molécules peuvent atteindre un tel niveau d’énergie libre à la température de la cellule.
- Il faut pourtant que certaines de ces réactions se fassent pour que le métabolisme fonctionne. La chaleur pourrait accélérer ces réactions.
- Mais l’excès de chaleur dégrade les protéines et tue la cellule et d’autre part, il y aurait accélérations de toutes les réactions, dont celles qui ne sont pas nécessaires
à L’organisme doit faire appel à une solution de rechange : les CATALYSEURS
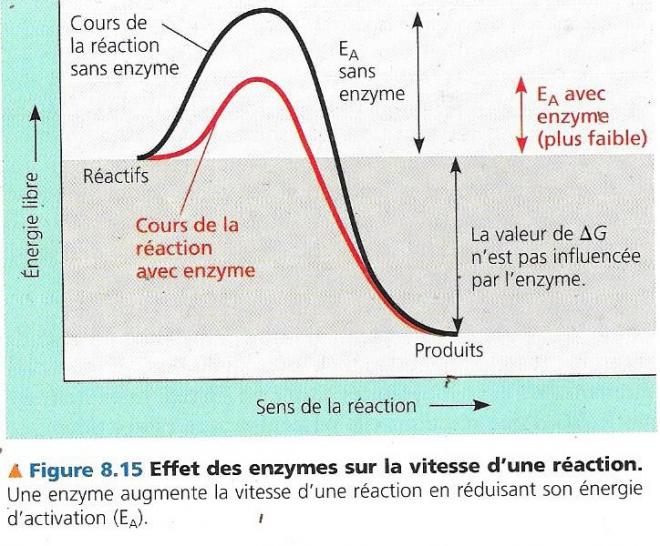
Une enzyme catalyse une réaction en abaissant l’énergie d’activation, les molécules acquièrent ainsi suffisamment d’énergie pour atteindre l’état de transition, même à des températures cellulaires
- L’enzyme ne change pas le ΔG d’une réaction, elle ne peut transformer une réaction endergonique en réaction exergonique
- Elle ne fait qu’accélérer un processus qui de toute façon finirait par se produire.
Cela permet à la cellule d’avoir un métabolisme dynamique, une circulation chimique « fluide ». Les enzymes déterminent les processus chimiques qui se déroulent en tout temps dans la cellule.
III.4 La spécificité des enzymes pour leur substrat
Substrat : réactif sur lequel une enzyme agit
Complexe enzyme substrat : forme de la liaison qui est réalisée entre l’enzyme et le substrat, pendant que les deux sont réunis, l’action catalytique de l’enzyme convertit le substrat en produit(s) de la réaction. Nous pouvons résumer ce processus de la manière suivante :

En fait, seule une petite partie de la molécule d’enzyme se lie au substrat :
Site actif : partie de l’enzyme qui se lie au substrat.
Cette partie forme en général une poche ou un sillon à la surface de la protéine.
En général, le site actif n’est constitué que de quelques-uns des acides aminés qui composent l’enzyme.
La spécificité d’une enzyme réside dans :
- La forme de son site actif correspondant exactement à la forme du substrat.
- La complémentarité dans les interactions entre les atomes ( charges électriques, régions hydrophiles et hydrophobes…)
L’ancien modèle clef-serrure ne doit plus être utilisé :
- Le site actif n’est pas un réceptacle rigide dans lequel l’enzyme s’emboîte
- Lors de la formation du complexe enzyme-substrat, les interactions entre les groupements chimique du substrat et les acides aminés de l’enzyme provoquent une légère modification structurale de l’enzyme et du substrat qui leurs permettent de se correspondre plus étroitement.
Le positionnement des groupements fonctionnels du site actif favorise ainsi leur capacité à catalyser la réaction chimique, c’est l’ajustement induit.
III.5 La catalyse dans le site actif d’une enzyme
III.5.1 Caractéristiques générales de l’action enzymatique
- La complémentarité dans les interactions entre les atomes ( charges électriques, régions hydrophiles et hydrophobes…)
L’ancien modèle clef-serrure ne doit plus être utilisé :
- Le site actif n’est pas un réceptacle rigide dans lequel l’enzyme s’emboîte
- Lors de la formation du complexe enzyme-substrat, les interactions entre les groupements chimique du substrat et les acides aminés de l’enzyme provoquent une légère modification structurale de l’enzyme et du substrat qui leurs permettent de se correspondre plus étroitement.
Le positionnement des groupements fonctionnels du site actif favorise ainsi leur capacité à catalyser la réaction chimique, c’est l’ajustement induit.
III.5 La catalyse dans le site actif d’une enzyme
III.5.1 Caractéristiques générales de l’action enzymatique
La liaison enzyme-substrat est la plupart du temps réalisée par des liaisons faibles (liaisons hydrogène, hydrophobes, hydrophiles, ioniques …. Les chaînes latérales de quelques acides aminés qui constituent le site actif catalysent la transformation du substrat en produit (s).
Une fois la réaction terminée, le produit quitte le site actif et il est libre à l’enzyme d’accepter une autre molécule de substrat.
Le cycle entier est extrêmement rapide au point qu’une seule molécule d’enzyme forme plusieurs milliers de molécules de produits à la seconde ;
Les enzymes restent inchangées après réaction, à l’instar de tous catalyseurs
Le cycle se répète sans cesse, ce qui implique qu’une très petite quantité d’enzyme peut avoir des répercussions énormes sur le métabolisme.
Beaucoup de réactions métaboliques étant réversibles, la plupart des enzymes peuvent catalyser la réaction directe et la réaction inverse. La réaction qui prédomine dépend essentiellement des concentrations des réactifs et des produits, de manière générale, l’enzyme favorisera la réaction qui tend vers l’équilibre des concentrations
Les enzymes utilisent différents mécanismes pour abaisser l’énergie d’activation et accélérer celle-ci.
III.5.2 mécanismes de fonctionnement d’une enzyme.
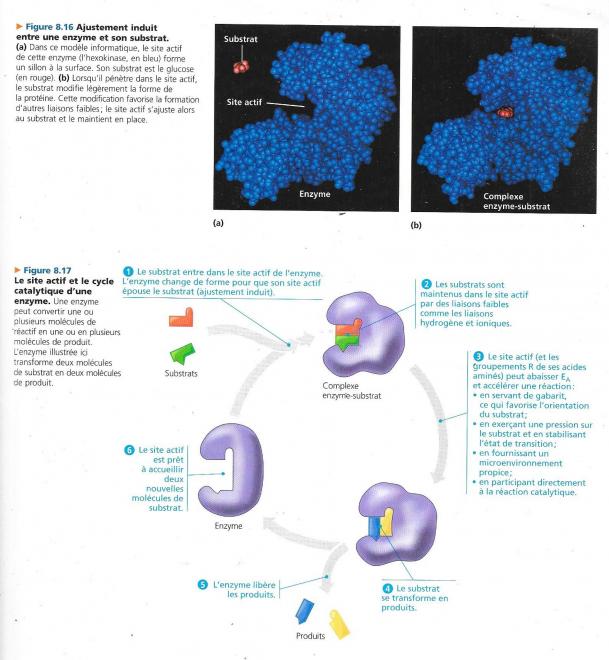
- Soit une réaction impliquant deux ou plusieurs réactifs : le site actif de l’enzyme fournit un gabarit qui permet aux substrats de se rapprocher l’un de l’autre et à adopter une conformation qui permet leur interaction.
- Une fois les substrats épousés correctement par le site actif de l’enzyme, celle-ci étire les molécules de réactifs pour qu’ils se rapprochent de l’état de conformation correspondant à l’état de transition. Elle exerce une pression et déforme les liaisons chimiques pour qu’elles puissent se rompre. L’énergie d’activation EA est proportionnelle au degré de difficulté pour rompre les liaisons, la torsion des substrats les rapprochent de leur état d’activation et, par ce fait même réduit la quantité d’énergie libre qui doit être absorbée pour atteindre l’état de transition.
- Le site actif peut également fournir un microenvironnement plus à la réalisation de certaines réactions particulières qu’une solution sans enzyme. Par exemple s’il comporte des acides aminés pourvus d’une chaîne latérale – R - , le site actif constitue une poche de faible pH dans un milieu cellulaire qui, par ailleurs est neutre, cet acide aminé pourra ainsi faciliter le transfert de protons H+ au substrat, ce qui peut constituer une étape clé dans la catalyse de la réaction. De même, le site actif peut créer une région polaire dans un environnement non polaire.
- Le site actif peut parfois participer directement à la réaction, il arrive même que des liaisons covalentes de courte durée entre le substrat et le radical de l’acide aminé, l’enzyme retrouvera ensuite sa conformation initiale.
III.5.3 Saturation de l’enzyme par le substrat.
La vitesse à laquelle une enzyme transforme les substrats en produit dépend en grande partie de la concentration de ce substrat dans la solution, plus il y a de molécules de substrat, plus elles occupent les sites actifs des enzymes. On ne peut cependant pas augmenter indéfiniment la concentration en substrat car un moment arrive, si la concentration en enzyme est fixe, où tous les sites actifs des molécules enzymatiques sont occupés : l’enzyme est alors dite saturée. Dès qu’une molécule quitte son site actif, une molécule de substrat peut s’y accrocher. La vitesse est ainsi déterminée par la vitesse de conversion par l’enzyme du substrat en produit. Le seul moyen d’augmenter la vitesse de la réaction en cas d’enzyme saturée est d’augmenter la concentration en celle-ci.
III.5.4 Effets des conditions locales sur le fonctionnement de l’enzyme
III.5.4.1 Effets de la température, du pH et de la concentration en sels.
La structure tridimensionnelle des protéines est sensible à l’environnement, ce qui est donc le cas pour les enzymes. Il existe pour chaque enzyme, des conditions optimales de fonctionnement qui sont celles de l’environnement. Un organisme peut
cependant s’adapter à son environnement en sécrétant ses enzymes sous des formes légèrement différentes que l’on appelle isoenzymes. A chaque isoenzyme particulière, ses conditions optimales particulières.
Comme l’indique le titre de ce paragraphe, la température, le pH, et la concentration en sel influencent le fonctionnement de l’enzyme :
La température
Jusqu’à un certain point, l’augmentation de la température accélère les réactions enzymatiques.
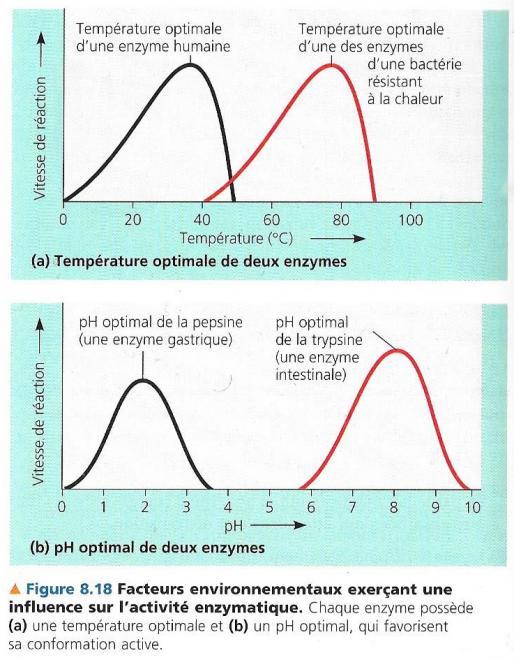
La température étant une mesure de l’énergie cinétique des molécules, dans ce cas, la vitesse des substrats en solution augmente et ils rencontrent plus souvent les sites actifs des molécules enzymatiques ; au-delà d’une certaine température, cependant, la vitesse de conversion des substrats chute rapidement. La molécule d’enzyme dans ce cas, devient si agitée que ses liaisons hydrogène, ioniques et autres liaisons faibles qui stabilisent la molécule se rompent. On dit dans ce cas que la protéine est dénaturée. Les sites actifs sont constitués d’acides aminés rapprochés par le repliement de la structure primaire. Si la température modifie suffisamment cette structure tertiaire, ces acides aminés seront trop éloignés pour que le site actif ne puisse plus assumer sa fonction.il existe donc des conditions optimales de température qui assurent le fonctionnement optimal des enzymes au cours desquelles la conversion des substrats en produits est la plus rapide sans que la protéine de l’enzyme soit dénaturée. Pour la plupart des enzymes humaines, ces conditions optimales de température s’échelonnent entre 35 et 40 °C ; Certaines bactéries vivant dans des milieux extrêmes peuvent avoir des conditions optimales de fonctionnement de leurs enzymes dépassant 70°C
Le pH
En général, ces conditions optimales varient entre pH 6 et pH 8 avec des exceptions dans certains cas particuliers comme la pepsine, enzyme digestive de l’estomac qui fonctionne le mieux lorsque le pH est de 2. Leur structure est conservée sans être dénaturée. On peut également prendre le cas des enzymes lysosomiales qui fonctionnent à pH 3 ou d’autres enzymes comme la trypsine qui est une enzyme fonctionnant le mieux à pH 8 dans le milieu alcalin de l’intestin.
Concentration en sels.
De même les sels en solution influencent le fonctionnement des enzymes car les ions perturbent les liaisons ioniques des protéines. Les solutions à forte concentration en sels empêchent les microorganismes de fonctionner encore qu’il y ait à nouveau des exceptions. Les aliments additionnés d’une solution à forte concentration en sel vont donc conserver bien plus longtemps.
Comme exception, on peut évoquer le cas de certaines bactéries qui vivent dans des milieux dont la concentration en sel est bien plus important que la plupart des eaux de mer. Les bactéries de la mer morte ou la concentration en sel atteint 300 gr/L.
Là ou d’autres organismes verraient leurs protéines totalement dénaturées.
III.5.4.2 Les cofacteurs
Pour accomplir leur fonction catalytique, beaucoup d’enzymes ont besoin de l’aide de substances non protéiques, appelées cofacteurs, ces substances peuvent se lier de deux manières à l’enzyme :
- Liaison forte et permanente.
- Liaison faible et réversible en même temps que le substrat.
Certains cofacteurs sont inorganiques, comme les métaux fer, zinc, cuivre, magnésium sous forme ionique.
D’autres sont de nature organique non protéique, ils sont alors appelés coenzymes : l’enzyme complète est alors constituée de sa partie protéique, l’apoenzyme et de sa partie non protéique le coenzyme.
Enzyme (complète) = Apoenzyme + Coenzyme
La plupart des vitamines sont des coenzymes ou des précurseurs de coenzymes.
Ces cofacteurs fonctionnent de manières diverses, mais jouent un rôle crucial dans la catalyse :
- Accepteurs d’électrons,
- Transporteurs de radicaux dans les réactions métaboliques.
III.5.4.3 Les inhibiteurs enzymatiques
Il s’agit de substances qui arrêtent de façon sélective l’action d’enzymes spécifiques, ils peuvent se lier de manière durable (normale) à l’enzyme par des liaisons covalentes et ce de manière irréversible, mais souvent il s’agit de liaisons faibles et dans ce cas l’inactivation est réversible.
- L’inhibition compétitive est le fait de substances qui ressemblent aux molécules de substrat et entrent en compétition pour la fixation sur le site actif de l’enzyme, la transformation du substrat en solution en produit est alors diminuée. Pour contrer cet effet, la seule solution est d’augmenter la concentration en substrat qui « gagnera » ainsi la compétition.
- L’inhibition non-compétitive consiste en « l’accrochage » de la substance inhibitrice en un lieu éloigné du site actif de cette enzyme. Cette fixation provoque une modification de la conformation de l’enzyme qui devient ainsi moins efficace pour remplir son rôle spécifique.
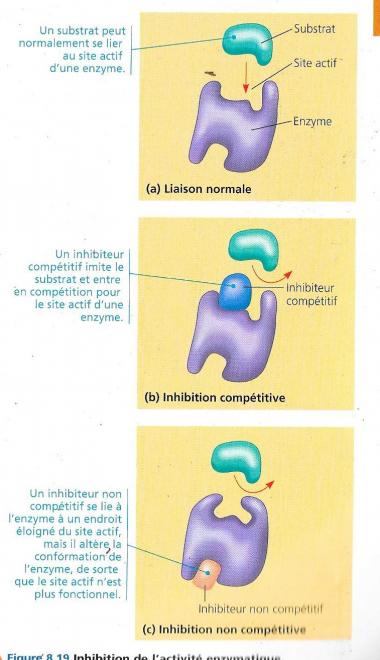
L’inhibition peut aussi être mixte à ce niveau, et s’’opérer de manière compétitive au niveau du site actif et non compétitive au niveau d’un endroit de l’enzyme éloigné du site actif.
Plusieurs poisons agissent en tant qu’inhibiteur irréversibles. Le gaz sarin par exemple est une petite molécule qui se fixe de manière covalente au groupe R de la sérine. Cet acide aminé se trouve dans le site actif de la acétyl-cholinestérase, importante dans le fonctionnement du système nerveux. La pénicilline bloque le site actif d’une enzyme qui intervient chez beaucoup de bactéries dans la synthèse de la paroi cellulaire. On peut également citer des pesticides comme le DDT et le Parathion qui sont également des inhibiteurs d’enzymes.
Il ne faut cependant pas se leurrer, le mécanisme d’inhibition enzymatique n’est en général pas délétère mais indispensable dans les mécanismes de régulation enzymatique que nous allons maintenant aborder.
III.5.5 Les mécanismes de régulation enzymatique contribuent à la régulation du métabolisme
III.5.5.1 contexte
Comme nous l’avons imagé par une carte métabolique au début de ce chapitre, les voies métaboliques comportent des carrefours, voire des rond-points. Si à partir de ces carrefours, toutes les voies métaboliques étaient activées de la même manière, il en résulterait un chaos indescriptible dans la cellule… La cellule doit régler le fonctionnement de ces voies, c’est essentiel à la vie de la cellule. La cellule contrôle le moment et l’endroit où les enzymes sont actives.
Ainsi la pepsine est sécrétée sous forme inactive par les cellules gastriques (cellules sécrétrices situées dans des cryptes), c’est ainsi que les cellules se protègent de l’action potentiellement destructrice de la cellule. La pepsine ne passera sous sa forme active que lorsqu’elle atteindra la lumière de l’estomac.
En fait, la cellule contrôle en grande partie l’activité enzymatique en activant ou inactivant des gènes qui codent pour des enzymes spécifiques ou en régulant l’activité des enzymes existantes. Le deuxième type de contrôle étant chez les eucaryotes beaucoup plus rapide.
III.5.5.2 La régulation allostérique des enzymes
Le plus souvent, les molécules qui contrôlent l’activité enzymatique dans une cellule agissent comme des inhibiteurs non compétitifs réversibles. Elles modifient la
conformation et le fonctionnement d’un site actif en se fixant de manière non covalente et réversible à un autre endroit de l’enzyme.
Dans la régulation allostérique, la fonction d’un des sites d’une molécule est modifiée par la fixation ou liaison de la molécule régulatrice à un autre site.
La régulation allostérique peut aboutir à la stimulation ou à l’inhibition de l’activité enzymatique et constitue un moyen de contrôle précis et rapide du métabolisme.
Rappelons avant de continuer les éléments des conditions locales qui influencent le fonctionnement des enzymes.
1)Caractéristiques de la solution
• Température
• pH
• Concentration saline
? Notion de conditions optimales
2)Les cofacteurs
Substances non protéiques dont l’enzyme a besoin pour fonctionner qui s’y lient de manière forte, permanente et irréversible ou de manière faible et réversible en même temps que le substrat
• Cofacteurs inorganiques ----gardent le nom de cofacteurs
• Cofacteurs organiques non protéiques – ont le nom spécifique de coenzyme le reste de l’enzyme portant alors le nom d’apoenzyme
3)Les inhibiteurs enzymatiques
Substances bloquant de manière sélective des enzymes spécifiques
• Fixation à l’enzyme covalente et irréversible
• Fixation faible réversible
o Inhibition compétitive
o Inhibition non compétitive
o Inhibition mixte
3)Régulateurs allostériques-régulation allostérique
Ressemble à l’inhibition réversible et non compétitive mais peut également être une activation. La molécule régulatrice se fixe à un site propre différent du site actif de l’enzyme
• Inhibition
• Activation
• Rétro-inhibition
Activation et inhibitions allostériques
Les enzymes fonctionnant de manière allostérique sont constituées, en générale de deux ou plusieurs sous unités constitués de chaines polypeptidiques ; elles e présentent le plus souvent par paires identiques. Chaque sous-unité possède son propre site actif. Le complexe oscille entre une conformation active et une conformation inactive. Dans les cas simples, la molécule régulatrice activatrice ou inhibitrice se fixe à son site parfois appelé site allostérique, ce site est souvent placé à la limite entre deux sous unités.
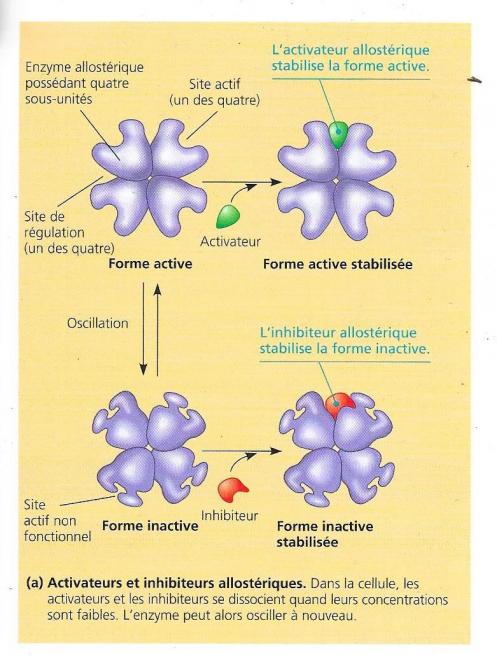
A son site de régulation :
- Un activateur stabilise la conformation qui a des sites actifs fonctionnels
- Un inhibiteur stabilise la conformation qui a des sites actifs non-fonctionnels.
Les sous-unités d’une enzyme allostérique s’articulent de telle sorte qu’un changement qui intervient dans la conformation d’une sous-unité se communique aux autres sous-unités. Ainsi, la fixation d’une seule molécule d’activateur ou d’inhibiteur à un site allostérique modifie la conformation du complexe protéique enzymatique et donc de ses sites actifs. La fluctuation des concentrations des régulateurs peut enchaînement complexe dans l’activité des enzymes cellulaires.
Ainsi les produit de l’hydrolyse de l’ATP, ADP et Pi contribuent par leurs effets sur des enzymes clé à la bonne circulation sur les voies anaboliques et cataboliques. La liaison allostérique de l’ATP à certaines enzymes cataboliques réduit l’affinité de ces enzymes et par le fait même réduit leur activité en réduisant de même l’activité pour leur substrat. L’ADP quant à lui agit comme activateur de ces mêmes enzymes. Ces processus sont logiques car un excès d’ATP limitera sa propre synthèse , si la production d’ATP est trop lente par rapport aux synthèses qui en ont besoin, l’ADP va s’accumuler et de ce fait activer la production de cet ATP. Par contre si la production d’ATP excède la demande pour les processus de l’anabolisme, le catabolisme producteur de cet ATP est ralenti à mesure que l’ATP s’accumule. En effet comme nous l’avons mentionné ci-dessus, l’ATP inhibe le fonctionnement de certaines enzymes du catabolisme. L’ATP et l’ADP ont également un rôle clé sur le fonctionnement de certaines voies anaboliques de synthèse. La gestion de la production de l’ATP par les voies du catabolisme est essentielle pour la vie. C’est ainsi que les enzymes allostériques sont fondamentales dans la régulation de tout le métabolisme.
Notons un autre mécanisme de régulation allostérique qui consiste en l’activation par le substrat même sur la forme moins active de l’enzyme..
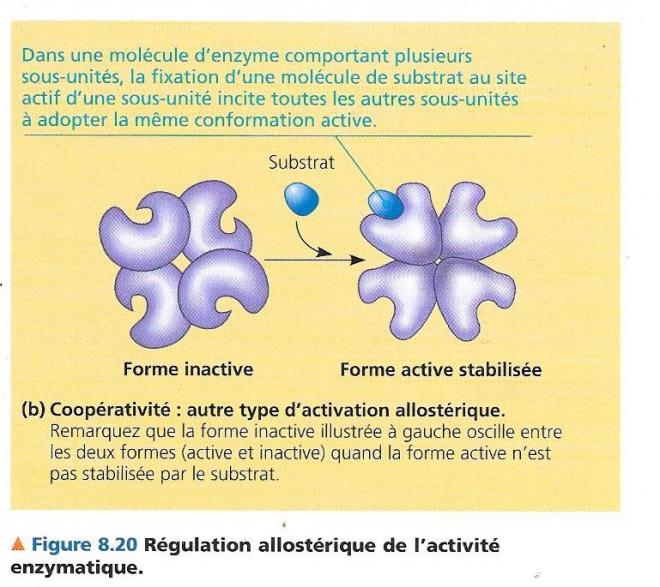
La fixation du substrat modifie l’ensemble de la configuration de l’enzyme à plusieurs sous-unités, ce qui signifie que l’activation par le substrat d’un seul site actif se communique à l’ensemble des sous-unités de l’enzyme. Ce mécanisme est appelé coopérativité.
La rétro-inhibition
Lorsque, comme nous venons de l’évoquer, l’ATP inhibe une enzyme de manière allostérique dans une voie de synthèse de cet ATP, le phénomène s’appelle rétro-inhibition, un des mécanismes principaux de régulation métabolique. La rétro-inhibition est la fermeture d’une voie métabolique par l’action de son produit final qui inhibe une enzyme de cette voie. La figure suivante montre ce type de régulation pour une voie à 5 étapes.
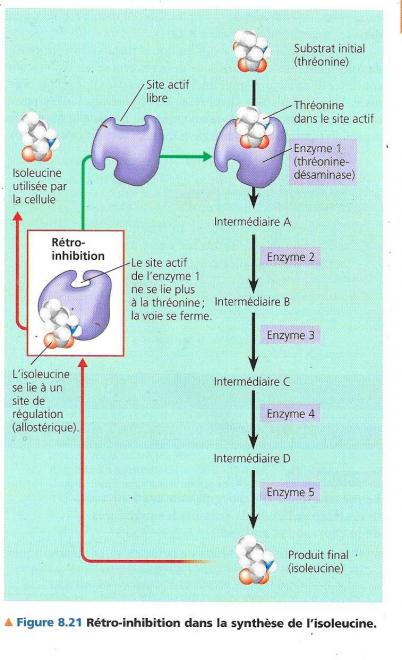
La voie montrée dans la figure est celle que certaines cellules utilisent pour synthétiser l’isoleucine à partir à partir de la thréonine, un autre acide aminé. En s’accumulant, l’isoleucine qui est le produit final inhibe sa propre synthèse. C’est possible parce qu’elle constitue un inhibiteur allostérique de l’enzyme qui catalyse la toute première étape de la voie. La rétro-inhibition empêche la cellule de gaspiller ses ressources chimiques et son énergie en produisant plus d’isoleucine qu’il n’en faut.
III.5.5.3 L’organisation spécifique des enzymes dans la cellule.

eucaryotes les enzymes de la respiration cellulaire aérobie logent dans la mitochondrie .
QUESTIONS GENERALES
- En quoi le second principe de la thermodynamique contribue-t-il à expliquer la diffusion d’une substance au travers d’une membrane ?
- Quel lien existe-t-il entre énergie et travail
- Décrivez les formes d’énergie qui se trouvent dans une pomme qui pousse dans un arbre, tombe et est digérée par un organisme qui l’a mangée ;
- La respiration cellulaire consomme du glucose riche en énergie libre et libère du CO2 et de l’eau pauvres en énergie libre, la respiration cellulaire est-elle un processus spontané ou non-spontané, endergonique ou exergonique, qu’arrive-t-il à l’énergie libérée par le glucose ?
- Un des processus importants du métabolisme est le transport d’ions H+ au travers une membrane, pour établir un gradient de concentration. Dans certaines conditions, les ions H+ retraversent la membrane et atteignent une concentration égale de chaque côté. Dans quelles conditions ces protons H+ peuvent-il exercer un travail dans ce système ?
- Dans la plupart des cas, comment l’ATP transfère-t-il de l’énergie d’un processus exergonique à un processus endergonique dans la cellule ?
- Soit deux groupes réactionnels : a) Acide glutamique + ammoniac + ATP, b) Glutamine + ADP + Pi, lequel des deux groupes a le plus d’énergie libre ?
- De nombreuses réactions spontanées sont lentes, pourquoi ne se réalisent -elles pas de manière instantanée ou presque ?
- Expliquez pourquoi les enzymes agissent seulement sur des substrats très spécifiques ?
- Le malonate est un inhibiteur compétitif de l’enzyme succinate déshydrogénase, décrivez comment le malonate empêche l’enzyme d’agir sur son substrat, qui est habituellement le succinate ?
Comment un activateur et un inhibiteur peuvent-ils avoir un effet différent sur une enzyme dont la régulation est allostérique ?
Date de dernière mise à jour : 22/12/2018
Ajouter un commentaire
