- Accueil
- D.Sciences biologiques
- III.Biologie générale
- 2. Organisation chimique fondamentale de la vie
- 2. L'eau
2. L'eau
1.2 La singularité vitale de l'eau
1.2.1 La molécule qui permet toute forme de vie .
La vie sur notre planète a débuté dans l'eau, et elle y a évolué pendant trois milliards d'années avant de gagner la terre ferme . Aujourd'hui encore, la vie , même terrestre , demeure dépendante de l'eau . Tous les organismes vivants ont besoin d'eau plus que de toute autre substance . Les humains par exemple , peuvent survivre pendant plusieurs semaines sans nourriture , mais ils ne peuvent vivre sans eau qu'environ une semaine . Les molécules d'eau participent à de nombreuses réactions chimiques nécessaires à la vie . La plupart des cellules baignent dans cette substance ; en fait, les cellules contiennent de 70 à 95 % d'eau environ. l'eau recouvre également les trois quarts de la surface de la terre . Bien qu'elle existe surtout sous forme liquide, on la trouve aussi sous forme de glace et de vapeur. C'est la seulme substance courante qui existe dans l'environnement naturel à l'état solide, liquide et gazeux. Si la terre est habitable , c'est avant tout en raison de l'abondance de l'eau . Dans son livre classique intitulé The fitness of de environement, l'écologiste Lawrence Henderson met en évidence l'importance de l'eau pour la vie tout en reconnaissant que la vie s'adapte à son environnement grâce à la sélection naturelle. Henderson fait valoir que, pour exister , la vie doit d'abord trouver un environnement accueillant . Dans ce chapitre nous allons voir comment la structure d'une molécule d'eau rend possible la formation de liaisons chimiques faibles avec d'autres molécules , y compris d'autres molécules d'eau . Cette capacité est à l'origine des propriétés particulières responsable de l'établissement et du maintien de la vie sur notre planète .
1.2.2 La polarité des molécules d'eau permet les liaisons hydrogène
L'eau fait tellement partie de notre existence qu'il nous est facile d'oublier qu'il s'agit d'une substance exceptionnelle possédant des qualités extraordinaires . Le concept de l'émergence nous permet d'expliquer son comportement unique d'après la struicture et l'interaction de ses molécules. La molécule d'eau est très simple . Elee est constituée de deux atomes d'hydrogène et d'un atome d'oxygène unis par des liaisons covalentes simples . L'oxygène étant plus électronégatif que l'hydrogène , les électrons mis en commun dans les liaisons covalentes passent plus de temps aux environs de l'atome d'oxygène . Autrement dit , les liaisons covalentes qui unissent une molécule d'eau sont polaires . La molécule d'eau , qui a à peu près la forme d'un V évasé, est une molécule polaire, ce qui signifie que ses pôles opposés présentent des charges opposées : la région de la molécule occupée par l'oxygène possède une chgarge partielle négative ( ð = -1 ) et les régions où se trouvent les atomes d'hydrogène ont une charge partielle positive (ð = +1 )
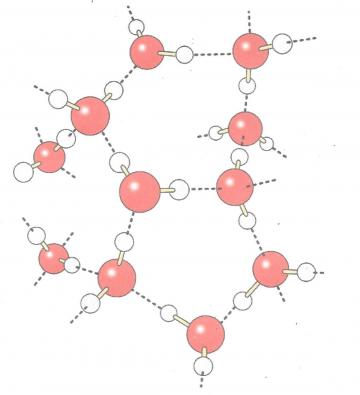 Pointillés : liaisons hydrogène, rouge : oxygène, blanc : hydrogène
Pointillés : liaisons hydrogène, rouge : oxygène, blanc : hydrogène
Fig 1 Les régions chargées d'une molécule d'eau polaire subissent l'attraction des régions de charges opposées des molécules voisines . Chaque molécule peut former des liaisons hydrogènes avec plusieurs autres molécules , et ces associations changent constamment . Dans une eau dont la température est de 37 °C ( soit la température du corps humain ), environ 15 % des molécules forment à tout moment quatre liaisons intermoléculaires ; ces groupements sont éphémères ( ils ne durent qu'une dizaine de picosecondes)
L'eau a des propriétés singulières qui résultent de l'attraction électrique qui pousse ses molécules polaires l'une vers l'autre. L'atome d'hydrogène (de charge partielle positive) d'une molécule subit l'attraction de l'atome d'oxygène ( de charge partielle négative ) de la molécule voisine . Il se forme alors une liaison hydrogène entre les deux molécules ( fig 1 ) . Dans un échantillon d'eau liquide , de nombreuses molécules sont à tout moment unies de cette façon, bien que les interactions entre elles changent constamment . Les liaisons hydrogènes qui agencent les molécules ont une structure organisée , donnent à l'eau ses qualités extraordinaires
1.2.3 Quatre propriétés de l'eau contribuent à maintenir l'environnement terrestre propice à la vie
a) La cohésion
Les liaisons hydrogène font en sorte que les molécules d'eau se maintiennent à proximité les unes des autres. Lorsque l'eau est à l'état liquide , ses liaisons hydrogène sont très fragiles . Leur force représente environ le vingtième de celle des liaisons covalentes . Elles se forment, se brisent et se reforment à une fréquence très élevée . chacune d'elles ne dure que quelques billionièmes de secondes ( 10 -12 ) , mais les molécules établissent constamment de nouvelles liaisons entre elles . En conséquence, en tout temps, un bon pourcenhtage des molécules d'eau sont liées à leurs voisines , ce qui rend l'eau plus structurée que la plupart des autres liquides . Prises collectivement , les liaisons hydrogène maintiennent ensemble les molécules d'eau , un phénomène appelé cohésion .
Dans les plantes , la cohésion assurée par les liaisons hydrogène contribue au transport de l'eau et des nutriments en contrant la force de gravitation . Comme nous aurons l'occasion de le voir , l'eau atteint les feuilles en se déplaçant dans un réseau de cellules conductrices depuis les racines. L'eau qui s'évapore d'une feuille est remplacée par l'eau des nervures . Grâce à la force des liaisons hydrogène , les molécules d'eau sortant des nervures attirent les molécules d'eau situées plus bas . Cette traction vers le haut se transmet tout le long des cellules conductrices jusqu'à la racine . quand à l'adhérence , issue de l'attraction mutuelle entre deux molécules polaires de substances différentes, elle joue aussi un rôle dans le transport de l'eau : celle-ci adhére à la paroi des cellules qui forment les vaisseaux conduisant la sève , ce qui lui permet de contrer la force de gravitation . Cohésion, adhérence et tension superficielle se combinent et permettent à l'eau d'atteindre les sommets des plus hauts arbres , comme certains Douglas taxifoliésde la côte ouest de l'Amérique du nord , qui mesurent plus de 10 m .
La tension superficielle , une force résultant de la cohésion , exprime la difficulté d'étirer ou de briser la surface d'un liquide . La tension superficielle est plus grande dans l'eau que dans la plupart des autres liquides ; seul le mercure a une valeur plus élevée. . A la surface de l'eau les molécules sont attirées grâce aux liaisons hydrogène , par les molécules situées en dessous et de chaque côté d'elles ; cela produit une sorte de pellicule invisible qui occupe la plus petite surface possible . Nous pouvons observer son effet en remplissant un verre un peu plus qu'à ras bord : elle donne au volume d'eau excédentaire la forme d'un dôme qui retient l'eau au dessus du bord . C'est également elle qui rend certains animaux capables de se tenir , de marcher ou de courir sur l'eau sans en briser la surface.
b) La stabilisation de la température
Tout ce qui se déplace possède de l'énergie cinétique, soit l'énergie du mouvement , Les atomes et les molécules ont également de l'énergie cinétique , parce qu'ils bougent continuellement , bien qu'ils ne suivent aucune direction particulière. Plus une molécule se déplace rapidement , plus son énergie cinétique est grande . La chaleur est une mesure de la quantité totale d'énergie cinétique des molécules d'un corps en mouvement . La température mesure l'intensité de la chaleur due à l'énergie cinétique moyenne des molécules d'un corps quelconque . Lorsque la vitesse moyenne des molécules augmentent , une hausse de température est accusée et indiquée par un thermomètre. La chaleur et la température sont liées mais il ne s'agit pas de la même chose . Un nageur qui traverse la manche possède une température plus élevée que celle de l'eau , mais l'océan contient beaucoup plus de chaleur que lui en raison de son volume.
Chaque fois que deux corps de températures différentes s'approchent l'un de l'autre , la chaleur de celuiqui est le plus chaud , se transmet à celui qui est le plus froid , jusqu'à ce que les deux atteignent la même température . Les molécules du corps froid accélèrent donc au détriment de l'énergie cinétique du corps chaud . Ainsi, un glaçon refroidit une boisson non pas en lui donnant du froid , mais en absorbant la chaleur du liquide à mesure que la glace fond.
Nous utiliserons l'échelle Celcius ( °C) pour indiquer la température . Au niveau de la mer l'eau gèle à 0°C et bout à 100 °C . La température du corps humain se situe autour de 37 °C ; une température ambiante agréable varie de 20 à 25 °C
L'unité de mesure servant à quantifier toute énergie est le joule ( j ) . Mais dans les domaines de la médecine et de la diététique , notamment, l'usage de la calorie prend encore beaucoup de place . La calorie ( cal ) est une unité de mesure qui correspond à la quantité de chaleur nécessaire pour élever de 1°C la température de 1 g d'eau, et réciproquement , la quantité de chaleur libérée par i g d'eau quand sa température diminue de 1°C. Une Kilocalorie ( kcal ) ( ou 1000 cal ) est la quantité de chaleur requise pour élever de 1°C la température de 1 kg d'eau. 5 les "calories" qu'on trouve sur les emballages d'aliments sont en fait des " kilocalories ") . Un Joule équivaut à 0,239 calories ; une calorie équivaut à 4,184 joules.
C) Chaleur spécifique élevée de l'eau
La capacité de l'eau à stabiliser la température ambiante découle de sa chaleur spécifique relativement élevée. La chaleur spécifique d'une substance représente la quantité de chaleur en joules absorbée ou perdue par 1 g de cvette substance pour changer sa température de 1°C. La chaleur spécifique de l'eau correspond à 4,184 joules par gramme par degré Celcius ; on écrit de façon abrégée 4,184 j/g/°C. Par ailleurs, l'éthanol contenu dans les boiussons alcoolisées a une chaleur spécifique de 2,51 j/g/°C, c'est à dire qu'il faut seulement 2,51 joules pour augmenter de 1°C la température de 1g d'éthanol.
L'eau ayant une chaleur spécifique plus élevée que la plupart des autres substances ( l'ammoniaque liquide est la seule substance naturelle ayant une valeur plus élevée ) , sa température varie moins quand elle absorbe ou libère une certaine quantité de chaleur . Par exemple , la raison pour laquelle vous pouvez vous brûler les doigts sur la popignée métallique d'une casserole quand l'eau dans le contenant est encore tiède, c'est que la chaleur spécifique de l'eau est dix fois plus élevée que celle du fer : cela signifie que seulement 0,4 joules ( 4,184/10 ) est requis pouir élever de 1°C la température de 1 g de fer. On peut concevoir la chaleur spécifique d'une substance comme une mesure de sa résistance aux changement de température quand elle absorbe ou libère de la chaleur . L'eau résiste aux variations de température ; quand sa température change , elle absorbe ou perd une quantité de chaleur relativement grande pour chaque degré de changement.
Comme pour bon nombre de ses propriétés, ce sont les liaisons hydrogène de l'eau qui lui donnent une chaleur spécifique élevée. De la chaleur doit être absorbée pour que celles-ci se brisent ; Inversément, il se forme un dégagement de chaleurs lorsque celles)ci se forment . Une quantité de chaleur de 1 joule provoque une variation relativement petite de la température de l'eau . Ce phénomène s'explique par le faiut qu'une bonne partie de l'énergie thermique sert à rompre les liaison hydrogène avant que le reste fournisse aux molécules d'eau l'énergie nécessaire au mouvement . De plus lorsque la température de l'eau baisse légèrement , beaucoup d'autres liaisons hydrogène se forment , libérant une quantité considérable d'énergie sous forme de chaleur.
Quelle est l'importance de la chaleur spécifique élevée de l'eau pour la vie sur terre ?Une grande étendue d'eau poeut absorber et emmagasinner une énorme quantité de chaleur solaire durant le jour et au cours de l'été , tout en se réchauffant de quelque degrés seulement . La nuit et au cours de l'hiver elle se refroidit graduellement et peut réchauffer l'air . C'esdt pourquoi les régions côtières possèdent généralement des climats plus doux que les régions intérieures. La chaleur spécifique élevée de l'eau tend également à stabiliser la température des océans, créant un environnement favorable à la vie marine . L'eau, qui recouvre la majeure partie de de la surface de la terre , permet en fait de maintenir la température des continents et des océans dans des limites compatibles avec la vie . De même , comme ils se composent principalement d'eau, les organismes résistent plus facilement aux variations de températures que s'ils étaient formés d'un liquide possédant une chaleur spécifique plus faible.
d) Le refroidissement par vaporisation
Dans tout liquide, les molécules demeurentgroupées parce qu'elles s'attirent mutuellement. Celles qui se déplacent assez rapidement pour vaincre cette attraction peuvent s'échapper du liquide et se mélanger à l'air sous forme de gaz . Ce passage à l'état liquide à l'état gazeux s'appelle vaporisation ou évaporation. Rappelez que la vitesse du mouvement moléculaire varie et que la température constitue constitue une mesure de l'énergie cinétique moyenne des molécules. Même à une basse température , les molécules les plus rapides peuvent s'échapper dans l'air. Il se produit donc une vaporisation à toutes les températures ; par exemple , l'eau contenue dans un verre placé à la température ambiante finit par se vaporiser. Si l'on chauffe un liquide , l'énergie cinétique moyenne des molécules augmente et il se vaporise plus rapidement.
La chaleur de vaporisation est la quantité de chaleur que 1 g de liquide doit absorber, à une température constante , pour passer de l'état liquide à l'état gazeux. L'eau possède une chaleur de vaporisation plus élevée que la plupart des autres liquides , pour les mêmes raisons qu'elle possède une chaleurspécifique élevée. La vaporisation d'un gramme d'eau à 25°c exige 2,26 Kj de chaleur soit presque le double de la quantité nécessaire pour vaporiser un gramme d'alcool ou d'ammoniac. Ce sont les liaisons hydrogène qui donnent à l'eau une chaleur de vaporisation élevée. Celles-ci doivent être rompues avant que les molécules quittent le liquide. La chaleur de vaporisation élevée de l'eau contribue à tempérer le climat de la terre. Une quantité considérable de la chaleur absorbée par les mers tropicales est utilisée et transférée à l'air durant la vaporisation de l'eau de surface . Puis, lorsqu'il se déplace vers les ,pôles , l'air tropical humide libère cette chaleur en se condensant et en formant de la pluie .
Au cours de la vaporisation d'une substance , la surface du liquide résiduel refroidit . Ce refroidissement par vaporisation se produit parce que les molécules les plus " chaudes " , celles qui possèdent l'énergie cinétique la plus grande , sont les plus susceptibles de s'échapper sous forme de gaz. C'est comme si on envoyait les 100 coureurs les plus rapides d'une école dans une autre ; la vitesse moyenee des élèves qui restent diminueraient. Le refroidissement par vaporisation contribue à stabiliser la température des lacs et des étangs . Il empêche également la surchauffe des organismes terrestres . Par exemple la vaporisation de l'eau des feuilles d'une plante empêche les tissus des feuilles de devenir trop chauds au soleil . De même par une chaude journée ou lors d'un exercice intense , la vaporisation de la sueur sur la peau d'une personne refroidit la surface du corps et aide à ,prévenir l'hyperthermie . Lorsque le taux d'humidité est élevé au cours d'une journée chaude , nous avons plus chaud , parce que la vapeur contenue dans l'air empêche la vaporisation de la sueur à la surface de la peau.
1.2.4 L'isolation des étendues d'eau par la glace qui flotte
L'eau est une des rares substances qui possèdentune masse volumique plus petite à l'état solide qu'à l'état liquide . En d'autres termes , la glace flotte à la surface de l'eau liquide . Alors que d'autres substances se contractent en se solidifiant, l'eau se dilate. Ce comportement singulier résulte encore une fois, des liaisons hydrogène . A des températures supérieures à 4°C, l'eau se comporte comme les autres liquides ; elle se dilate quand elle se réchauffe et elle se contracte lorsqu'elle se refroidit . Elle commence à geler lorsque ses molécules ne se déplacent plus avec suffisamment de vigueur pour briser leurs liaisons hydrogène. . Lorsque la température atteint 0°C, l'eau forme un réseau cristallin, chacune de ses molécules demeurant liée à quatre de ses voisines .
Fig 2 : structure cristalline de la glace
Les liaisons hydrogène gardent les molécules assez éloignées les unes des autres pour que la masse volumique de la glace soit inférieure d'environ 10% ( il y a 10 ° moins de molécules pour un même volume ) à celle d'eau liquide à 4°C . Lorsque la glace absorbe suffisammentde de chaleur pour que sa température grimpe au dessus de 0 , les liaisons hydrogène entre les molécules se rompent . A mesure que le cristal s'affaisse , la glace fond , et les molécules se rapprochent les unes des autres. L'eau atteint sa masse volumique maximale à 4°C et commence à se dilater de nouveau en raison de la vitesse accrue de ses molécules . N'oubliez pas toutefois que, même dans l'eau liquide , nombre de molécules sont maintenues ensemble par des liaisons hydrogène. Cependant, celles-ci sont transitoire : elles se brisent et se reforment constamment. La flottabilité de la glace causée par la dilatation de l'eau à l'état solide contribue grandement à rendre l'environnement propice à la vie. Si la glace ne flottait pas , les étangs, les lacs et même les océans gèleraient complètement à poartir du fond ; la vie sur terre telle que nous la connaissons n'existerait pas . En été seuls quelques centimètres à la surface de l'eau dégèlerainet, comme des expérience avec des réservoirs d'eau l'ont démontré . Au lieu de cela quend une étendue profonde refroidit, la glace qui flotte isole l'eau liquide qui se trouve en dessous et l'empêche de geler , rendant possible l'existance de la vie sous la surface . Si l'étendue d'eau était plutôt une étendue d'huile , elle finirait par geler entièrement , car l'huiule n'a pas la flottabilité de l'eau à l'état solide.
1.2.5 Le solvant fondamental de la vie
Si l'on met un cube de sucre dans un verre d'eau , il se dissout graduellement. Une fois que cela s'est produit, on obtient un mélange homogène de sucre et d'eau : la concentration du sucre dissous est la même dans tout le verre. Un liquide formé d'un mélange homogène de deux ou de plusieurs substances s'appelle solution. L'agent dissolvant d'une solution est le solvant, et la substance dissoute le soluté . Dans l'exemple si-dessus , l'eau constitue le solvant, et le sucre le soluté . Une solution aqueuse est une solution dont l'eau est le solvant. Au Moyen Age, les alchimistes essayaient de trouver un solvant universel, qui pourrait tout dissoudre . Ils se sont rendus compte de l'efficacité sans égal de l'eau . Cependant l'eau n'est pas un solvant universel ; autrement nous ne pourrions l'entreposer dans un aucun récipient , pas même dans nos cellules . Il reste que c'est un solvant très polyvalent grâzce à la polarité de ses molécules. Supposons , par exemple ; que nous placions dans l'eau un cristal de chlorure de sodium ( NaCl ), un composé ionique. Les ions sodium et chlorure qui se trouvent à la surface sont exposé au solvant . Ces ions ainsi que les molécules d'eau subissent une attraction électrostatique mutuelle . Le pôle négatif de l'atome d'oxygène des molécules d'eau s'associe au cation sodium , tandis que le pôle positif des atomes d'hydrogène subit l'attraction des atomes d'hydrogène . Résultat : les molécules d'eau entourent chacun des ions sodium et chlorure , les séparant les uns des autres et formant un écran entre eux. Le processus par lequel une enveloppe de molécules d'eau entoure chaque ion dissous s'appelle hydratation. L'eau pénètre petit à petit à l'intérieur du cristal de sel et finit par dissoudre tous les ions . La solution qui en résulte est formée de deux solutés , les cations sodium et les anions chlorure, mélangés de façon homogène avec l'eau, le solvant. L'eau de mer par exemple, contient une grande variété d'ions en solution, à l'instar des cellules vivantes.
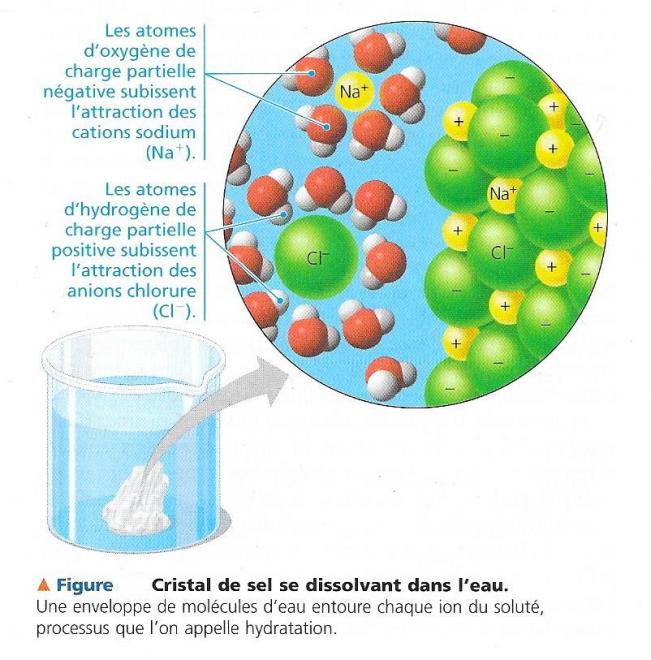 Fig 3
Fig 3
Les composés n'ont pas besoin d'être ioniques pour se dissoudre dans l'eau; ceux qui sont composés de molécules polaires , comme les sucres , sont aussi hydrosolubles . Ils se dissolvent quand les molécules d'eau entourent chacune de leurs molécules . Même les grosses molécules comme certaines protéines peuvent se dissoudre dans l'eau si leur surface présentent des régions ioniques et polaires . De nombreux types de composés polaires se dissolvent ( en même temps que les ions ) dans l'eau contenue dans le sang , la sève ou le liquide intracellulaire , ce qui fait de l'eau un excellent agent de transport entre les différeentes parties d'un organisme . L'eau est le solvant fondamental de la vie .
1.2.6 Substances hydrophyles et substances hydrophobes.
Qu'elle soit ionique ou polaire , toute substance ayant une affinité avec l'eau est dite hydrophyle . Certaines molécules sont hydrophyles sans pour autant se dissoudre. Par exemple, certaines composantes des cellules sont des molécules très grosses ( ou des complexes de nombreuses molécules ) , de sorte qu'elles ne se dissolvent pas . Elles demeurent plutôt en suspension dans le liquide cellulaire aqueux . Un tel mélange constitue un exemple de colloïde, une suspension stable de fines particules dans un liquide . Le coton, un produit végétal , est également une substance hydrophyle qui ne se dissout pas. Il s'agit d'un composé constitué de molécules géantes de cellulose qui comportent de nombreuses charges partielles positives et négatives associées à des liaisons polaires . L'eau adhère aux fibres de cellulose . C'est pourquoi une serviette de cotton fait très bien l'affaire pour se sècher après la douche, sans pour autant se dissoudre dans la machine à laver . La cellulose est également présente dans la paroi des cellules conductrices des plantes où l'eau circule , l'eau adhère à ces parois hydrophyles , et cela facilite le transport.
Evidemment il existe des substances qui n'ont aucune affinité avec l'eau . En fait celles qui ne sont ni ioniques ni polaires semblent la repousser : elles sont dites hydrophobes . L'huile végétale et l'eau ne se mélangent pas. Le comportement hydrophobe des molécules d'huile résulte de la prédominance des liaisons covalentes très peu polaires unissant le carbone et l'hydrogène , qui se répartissent les électrons presque également . Certaines molécules hydrophobes apparentées aux huiles sont des constituants importants des membranes cellulaires ( imaginez ce qui arriverait à une cellule si sa membrane se dissolvait dans les milieux aqueux extracellulaires et intracellulaires ).
1.2.7 Les concentrations des solutés dans les solutions aqueuses
La plupart des réactions chimiques qui se produisent chez les êtres vivants mettent en jeu des solutés dissous dans de l'eau . Il faut connaître le nombre d'atomes et de molécules en jeu si l'on veut comprendre les réactions chimiques . Il est donc important d'apprendre à calculer les concentrations des solutés en solution aqueuse ( le nombre de molécules de soluté dans un certain volume de solution. Lorsqu'on réalisde des expériences, on utilise la masse pour calculer le nombre de molécules. Comme on connaîtla masse de chaque atome dans une molécule donnée, il est possible de calculer sa masse moléculaire , la somme des masses de tous les atomes dans une molécule . Par exemple calculons la masse moléculaire du sucre granulé ( saccharose ), dont la formule moléculaire est C12H22O11 . Si on arrondit les nombres d'unité de masse atomique, la masse d'un atome de carbone est 12; Celle d'un atome d'hydrogène est 1 et celle d'un atome d'oxygène est 16. Le saccharose a donc une masse moléculaire de 342 unités de masse atomique . Comme il est peu commode de peser de petits nombres de molécules , on mesure habituellement les substances en unités appelées moles . Tout comme une douzaine signifie 12 objets, une mole ( mol )représente un nombre exact d'objets, soit 6,02 x 10 23 , appelé nombre d'Avogadro. A cause de lka façon dont le nombre d'Avogadro et les unités de masse atomique ont été définis au départ , il y a 6,022 1023 unités de masses atomique dans un gramme , ce qui est important parce qu'après avoir déterminé la masse moléculaire d'une molécule comme le saccharose, on peut utiliser le même nombre ( 342 ) mais l'exprimer en grammes pour représenter la masse de 6,022x1023 molécules de saccharoses, ou de mole de saccharose. On appelle parfois ce nombre la masse molaire. Par conséquent, pour obtenir une mole de saccharose, on pèse 342 g.
L'utilisation des moles pour mesurer des substances chimiques présente l'avantage suivant : une mole d'une substance donnée possède exactement le même nombre de molécules qu'une mole d'une autre substance . Si la masse moléculaire d'une substance A est de 342 unités de mlasse atomique et celle d'une substance B de 10 unités de masse atomique , alors 342 g de A contiendront le même nombre de molécules que 10 g de B. Une mole d'éthanol ( C2H6O ) contient également 6,022x1023 molécules , mais elle ne pèse que 46 g , parce que ses molécules sont plus petites que celles du saccharose . La mesure en môle permet également aux scientifiques travaillant dans des laboratoires de combiner des substances en respectant des proportions définies de molécules. Comment préparer un litre (L) d'une solution formée de 1 mole de saccharose dissoute dans de l'eau ? Il faut d'abord peser 342 g de saccharose , puis ajouter graduellement de l'eau dans le contenant tout en agitant celui-ci jusqu'à dissolution complète du sucre . On verse par la suite suffisamment d'eau pour amener le volume total de solution à un litre. A ce stade on a une solution de saccharose de 1 mol/L. La concentration molaire volumique (c), soit le nombre de môle de soluté par litre de solution , est l'unité de concentration la plus couramment employéeen biologie dans le cas de solutions aqueuses.
1.2.8 La dissociation des molécules d'eau crée des conditions acides ou basiques qui influent sur les organismes vivants
Il arrive parfois qu'un atome d'hydrogène mis en commun par deux molécules d'eau ( liaison hydrogène ) se déplace d'une molécule à l'autre . Lorsque cela se produit, l'atome d'hydrogène abandonne son électron, et ce qui est transféré , c'est un seul proton portant une charge de +1, ou ion hydrogène , que nous identifierons désormais par H+ . La molécule d'eau qui perd un proton devient un ion hydroxyde (OH-), dont la charge est de -1. Le proton se lie à l'autre molécule d'eau , formant ainsi un ion hydronium ( ou ion oxonium , H3O+ ). Nous pouvons représenter cette réaction chimique de la façon suivante :
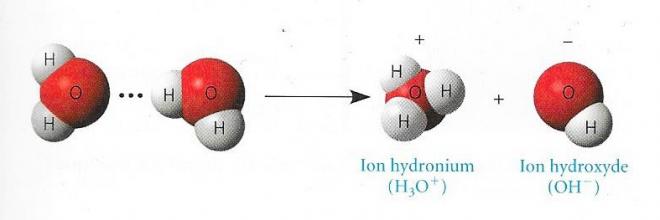 Fig 4
Fig 4
Cette illustration montre bien ce qui se produit réellement . Il est toutefois plus simple de se représenter cette réaction comme la dissociation d'une molécule d'eau en un proton et en un ion hydroxyde.
H2O <=> H+ + OH-
Comme l'indique la flèche double , il s'agit d'une réaction réversible . Celle-ci atteint un état d'équil ibre dynamique lorsque l'eau se dissocie à la même vitesse qu'elle se reforme à partir de H+ et de OH- . Au point d'équilibre, la concentration molaire volumique des molécules d'eau excède énormément celles de H+ et de OH-. En fait, dans l'eau pure , seulement une molécule d'eau sur 554 millions se dissocie. La concentration volumique molaire de chaque ion contenu dans l'eau pure est de 10-7 moles par litre ( à 25°C). Cela signifie qu'un litre d'eau pure contient un 10 millionième de mole de proton et un nombre égal d'ions hydroxyde. Bien qu'elle soit réversible et rare sur le plan statistique, la dissociation de l'eau joue un rôle crucial dans la chimie de la vie . Les protons et les ions hydroxyde sont très réactifs. Une variation de leur concentration molaire volumique peut perturber dramatiquement les protéines et les autres molécules complexes d'une cellule. Comme nous l'avons vu, les concentrations molaires volumiques de H+ et de OH- sont égales dans l'eau pure, mais l'ajout d'acides ou de bases perturbe cet équilibre. On utilise une échelle de pH pour décrire le degré d'acidité ou de basicité d'une solution . Plus loin vous en apprendrez davantage sur les acides et les bases et le pH ; vous saurez également pourquoi une variation de pH peut porter atteinte aux organismes.
a) Les effets des variations de pH
Avant d'aborder l'échelle de pH, voyons ce que sont les acides et les bases , et comment ils interagissent avec l'eau.
- Acides et bases
Qu'est-ce qui peut provoquer un déséquilibre dans les concentrations molaires volumiques des ions H+ et OH- en solution aqueuse ? Lorsqu'elles se dissolvent dans l'eau , les substances dites acides augmentent le nombre des ions H+
. Un acide est une substance qui accroît le concentration molaire volumique des protons d'une solution . Par exemple , quand on met du chlorure d'hydrogène ( HCl ) dans de l'eau, les protons et les ions chlorure se dissocient :
HCl -----> H+ + Cl-
Cette deuxième source de H+ ( la dissociation de l'eau en est la première ) fournit un plus grand nombre d'ions H+ que d'ions OH- . Une telle solution est dite acide.
Inversément, une substance qui réduit la concentration molaire volumique des protons d'une solution est une base. Certaines bases réduisent la concentration molaire volumique des ions H+ en les acceptant directement . L'ammoniac ( NH3 ),par exemple agit comme une base quand le doublet d'électrons libres du dernier niveau électronique de l'azote attire un proton de la solution, ce qui donne un ion ammonium ( NH4+ )
NH3 + H+ <=====> NH4+,
D'autres bases réduisent indirectement la concentration molaire volumique des protons en se dissociant pour former des ions hydroxyde . Ces derniers se combinent avec les protons de la solution de la solution pour former de l'eau . L'hydroxyde de sodium est une base qui agit de cette façon ; elle se dissocie en ions dans l'eau :
NaOH ---------> Na+ + OH-
Dans les deux cas, la base réduit la concentration molaire volumique de H+ . Une solution dont la concentration molaire volumique de H+. Une solution dont la concentration molaire volumique de OH- est plus élevée que celle de H+ est dite basique . Une solution dont les concentrations molaires volumiques de H+ et de OH- sont équivalente est dite neutre.
Remarquez les flèches simples dans les réactions impliquant HCl et NaOH ; elles indiquent que ces composés se dissocient complètement quand on les mélange à l'eau , donc le chlorure d'hydrogène est un acide fort et l'hydroxyde de sodium une base forte Par contre l'ammoniac est une base relativement faible : les flèches doubles de la réaction indiquent que la liaison ou la libération du proton sont réversibles. En conséquence, à l'équilibre , le rapport entre NH4+ et NH3 est constant. Il existe également des acides faibles qui libèrent puis acceptent à nouveau des protons . L'acide carbonique en est un exemple ; cette substance exerce des fonctions essentielles dans de nombreux organismes .
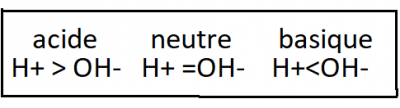
H2CO3 <================> HCO3- + H+
acide carbonique ion hydrogénocarbonate proton
L'équilibre favorise tellement la réaction vers la gauche , que lorsque l'on ajoute de l'acide carbonique à l'eau , seulement 1% de ses molécules se dissocient . Cela suffit pourtant à déplacer l'équilibre des ions H+ et OH- du point de neutralité.
b) Echelle de pH
Dans toute solution aqueuse à 25 °C, le produit des concentrations molaires volumiques de H+ et OH- est toujours de 10-14, il peut s'écrire ainsi :
[ H+ ] [OH-] = 10-14 (mol/L)2
Les crochets indiquent la concentration molaire volumique de la substance qu'ils renferment. Dans une solution neutre à 25°C , [H+] = 10-7 mol/L et [OH-] = 10-7 mol/L de sorte que le produit est 10-7 x 10-7 = 10-14 ( mol/L)2. Si on ajoute suffisamment d'acide à la solution pour porter [H+] à 10-5 mol/L, [OH-] diminue d'une quantité équivalente pour atteindre 10-9 mol/L ( 10-5 x 10-9 = 10-14 ). Cette relation constante explique le comportement des acides et des bases dans une solution aqueuse. Un acide ne fait pas qu'ajouter des protons à la solution; il enlève également des ions hydroxyde en raison de la tendance de H+ à se combiner avec OH- pour former de l'eau. Une base produit l'effet opposé : elle augmente le concentration molaire volumique de OH- tout en réduisant la concentration molaire volumique de H+ par la formation d'eau . Si l'on ajoute assez de base à une solution d'eau pour porter la concentration molaire volumique de OH- à 10-4 mol/L, cela aura pour effet de diminuer celle de H+ à 10-10 mol/L. Quand on connaît la concentration molaire volumique de H+ dans une solution aqueuse, on peut déduire la concentration molaire volumique de OH-, et inversément.
Etant donné que les concentrations molaires volumiques de H+ et de OH- peuvent varier d'un facteur pouvant atteindes 100 billions ( 10-14 ), les scientifiques ont élaboré un moyen plus commode que les moles par litre pour exprimer ce changement : l'échelle de pH . Elle réduit la plage des concentrations molaires volumiques de H+ et OH- au moyen de logarithmes, le pH ( pouvoir ou puissance hydrogène ) se définit comme le logarithme négatif à base 10 de la concentration molaire volumique des protons :
pH = -log [H+]
Par ailleurs on peut transformer le logarithme en exposant [H+] = 10-pH . Comme un exposant ne comporte jamais d'unité , toutes les valeurs de pH apparaissent sans unité. Une augmentation ( ou une diminution ) de "1" dans la valeur du pH correspond à des concentrations différentes de protons [H+] selon la valeur du pH de départ. Dans le cas d'une solution neutre, [H+] = 10-7 mol/L , ce qui donne :
pH = - log 10-7 = 7
Remarquez que le pH diminue à mesure que la concentration molaire volumique de H+ augmente. Notez également que, même si elle se base sur la concentration molaire volumique de H+, l'échelle de pH reflète également celle de OH-. Une solution dont le pH est de 10 possède une concentration molaire volumique de protons de 10-10 mol/L et une concentration molaire volumique de OH- de 10-4.
Le pH d'une solution neutre est 7, ce qui équivaut au milieu de l'échelle . Un pH inférieur à ce chiffre désigne une solution acide ; plus cette valeur est faible , plus la solution est acide. Le pH d'une solution basique est supérieur à 7. Le pH de la plupart des liquides biologiques se situe entre 6 et 8 . Il existe toutefois quelques exceptions comme le suc gastrique de l'estomac humain , fortement acide : son pH est d'environ 2. Il faut vous rappeler qu'une variation de un " degré" dans la valeur du pH représente une différence d'un facteur de 10 dans les concentrations molaires volumiques de H+ et OH- . C'est cette propriété mathématique qui permet de condenser l'échelle de pH . Ainsi une solution de pH 3 n'est pas deux fois mais mille fois plus acide qu'une autre de pH 6. Lorsque le pH d'une solution aqueuse change légèrement , les concentrations molaires volumiques de H+ et de OH- varient de façon importante.
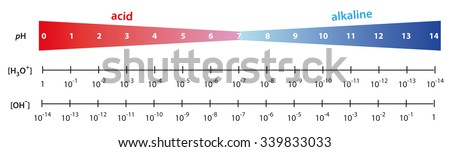
c) Les solutions tampons
La plupart des cellules ont un pH qui se situe autour de 7. Le moindre changement de leur pH peut s'avérer dommageable parce que les processus chimiques sont très sensibles aux variations des concentrations molaires volumiques des protons et des ions hydroxyde.
C'est grâce aux solutions tampons que le pH des liquides biologiques demeure à peu près constant malgré l'ajout d'un acide ou d'une base. Une solution tampon est une substancequi réduit au minimum la variation des concentrations molaires volumiques de H+ et de OH- dans une solution. Par exemple, des solutions tampons maintiennent le pH du sang humain très prés de 7,4. Une personne ne peut survivre plus de quelques minutes si le pH du sang chute à 7 ( neutre) ou grimpe à 7,8. En temps normal, le pouvoir tampon du sang empêche de telles variations dans le pH .
Les solutions tampons fonctionnent de la façon suivante : elles acceptent des protons quand la solution en renferme trop , et elles en donnent quand il n'y en a plus assez. La plupart d'entre-elles se composent d'un acide faible et de son sel ( une base ) , celui ci se combinant de façon réversible aux protons . Ils existe plusieurs solutions tampon qui contribuent à stabiliser le pH du sang et de nombreux autres liquides biologiques . L'une d'elle est l'acide carbonique , qui, comme nous l'avons mentionné , se dissocie pour produire un ion hydrogénocarbonate ( ou ion bicarbonate HCO3- ) et un proton (H+)
H2CO3 ( donneur de H+) <================> HCO3- ( accepteur de H+) + H+(proton)
---------> réaction à une hausse de pH
<------- réaction à une baisse de pH
L'équilibre chimique entre l'acide carbonique et l'ion hydrogénocarbonate agit comme un régulateur de pH . La réaction se déplace vers la gauche ou la droite lorsque d'autres processus qui ont lieu dans la solution ajoutent ou enlèvent des protons . Si la concentration molaire volumique de H+ dans le sang se met à baisser ( c'est à dire si le pH augmente), la réaction se déplace vers la droite ; l'acide carbonique se dissocie et libère des protons. Par contre , lorsque la concentration molaire volumique de H+ dans le sang augmente ( le pH diminue ) , la réaction se déplace vers la gauche : HCO3- agit alors comme une base et enlève des protons dans la solution pour former H2CO3 .
En fait, la solution tampon acide carbonique-hydrogénocarbonate se compose d'un acide et d'une base à l'état d'équilibre . La plupart des autres solutions tampons sont aussi des paires acide-base.
Date de dernière mise à jour : 24/03/2018
Ajouter un commentaire

