- Accueil
- D.Sciences biologiques
- III.Biologie générale
- 2. Organisation chimique fondamentale de la vie
- 1. Eléments chimiques
1. Eléments chimiques
I.L'organisation chimique fondamentale de la vie
I.1 Les fondements chimiques de la biologie.
Comme les autres animaux, les Coléoptères ont développé des structures et des mécanismes de défense contre leurs prédateurs. Le coléoptère bombardier ( Stenaptinus insignis ) qui vit au sol possède un mécanisme de défense particulièrement efficace contre les fourmis qui le harcèlent. Lorsqu'une fourmi s'approche de lui, il l'arrose d'un liquide brûlant sécrété par ses glandes abdominales. Ce liquide contient des substances chimiques irritantes, produites au moment de l'expulsion par une réaction fortement exothermique entre deux types de réactifs stockés séparément dans les glandes de l'animal . De plus il se produit en même temps un claquement sonore susceptible d'effrayer l'agresseur. L'étude du coléoptère bombardier nécessite qu'on recoure à plusieurs sciences . Les biologistes se spécialisent dans l'étude de la vie, mais , les organismes et le monde dans lequel ceux-ci évoluent découlant de la matière et de l'énergie, il leur est nécessaire d'utiliser fréquemment des concepts fondamentaux de chimie, de physique, ...
I.1.1 Les éléments et composés
La matière est formée d'éléments. Un élément est une substance impossible à décomposer en d'autres substances plus simples au cours de réactions chimiques. Les chimistes ont identifiés 92 éléments naturels, dont l'or, le cuivre, le carbone et l'oxygène. Ils ont attribué à chacun un symbole, le plus souvent constitué de la première ou des deux premières lettres de son nom. Quelques symboles dérivent de noms latins ou allemands ; par exemple celui du sodium est Na du mot latin natrium, alors que celui du tungstène est w , du mot allemand wolfram.
Un composé est une substance formée de deux ou plusieurs éléments combinés dans des proportions définies . Le sel de table est,par exemple du chlorure de sodium ( NaCl) ; il est composé de deux éléments sodium ( Na) et chlore ( Cl ) dans un rapport de 1:1. Le sodium pur est un métal alors que le chlore pur est un gaz toxique . Cependant une fois qu'ils sont liés chimiquement, ils forment un composé comestible . Cet exemple illutre bien le principe d'émergence : un composé possède des caractéristiques que n'ont pas ses éléments pris individuellement .
I.1.2 Les éléments chimiques essentiels à la vie
Environ 25 des éléments naturels sont essentiels à la vie. Quatre d'entre eux , soit le carbone ( C ), l'oxygène ( O ), l'hydrogène ( H ) et l'azote ( N), constituent à eux seuls 96 % de la matière vivante.Le phosphore (P), le soufre (S), le calcium (Ca), le potassium ( K ) et quelques autres éléments forment presque tout le reste de la matière d'un organisme ( 4%).
Eléments structurels entrant dans la composition du corps humain
| Symbole chimique | Element |
Numéro atomique ( voir plus loin ) |
Pourcentage de la masse corporelle |
|
O C H N Ca P K S Na Cl Mg |
Oxygène Carbone Hydrogène Azote Calcium Phosphore Potassium Soufre Sodium Chlore Magnesium |
8 6 1 7 20 15 19 16 11 17 12 |
65,0 18,5 9,5 3,3 1,5 1,0 0,4 0,3 0,2 0,2 0,1 |
fig 1
On compte encore d'autres éléments à l'état de traces ( moins de 0,01 %) : Bore ( Bo), Chrome (Cr), Cobalt ( Co), Cuivre ( Cu), Fluor ( F), Iode ( I ), Fer ( Fe ), Manganèse ( Mn), Molybdène ( Mb), Sélénium ( Se), Silicium ( Si ), Etain ( Sn), Vanadium ( V ) et Zinc ( Zn).
Les éléments qui entrent dans la composition d'un corps humain, ainsi que leur pourcentage de la masse corporelle figurent donc dans le tableau précédent. Ces pourcentages sont pratiquement les mêmes chez les autres organismes.
L'organisme a besoin de certains éléments appelés éléments traces . En quantités infimes, ils n'en sont pas moins essentiels. Quelques uns d'entre eux comme le fer (Fe) sont indispensables à toutes les formes de vie ; d'autres à quelques espèces seulement . Par exemple chez les vertébrés ( animaux dotés d'une colonne vertébrale ), l'Iode ( I) est un constituant essentiel d'une hormone produite par la glande thyroïde. Un apport quotidien de 0,15 mg d'Iode, suffit au fonctionnement de la thyroïde humaine, mais un régime alimentaire déficient en Iode fait augmenter le volume de cette glande et entraine une déformation de cette glande appelée goitre. Dans les régions où l'on a consommé du sel iodé, l'incidence du goitre a diminué.
I.1.3 Les propriétés d'un élément sont déterminées par la structure de ses atomes.
Chaque élément est constitué d'un type d'atome qui lui est propre. L'atome est la plus petite unité de matière possédant les mêmes propriétés que l'élément auquel il appartient. Il est si petitqu'il en faudrait environ un million pour tracer le diamètre d'un point imprimé à la fin de cette phrase. On emploie le même symbole pour désigner l'atome et l'élément dont il fait partie . Ainsi C représente aussi bien l'élément Carbone qu'un seul atome de carbone.
- Les particules élémentaires
Bien qu'il soit la plus petite unité possédant les propriétés de l'élément qu'il constitue, l'atome est formé de parties encore plus petites , appelées particules élémentaires. Selon les physiciens, l'atome comporte plus d'une centaine de particules élémentaires, mais seulement trois sont suffisamment stables pour que nous nous y attardions : Les neutrons, les protons et les électrons . Les neutrons et les protons se trouvent au centre de l'atome et forment un noyau dense appelé noyau atomique , les électrons, eux, gravitent autour du noyau à une vitesse proche de celle de la lumière
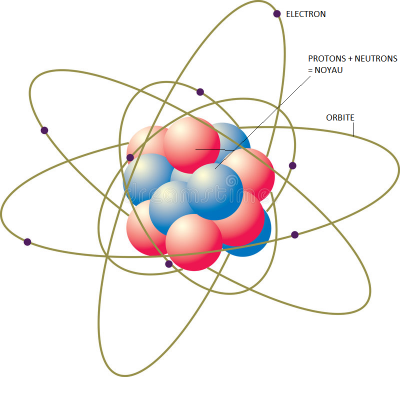
fig 2
Ce dessin montre que le noyau est composé de plusieurs éléments ( sphériques ), ce sont les protons et les neutrons.
Chaque électron et chaque proton possède une charge électrique. L'électron possède une unité de charge électrique négative et le proton une unité de charge positive . Quant au neutron, il est, comme son nom l'indique, électriquement neutre. Le noyau d'un atome est donc positif, et c'est l'attraction entre sa charge et celle, opposée des électrons qui relie ceux-ci autour du noyau.
Le proton et le neutron possèdent une masse presque identique , de l'ordre de 1,67.10-27 kg approximativement . Comme la masse d'un électron ne représente qu'environ 1/2000 de celle d'un neutron ou d'un proton, on peut l'ignorer lorsque l'on calcule la masse totale d'un atome.
- Numéro atomique, nombre de masse et masse atomique moyenne
Les atomes des différents éléments se distinguent par le nombre de particules élémentaires qu'ils contiennent . Tous les atomes d'un même élément ont un nombre égal de protons dans leur noyau. Ce nombre est appelé numéro atomique. Il est placé en indice à gauche du symbole de l'élément. Par exemple l'abréviation 2He montre que chaque atome d'Hélium a deux protons dans son noyau. A moins d'une indication contraire, un atome est électriquement neutre , c'est à dire qu'il a autant de protons que d'électrons.En conséquence, le numéro atomique indique à la fois le nombre d'électrons et le nombre de protons dans un atome électriquement neutre.
Il est possible de déduire le nombre de neutrons à partir du nombre de masse. Ce dernier correspond grosso modo à la somme des protons et des neutrons contenus dans le noyau . Il est exprimé au moyen d'un exposant placé à gauche de l'élément ; par exemple pour désigner un atome d'Hélium , on peut employer l'abréviation 24He . Puisque le nombre atomique montre le nombre de protons , il est possible de déterminer la quantité de neutrons en soustrayant le nombre atomique du nombre de masse ; ainsi un atome 24He possède deux neutrons. Un atome de sodium 1123Na a 11 protons, 11 électrons et 12 neutrons . L'atome le plus simple est l'atome d'hydrogène 11H ; il ne possède que 1 proton et 1électron et ne possède pas de neutron, il y a un seul électron gravitant autour d'un seul proton.
Puisque la masse de l'électron est négligeable, presque toute la masse de l'atome se concentre dans le noyau et, par ailleurs, comme les neutrons ont chacun une masse très proche de 1 u.m.a ( unité de masse atomique = 1 dalton ) , le nombre de masse est une approximation de la masse atomique moyenne. Celle-ci figure dans le tableau périodique des éléments ou elle est simplement appelée masse atomique . On la calcule en faisant la moyenne pondérée des masses atomiques des isotopes ( soit des différentes formes ) d'un élément et en prenant compte de l'abondance relative de chaque isotope dans la nature . La masse atomique moyenne nous indique, à peu de choses près la masse de l'atome entier, ainsi la masse atomique du Sodium 1123Na est de 23 u.m.a ( 22,9898 u.m.a exactement ).
- Les isotopes
Tous les atomes d'un élément donné possèdent le même nombre de ( sinon il ne s'agirait pas du même élément ), mais certains ont plus de neutrons que d'autres et, par conséquent ont une masse plus élevée. Les différentes formes atomiques d'un élément s'appellent isotopes. Dans la nature, où il existe plus de 300 isotopes différents , on trouve les éléments sous forme de mélanges d'isotopes . Prenons par exemple le carbone dont le nombre atomique est 6 . Il existe 3 isotopes de cet élément . Le plus courant est le carbone 12 : (612C) , il constitue environ 99 % du carbone naturel et possède 6 neutrons . La majeure partie du 1% restant consiste en atomes de l'isotope 613C qui a 7 neutrons . Quant au troisième isotope le 614C qui est encore plus rare il a 8 neutrons.Même s'ils ont des masses différentes, les isotopes d'un même élément se conduisent de la même facon dans les réactions chimiques ( le nombre généralement attribué comme masse atomique à un élément tel que : 22,9898 u pour le sodium est en fait une moyenne des masses atomiques de tous les isotopes naturels de cet élément )
Les isotopes 12C et 13C sont stables c'est à dire que leur noyau n'a pas tendance à perdre des particules . Par contre l'isotope 14C est instable ou radioactif. Un radio-isotope est un isotope dont le noyau se désintègre spontanément , ce qui libère des particules et de l'énergie. Lorsque cela se produit et que le nombre de protons dans le noyau se modifie, l'atome se transforme en un atome d'un autre élément. Par exemple le carbone radioactif se désintègre en azote.
Les radio isotopes sont très utiles dans le domaine de la recherche biologique et de la médecine. Toutefois, le rayonnement émis lors de leur désintégration comporte des risques parce qu'il endommage les molécules qui composent les cellules . La gravité des lésions dépend du type et de la quantité de radiations absorbées par l'organisme . Les retombées radioactives causées par des accidents nucléaires constituent l'une des menaces environnementales les plus sérieuses. En médecine cependant, les doses de la plupart des isotopes utilisés comportent peu de risques .
- Les niveaux énergétiques des électrons
Dans la figure 2 qui montre un modèle simplifié de l'atome, la taille du noyau est disproportionnée avec le volume complet de l'atome . Si l'atome d'Helium avait la taille du Stade olympique de Montréal, le noyau ne serait pas plus gros que la gomme à effacer d'un crayon placée au centre du terrain. De plus les électrons auraient l'allure de deux minuscules moucherons gravitant dans le stade , dans un espace environ 1 million de fois plus grand que le noyau. Les atomes se composent en grande partie d'espace vide.
Même lorsque deux atomes s'approchent l'un de l'autre au cours d'une réaction chimique , les noyaux demeurent trop éloignés pour interagir. Ainsi parmi les trois types de particules élémentaires dont nous avons parlé. Seuls les électrons participent directement aux réactions chimiques entre les atomes.
Chaque électron possède sa propre quantité d'énergie . L'énergie est la capacité de provoquer un changement , par exemple de produire du travail . L'énergie potentielle est l'énergie que la matière possède grâce à sa structure ou à sa position par rapport à d'autres objets. Par exemple l'eau contenue dans un réservoir sur une colline possède de l'énergie potentielle en raison de la hauteur à laquelle elle se trouve . Lorsque les vannes du réservoir s'ouvrent l'énergie se libère et sert à produire du travail , par exemple à faire marcher une turbine . L'eau qui arrive au pied de la colline a moins d'énergie que celle du réservoir . Or il faut savoir que la tendance naturelle de la matière est d'occuper le niveau d'énergie potentielle le plus bas possible. Pour rétablir l'énergie potentielle de l'eau ayant coulé , il faut produire du travail, celui-ci permettra de faire remonter l'eau jusqu'au réservoir malgré la force de gravitation.
Les électrons d'un atome qui sont chargé négativement possède eux aussi de l'énergie potentielle , en raison de leur disposition par rapport au noyau , chargé positivement . Plus ils se trouvent loin du noyau, plus leur énergie potentielle est élevée étant donné qu'il faut fournir un travail pour éloigner un électron du noyau . Contrairement à la variation continue de l'énergie potentielle de l'eau qui s'écoule vers le bas , les changements d'énergie potentielle des électrons , s'effectuent par étape, de façon discontinue . Un électron possédant une certaine énergie potentielle peut se comparer à une balle descendant un escalier. La balle a différentes quantités d'énergie potentielle selon la marche sur laquelle elle se trouve , elle ne peut pas passer beaucoup de temps entre les marches . De même un électron ne peut se trouver à un niveau intermédiaire entre certains niveaux déterminés d'énergie potentielle.
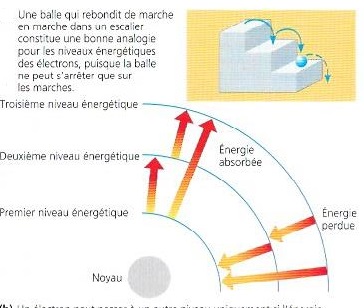
fig 3
es différents niveau d'énergie potentielle des électrons d'un atome s'appellent niveaux énergétiques. Le niveau énergétique d'un électron est lié à sa distance moyenne du noyau représentée symboliquement par des couches électroniques ( figure 4) . La première couche se situe le plus près du noyau
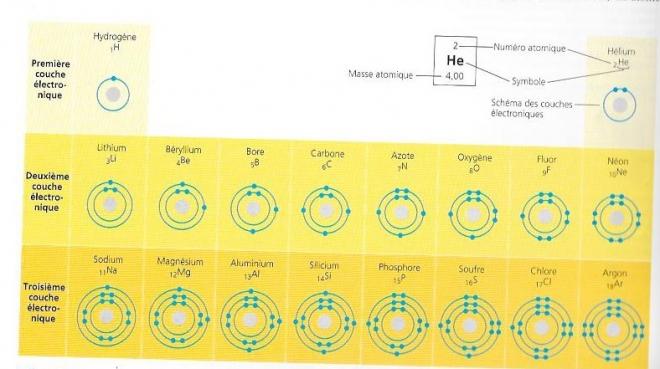
fig 4 : Schéma des couches électroniques des 18 premiers éléments.Dans un tableau périodique de base, l'information est présentée comme dans le médaillon illustrant l'Hélium. Dans les schémas de ce tableau modifié, les électrons sont représentés par des points bleus et les couches électroniques ( représentant les niveaux énergétiques ) par des anneaux concentriques . Ces schémas des couches électroniques constituent un moyen commode de représenter la répartition des électrons d'un atome parmi ses niveaux énergétiques, mais il faut bien noter que ces modèles sont simplifiés. Quant aux éléments, il figurent sur trois lignes ( ou périodes ) selon le nombre de leurs couches et le nombre d'électrons contenus dans celles-ci . Chaque ligne représente le remplissage d'un niveau énergétique . A mesure qu'ils s'ajoutent, les électrons occupent le plus bas niveau énergétique disponible ; les électrons qui s'y trouvent possèdent l'énergie la plus faible.Les électrons situés dans la deuxième couche ont plus d'énergie, ceux de la troisième couche encore plus , et ainsi de suite . Un électron peut passer d'une couche à une autre seulement en absorbant ou en perdant une quantité d'énergie égale à la différence d'énergie potentielle entre l'ancienne couche et la nouvelle . Pour gagner une couche plus éloignée du noyau , l'électron doit absorber de l'énergie . Par exemple la lumière peut l'exciter et le faire passer à un niveau énergétique supérieur ( en fait il s'agit là de la première étape de la photosynthèse , durant laquelle les végétaux captent l'énergie lumineuse. C'est le processus qui leur permet de produire de la nourriture à partir de dioxyde de carbone et d'eau ).Au contraire, pour regagner une couche plus proche du noyau , l'électron doit perdre de l'énergie habituellement en la libérant dans l'environnement sous forme de chaleur . Ainsi quand les rayons du soleil excitent les électrons contenus la peinture d'une voiture noire , ceux-ci passent à des niveaux d'énergie supérieurs. L'automobile chauffe pendant que les électrons regagnent leur niveau énergétique initial. Cette énergie thermique peut être transférée à l'air ou à la main si on touche l'automobile.
- Configuration électronique et propriétés chimiques
Le comportement d'un atome dépend de la configuration électronique de celui-ci , c'est à dire de la répartition des électrons dans ses couches électroniques. En commençant par l'hydrogène , l'atome le plus simple, nous poulons élaborer les atomes des autres éléments en ajoutant un proton et un éléctron à la fois ( de même qu'un nombre approprié de neutrons ). La figure 4 présente une version abrégée de ce que nous appelons tableau périodique des éléments et nous permet de visualiser la configuration des 18 premiers , soit de l'Hydrogène ( 1H) à l'Argon (18Ar).Ces éléments figurent sur trois lignes appelées périodes correspondant aux couches électroniques contenues dans leurs atomes . De gauche à droite, la suite des éléments de chaque ligne correspond à l'addition séquentielle d'électrons ( et de protons ). Comme toute matière les électrons cherchent à atteindre l'état d'énergie potentielle le plus bas , ce qui est possible lorsqu'ils se trouvent dans le première couche électronique . L'unique électron de l'hydrogène et les deux électrons de l'helium , par exemple occupent le premier niveau électronique. Or celui-ci ne peut contenir plus de deux électrons ; donc la première rangée du tableau ne peut contenir plus de deux éléments ' l'hydrogène et l'hélium ) . Quand il possède plus de deux électrons , un atome doit utiliser des couches électroniques supérieure, la première étant saturée. Le lithium par exemple a trois électrons : deux électrons remplissent sa première couche , et le troisième est localisé dans la deuxième couche . Cette dernière peut contenir un maximum de huit électrons . Quant au néon qui se situe à la fin de la deuxième ligne , il compte huit électrons dans sa seconde couche , cet atome a donc dix électrons au total.
Un atome a des propriétés chimiques qui dépendent principalement du nombre d'électrons présents dans sa couche périphérique , appelée dernier niveau énergétique. Ces électrons s'appellent électrons de valence ou électrons périphériques. Le lithium par exemple, qui a deux couches possède seulement un électron de valence . Les atomes qui ont le même nombre d'électrons dans leur dernier niveau énergétique affichent un comportement chimique semblable . Par exemple le Fluor ( F) et le Chlore ( Cl) possèdent tous deux sept électrons de valence , et chacun d'eux peut se combiner au Sodium et former des composés. Par ailleurs, un atome dont le dernier niveau énergétique est saturé ne réagit pas spontanément avec les atomes qu'il rencontre. A l'extrême droite du tableau périodique se trouvent l'hélium, le néon et l'argon , il s'agit des trois seuls éléments présentés à la figure 4 dont le dernier niveau énergétique est saturé . Ils sont dit inertes en raison de leur stabilité chimique. Tous les autres atomes de la figure 4 ont la capacité de réagir chimiquement , parce que leur dernier niveau énergétique est insaturé.
- Les orbitales électroniques
Au début du XXème siècle les scientifiques percevaient les couches électroniques comme des trajectoires concentriques décrites par les électrons se déplaçant autour du noyau, un peu comme les orbites des planètes bougeant autour du soleil. Aujourd'hui, on se sert encore des cercles concentriques à deux dimensions pour illustrer les couches électroniques ( fig 4 ).
Mais il faut se rappeler qu'une couche électronique représente la distance moyenne d'un électron par rapport au noyau. Ce n'est qu'un modèle , toutefois, qui ne donne en rien une représentation réelle d'un atome. Par contre nous pouvons déterminer le volume de l'espace dans lequel il passe la majeure partie de son temps . L'espace tridimensionnel où l'électron passe 90% de son temps s'appelle orbitale.
Chaque couche électronique compte un nombre déterminé d'orbitales de formes et d'orientations particulières ( figure 5 ). On peut se représenter une orbitale comme une composante d'une couche électronique ( rappelkez vous qu'une couche électronique correspond à un niveau énergétique particulier ). La première couche électronique a une seule orbitale de forme sphérique , qui s'appelle 1s, mais la deuxième couche a quatre orbitales : une grande orbitale sphérique s ( appelée 2s) et trois orbitales p ( appelées 2p) qui ont la forme d'haltères , chacune d'elle s'oriente à angle droit par rapport aux deux autres ( voir figure 5). La troisième couche électronique ainsi que les couches supérieures possèdent également des orbitales s et p en plus d'orbitales de formes plus complexes.
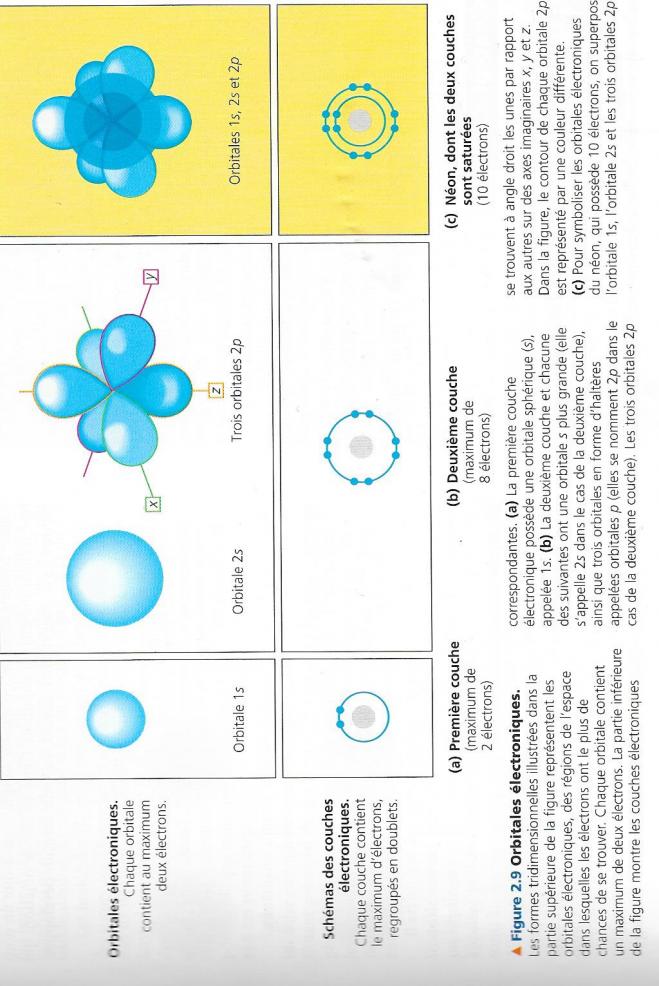
Fig 5 : Orbitales électroniques
La même orbitale ne peut contenir plus de deux électrons , la première couche électronique peut donc loger au maximum deux électron dans son orbitale s. L'unique électron de l'atome d'hydrogène et les deux électrons de l'atome d'hélium occupent donc l'orbitale 1s. La deuxième couche électronique a quatre orbitales électroniques et ne peut loger plus de huit électrons . Ces électrons possèdent à peu près la même énergie , mais ils se déplacent dans des espaces différents.
La réactivité d'un atome dépend de la présence d'électrons non appariés ou célibataires dans une nou plusieurs orbitales de son dernier niveau énergétique. Observez la figure quatre , ,où les électrons s'ajoutent un à la fois pour occuper les orbitales. Pour plus de clarté on place un électron sur chaque côté de la couche périphérique jusqu'à ce qu'elle soit à demi-remplie , puis on apparie les électrons jusqu'à ce que le niveau énergétique soit complet . Quand les atomes interagissent pour combler leur dernier niveau électronique , ce sont les électrons célibataires qui entrent en jeu.
I.1.3 La formation et la fonction de molécules dépendent des liaisons chimiques entre les atomes
Montons maintenant dans la hiérarchie de l'organisation biologique pour voir comment les atomes se combinent de façon à former des molécules et des composés ioniques. Les atomes dont le dernier niveau énergétique est incomplet ( c'est le cas des éléments les plus abondants dans la manière vivante ) interragissent avec certains autres atomes de manière à remplir leur dernière couche électronique. Pour ce faire il doivent soit mettre en commun leurs électrons de valence, soit les transférer complètement.Cela fait ils restent habituellement proches l'un de l'autre. Ils sont retenus par des forces d'attraction appelées liaisons chimiques . Les liaisons chimiques les plus fortes sont la liaison covalente et la liaison ionique entre atomes ou ions, la liaison covalente étant la plus forte des deux .
- La liaison covalente
La liaison covalente existe quand deux atomes mettent en commun une ou plusieurs paires d'électrons de valence. C'est ce qui arrive , par exemple, quand deux atomes d'hydrogène s'approchent l'un de l'autre. Rappelez vous que l'hydrogène possède un électron de valence situé dans sa première couche mais que celle-ci peut en contenir deux. Lorsqu'ils sont assez près pour que leurs orbitales 1s se chevauchent, deux atomes d'hydrogène mettent en commun leur unique électron.
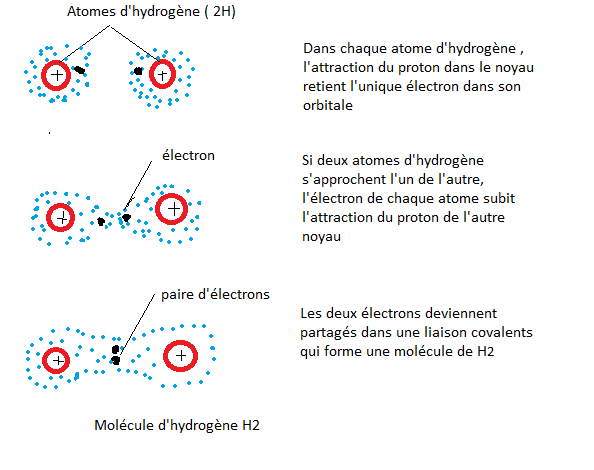
Fig 6
Chaque atome d'hydrogène possède alors deux électrons qui se déplacent dans son orbitale 1s et son dernier niveau énergétique est complet, ce qu'illustra la figure 7 a sous forme de schémas des couches électroniques. Quand ils sont unis par des laisons covalentes, deux atomes ou plus forment une molécule . Dans l'exemple ci dessus nous avons choisi le dihydrogène
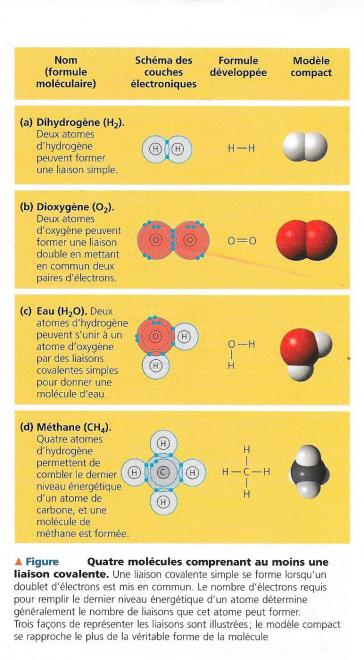 Fig 7
Fig 7
le symbole utilisé pour la représenter est H-H ; le tiret indique une liaison covalente simple ou liaison simple , c'est à dire un doublet d'électrons mis en commun. Cette forme de notation qui montre les atomes et leurs liaisons s'appelle formule développée. Nous pouvons l'abréger en écrivant H2 ; il s'agit de la formule moléculaire , qui indique simplement que la molécule consiste en deux atomes d'hydrogène.
Ayant 6 électrons dans sa deuxième couche électronique, l'oxygène a besoin de deux électrons supplémentaires pour combler son dernier niveau énergétique . Deux atomes d'oxygène qui se rencontrent doivent mettre en commun deux doublets d'électrons de valence afin de former une molécule ( fig 7b) , ils sont alors unis par une liaison covalente double , ou liaison double. Chaque atome qui peut mettre en commun des électrons de valence possède une capacité de liaison correspondant au nombre de liaisons covalentes qu'il peut établir . Une fois que celles - ci sont formées, le dernier niveau énergétique de l'atome est comblé. Le nombre d'oxydation d'un atome détermine sa capacité de liaison . Il représente le nombre d'électrons qu'un atome doit perdre ( signe + ) , gagner ( signe - ) ou mettre en commun pour remplir son dernier niveau énergétique. Le nombre d'oxydation de l'hydrogène est +1 . Cette valeur signifie que l'électron a plutôt tendance à s'éloigner du noyau de l'hydrogène et à se rapprocher d'un autre atome ; l'électron éloigne par le fait même , sa charge négative du noyau de l'hydrogène . Dans ce cas le proton du noyau de charge positive , prédomine au sein de l'hydrogène d'où le +1 correspond au nombre d'oxydation de cet atome . Quant au nombre d'oxydation de l'oxygène il est de -2. Parfois un élément comporte plusieurs nombres d'oxydation , selon le type de molécule auxquel il appartient ; ainsi ceux de l'azote sont +/-3, +5, +4, +2. Le phosphore P, un élément important pour la vie peut avoir un nombre d'oxydation de +/- 3 ainsi que ses trois électrons célibataires permettent de le prédire. Cependant lorsqu'il fait partie d'une molécule essentielle à la vie , il a généralement un nombre d'oxydation de +5 ; il forme 3 liaisons simples et une liaison double . Il peut aussi avoir un nombre d'oxydation de +4.
Les molécules H2 et O2 constituent des éléments purs et non des composés ( rappelez vous qu'un composé est une combinaison de 2 ou de plusieurs éléments différents ). L'eau dont la formule moléculaire est H2O , est un exemple de composé . Il faut deux atomes d'hydrogène pour combler le dernier niveau énergétique d'un atome d'oxygène. La figure 7 c montre la structure d'une molécule d'eau. L'eau revêt tellement d'importance pour la vie que nous consacrerons tout un chapitre à sa structure et à ses propriétés.
Le méthane dont la formule moléculaire est CH4, représente un autre exemple de composé ( fig 7d ). C'est en fait le constituant principal du gaz naturel. Il faut quatre atomes d'hydrogène ( chacun ayant un nombre d'oxydation de +1 ) pour combler le dernier niveau énergétique d'un atome de carbone ( dont le nombre d'oxydation est -4 ) . Nous étudierons de nombreux autres composés du carbone plus loin.
Il arrive que des atomes ou des molécules contenant des électrons de valence non appariés ( ou célibataires ) se forment dans un organisme ( O2- , NO ou OH) par exemple . Ces substances appelées radicaux libres sont très instables et très réactives , car elles sont, en quelque sorte, à la recherche de l'électron manquant.Elles peuvent "voler" celui-ci à n'importe quel atome , y compris des électrons appartenant à des substances utiles pour un organisme, comme les protéines. Les radicaux libres peuvent donc avoir des effets physiologiques nocifs.
L'attraction d'un atome sur les électrons qu'il met en commun s'appelle électronégativité . Plus un atome est électronégatif, plus il attire vers lui les électrons mis en commun. Dans une liaison covalente entre deux atomes du même élément , la partie est nulle, étant donné que ceux-ci ont une électronégativité égale. On parle alors de liaison covalente non polaire.Les électrons sont répartis également entre les atomes. Ainsi la liaison covalente de H2 n'est pas polaire, tout comme la liaison double de O2 . Dans d'autres composés par contre qui comprennent un atome lié à un autre plus électronégatif , les électrons de la liaison passent plus de temps du côté de ce dernier. On parle de laison covalente polaire. La polarité de ces liaisons varie en fonction de l'électronégativité relative des deux atomes . Par exemple les liaisons du méthane ( CH4) sont faiblement polaires parce que l'électronégativité du carbone diffère faiblement de celle du carbone. Dans un autre exemple mettant en jeu la molécule d'eau , les liaisons entre l'oxygène et l'hydrogène sont très polaires. L'oxygène fait partie des éléments les plus électronégatifs parmi les 92 éléments naturels . L'attraction qu'il exerce sur les électrons mis en commun est beaucoup plus forte que celle de l'hydrogène. En conséquence dans une liaison covalente entre l'oxygène et l'hydrogène, les électrons passent plus de temps autour du noyau de l'oxygène que du noyau de l'hydrogène. Comme les électrons possèdent une charge négative, la répartition inégale dans la molécule d'eau confère à l'oxygène une charge partielle négative ( symbolisée par la lettre grecque delta ð suivie du signe - ou " delta -) et à chacune des atomes d'hydrogène, une charge partielle delta +
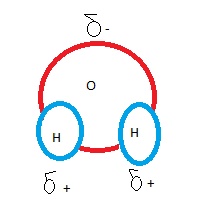 Fig 8
Fig 8
- La liaison ionique
Dans certains cas, deux atomes proches l'un de l'autre exercent des attractions tellement inégales sur leurs électrons de valence que le plus électronégatif arrache complètement un électron à l'autre atome . Cela se profuit par exemple quand un atome de sodium ( 11Na) rencontre un atome de Chlore (17Cl) . L'atome de sodium possède au total 11 électrons dont un seul de valence. L'atome de chlore possède 17 électrons dont 7 de valence. Lorsque ces deux atomes se rencontrent , le sodium cède son unique électron de valence au chlore ; les deux atomes ont donc ainsi leur dernier niveau énergétique saturé . 5 Comme le sodium n'a plus d'électron dans sa troisième couche , sa deuxième couche devient le dernier niveau énergétique.
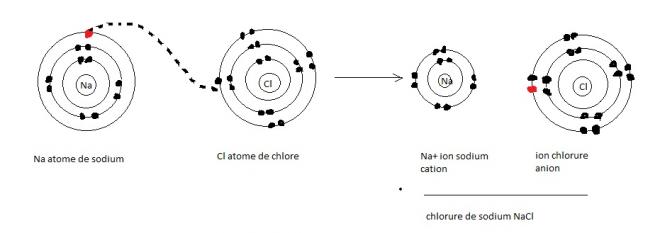
Le transfert d'un électron du Sodium au Chlore déplace vers celui-ci une unité de charge négative. Le Sodium que se retrouve avec 11 protons et seulement 10 électrons possède maintenant une charge électrique nette de plus 1 ( + 1 ). Un atome chargé ou une molécule chargée s'appelle ion. Lorsqu'il cède ou accepte au moins un électron, un atome devient un ion monoatomique : c'est le cas des ions Cl- et Ca++. Une molécule chargée est un ion polyatomique ( un groupe d'atomes liés ) : c'est le cas par exemple des ions NH4+ et SO42-. Le chlorure d'ammonium est le résultat de l'union d'un ion monoatomique Chlorure ( Cl-) et d'un ion polyatomique ammonium ( NH4+), un composé formé d'un atome d'azote lié par covalence à quatre atome d'hydrogène. L'ion ammonium possède une charge électrique +1 parce qu'il lui manque un électron.
Lorsque la charge est positive, comme dans le cas du sodium de notre exemple, l'ion s'appelle cation. Par contre , comme l'atome de chlore a gagné un électron, il se trouve avec 17 protons et 18 électrons , ce qui lui donne une charge électrique nette de -1. C'est devenu un ion chlorure, un anion, soit un ion chargé négativement. En raison de leurs charges opposées, les cations et les anions s'attirent mutuellement et forment des liaisons ioniques . Deux ions de charges opposées peuvent former une liaison ionique sans qu'ils aient effectué un transfert mutuel d'électron.
Les composés formés par des liaisons ioniques sont appelés composés ioniques ou sels . Nous connaissons tous le sel de table , il s'agit d'un composé ionique appelé chlorure de sodium ( NaCl) . Dans la nature, les sels ont souvent l'aspect de cristaux de taille et de forme diverses , ce sont des agrégats formés d'un grand nombre de cations et d'anions unis par leur attraction électrique et assemblés en réseaux tridimensionnels . Un cristal de sel n'est pas constitué de molécules dans le sens que nous avons attribué aux composés covalents : cela parce qu'une molécule formée d'atomes unis par des liaisons coivalentes a une taille et un nombre d'atomes déterminé . La formule d'un composé ionique comme NaCl, indique seulement le rapport entre les éléments que le cristal de sel renferme . La formule NaCl ne représente pas une molécule individualisée.
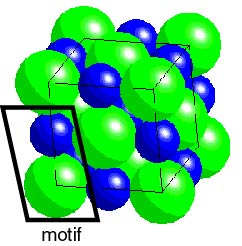
Fig 9 : La structure d'un cristal de chlorure de sodium.
Légende : Bleu : Na+, Vert : Cl-
Tous les sels ne possèdent pas un nombre égal de cations et d'anions. Par exemple , le dichlorure de magnésium ( MgCl2) , un composé ionique comprend deux ions chlorure pour chaque ion mlagnésium. Le magnésium doit perdre ses deux électrons de valence pour que son dernier niveau énergétique soit saturé . Il devient alors un cation dont , dont la charge est +2 ( Mg2+) . Un cation magnésium peut ainsi former des liaisons ioniques avec deux anions chlorure.
L'environnement influe sur la force des liaisons ioniques . Un cristal de sel pur possède des liaisons tellement fortes lorsqu'il est secqu'il faut un marteau et un ciseau pour le casser en deux . Cependant si on le place dans l'eau , il se dissout à mesure que l'attraction diminue entre ses ions ( voir prochain chapitre ).
- Les liaisons chimiques faibles
Chez les êtres vivants, les liaisons chimiques les plus fortes sont les liaisons covalentes unissant des atomes et formant les molécules d'une cellule. Mais des liaisons intermoléculaires et intramoléculaires plus faibles sont également indispensables ; en fait les propriétés de la vie découlent d'elles . Grace aux liaisons faibles les grosses molécules les plus importantes en biologie peuvent maintenir des formes tridimensionnelles , responsable de leurs fonctions. De plus , lorsqu'elles entrent en contact dans une cellule , deux molécules peuvent s'associer de façon temporaire grâce à des types chimiques faibles. Le caractère réversible des liaisons faibles constitue un avantage : deux molécules s'associent , réagissent l'une à l'autre d'une certaine manière , puis se séparent. Plusieurs types de liaisons chimiques faibles jouent un nrôle important dans les organismes. Mentionnons la liaison ionique , dont nous venons de parler, et la liaison hydrogène , essentielle à la vie et découlant des forces de Van der Waals.
a) La liaison hydrogène.
C'est une liaison chimique faible , elle est tellement importante pour la vie qu'elle mérite une attention particulière. Elle se forme quand un atome d'hydrogène déjà lié par une covalence à un atome électronégatif subiyt l'attraction d'un autre atome électronégatif. Dans les cellules, les atomes électronégatifs susceptibles de donner lieu à des liaisons hydrogène sont habituellement l'oxygène et l'azote . Observons le cas simple de la liaison hydrogène entre l'eau ( H2O) et l'ammoniac ( NH3). Dans le prochain chapitre , nous verrons comment les liaisons hydrogène entre les molécules d'eau permettent à certains insectes de marcher sur un étang.

![]()
Fig 10
b) Les forces de Van der Waals
Même une molécule ayant des liaisons covalentes non polaires peut présenter des régions chargées positivement , et d'autres , négativement . Etant constamment en mouvement, les électrons ne sont pas toujours répartis de façon symétrique dans la molécule . Ils peuvent à tout moment se retrouver rassemblés par hasard dans l'une ou l'autre de ses parties. Par conséquent les " points chauds " chargés positivement et négativement changent constamment , ce qui permet à tous les atomes et à toutes les molécules de s'attirer mutuellement. Ces forces ou interactions de Van der Waals sont faibles et apparaissent seulement quand les atomes et les molécules sont très proches les uns des autres
Les forces de Van der Waals, les liaisons hydrogène et les liaisons ioniques en milieu aqueux peuvent se former non seulement entre des molécules , mais aussi entre différentes régions d'une même molécule , comme une protéine. Bien qu'elles soient faiblers individuellement , ces liaisons ont un effet cumulatif qui renforce la force tridimensionnelle des grosses molécules .
- Forme moléculaire et fonction biologique
Une molécule possède une taille et une forme tridimensionnelle caractéristiques. La forme tridimensionnelle particulière d'une molécule contribue habituellement de manière très importante à la fonction de la molécule dans la cellule.
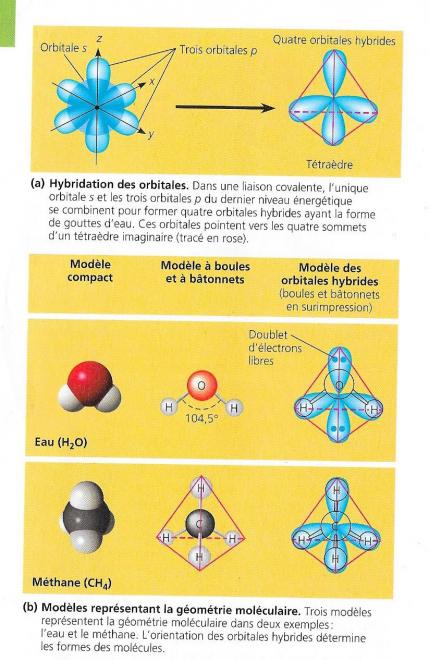 Fig 11
Fig 11
Les molécules constituées de deux atomes comme H2 ou O2 sont toujours linéaires. Celles qui comportent plus de deux atomes ont des formes plus complexes déterminées par la position des orbitales des atomes . Quand un atome établit des liaisons covalentes avec un autre atome , les orbitales de son dernier niveau énergétique se transforment . S'il possède des électrons de valence dans les orbitales s et p , l'unique orbitale s et les trois orbitales p se combinent pour former quatre nouvelles orbitales dites hybrides. Celles-ci ont le forme de gouttes d'eau identiques émergeant du noyau atomique (Fig 11 a ) . Si nous relions les grosses extrémités des gouttes d'eau par des droites nous obrenons un tétraèdre ( une pyramide à base triangulaire).
Dans la molécule d'eau ( H2O ) , l'atome d'oxygène met en commun deux des orbitales hybrides de son dernier niveau énergétique avec les atomes d'oxygène ( Fig 11 b). La molécule qui en découle a grossièrement la forme d'un V ( inversé dans la figure 11b), ses deux liaisons covalentes formant un angle de 104,5 °. La molécule de méthane (CH4) a la forme d'un tétraèdre parce que les quatre orbitales hybrides du carbone sont mises en commun avec l'hydrogène ( voir la figure 11b) . Le noyau de l'atome de carbone se trouve au centre et ses quatres liaisons covalentes pointes vers les noyaux d'hydrogène situés au sommet du tétraèdre. Les mélécules plus volumineuses contenant plusieurs atomes de carbone ( dont de nombreuses molécules composant la matière organique ont des formes tridimensionnelles plus complexes . Cependant la forme térraédrique que prend un atome de carbone uni à quatre autres atomes est motif courant.
La géométrie moleculaire suscite beaucoup d'intérêt en biologie car elle détermine la façon dont la plupart des molécules se reconnaissent et réagissent entre elles , de manière spécifique. Les liaisons faibles ne peuvent s'établir qu'entre des molécules possédant une forme complémentaire .
I.1.4 Les réactions chimiques établissent et rompent des liaisons chimiques
La formation et la rupture des liaisons chimiques, qui provoquent des modifications dans la composition de la matière , constituent les réactions chimiques . La réaction qui se produit entre le dihydrogène et le dioxygène et qui aboutit à la formation d'eau en est un exemple :
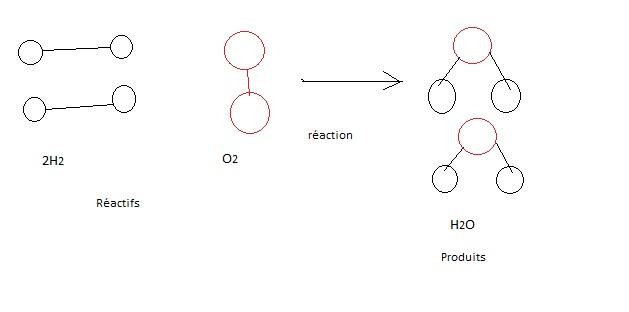 Cette réaction rompt les liaisons covalentes de H2 et de O2 . De nouvelles liaisons sont établies , et des molécules de H2O sont formées. Pour exprimer une réaction chimique, nous utilisons une flèche représentant la transformation des substances , appelées réactifs , en une ou plusieurs nouvelles substances , les produits . Les coefficients . Les coefficients indiquent le nombre de molécules participantes. Les coefficient 2 devant H2 signifie que la réaction commence avec deux molécules de dihydrogène . Remarquez que tous les atomes des réactifs se retrouvent dans les produits . Dans toute réaction chimique , la matière est conservée : les réactions ne peuvent ni la créer ni la détruire ; elles ne peuvent que la réorganiser.
Cette réaction rompt les liaisons covalentes de H2 et de O2 . De nouvelles liaisons sont établies , et des molécules de H2O sont formées. Pour exprimer une réaction chimique, nous utilisons une flèche représentant la transformation des substances , appelées réactifs , en une ou plusieurs nouvelles substances , les produits . Les coefficients . Les coefficients indiquent le nombre de molécules participantes. Les coefficient 2 devant H2 signifie que la réaction commence avec deux molécules de dihydrogène . Remarquez que tous les atomes des réactifs se retrouvent dans les produits . Dans toute réaction chimique , la matière est conservée : les réactions ne peuvent ni la créer ni la détruire ; elles ne peuvent que la réorganiser.
La photosynthèse est un bon exemple de réactions chimiques qui réorganisent la matière. Les animaux ( dont l'humain fait partie ) dépendent de la photosynthèse pour se nourrir et pour respirer ; celle-ci constitue la base de presque tous les écosystèmes . Voici une formule abrégée résumant la réaction de la ,photosynthèse :
6 CO2 + 6 H2O ---------> C6H12O6 + 6O2
Les matériaux bruts de la photosynthèse sont le dioxyde de carbone ( CO2) dans l'air et l'eau ( H2O) provenant du sol. La lumière du soleil fournit aux cellules capables de photosynthèse. L'énergie nécessaire à la transformation de ces ingrédients en un sucre ( C6H12O6) et en molécules de dioxygène ( O2), un produit secondaire libéré dans l'environnement. Même si la photosynthèse est une suite de nombreuses réactions biochimiques , nous retrouvons en bout de ligne le même nombre et le même type d'atomes qu'au début . Bref, les réctions réorganisent simplement la matière grâce à l'énergie fournie par le soleil.
Certaines réactions chimiques sont complète et irréversibles, c'est à dire que tous les réactifs sont transformés en produits. D'autres sont réversibles : les produits de la réaction directes deviennent les réactifs de la réaction inverse. Par exemple, les molécules de dihydrogène et de diazote peuvent se combiner pour former de l'ammoniac, et celui-ci peut se décomposer pour reformer du dihydrogène et du diazote.
3 H2 + N2 <=> 2 NH3
Les flèches superposées et pointant dans un sens opposé indiquent que la réaction est réversible
La concentration des réactifs est l'un des facteurs qui déterminent la vitesse d'une réaction chimique . Plus les molécules desz réactifs sont concentrées, plus elles se heurtent les unes aux autres et plus elles ont l'occasion de réagir et de former des produits . Le même principe vaut pour ces derniers : à mesure qu'ils s'accumulent , les collisions deviennent de plus en plus fréquentes , ce qui aboutit à la formation des réactifs de départ. En fin de compte, la réaction directe et la réaction inverse ont lieu à la même vitesse n, et la concentration relative des produits et des réactifs demeure constante. Le point précis où cela arrive , donc où les réactions s'annulent , est appelé équilibre chimique . En fait il s'agit d'un équilibre dynamique ; les réctions continuent toujours de se dérouler dans les deux sens, mais elles n'ont aucune influence sur la concentration des réactifs et des produits . Notez que l'équilibre ne signifie pas que les concentrations des réactifs et des produits sont égales, mais seulement qu'elles sont dans un certain rapport stable. La réaction de l'ammoniac dont nous avons parlé plus haut atteint l'équilibre quand ce composé se dissocie aussi rapidement qu'il se forme . Al'état d'équilibre il y a beaucoup plus d'ammoniac que de dihydrogène et de diazote
Date de dernière mise à jour : 10/11/2018
Commentaires
-

1 Moukolo Noelle Sina Le 20/12/2017
Comment teléchargé cet ouvrage ?
Ajouter un commentaire

