- Accueil
- D.Sciences biologiques
- IV.Biologie animale ou zoologie
- 6.physiologie animale
- Physiologie animale 5
Physiologie animale 5
3. Autres cellules musculaires
Les cellules musculaires cardiaques et les cellules musculaires lisses sont deux autre catégories de cellules contractiles qui se rencontrent chez les vertébrés. La contraction met en jeu les mêmes mécanismes moléculaires que dans les cellules striées squelettiques mais certaines différences dans les modalités de ces cellules méritent d'être soulignées.
3.1 Cellules du myocarde
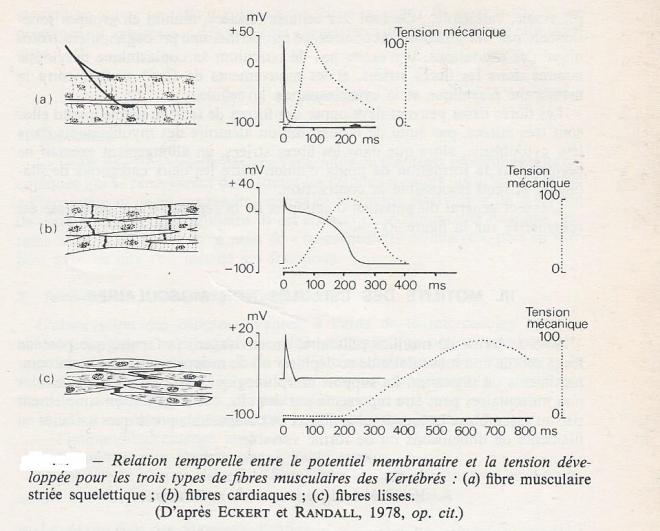
les cellules du myocarde n'ont qu'un seul noyau, situé en position centrale , et leurs éléments contractiles sont organisés en myofibrilles, comme dans la fibre striée squelettique , distribuées essentiellement à la périphérie de la cellule . Toutes les cellules sont interconnectées par des synapses électriques, ce qui assure une propagation rapide des potentiels d'action musculaire. Le potentiel d'action d'une cellule cardiaque ( fig suivante ) présente un plateau de dépolarisation qui se maintient pendant plusieurs centaines de millisecondes , entretenu par l'influx de Ca2+ dans le cytoplasme . La durée prolongée du potentiel d'action , par rapport à sa vitesse de conduction permet aux cellules touchées les dernières de se contracter alors que les premières ne sont pas encore relâchées. Chaque potentiel d'action cardiaque est suivi d'une longue période réfractaire pendant laquelle le relâchement des fibres permet le remplissage de l'organe.
3.2 Fibres musculaires lisses
Les fibres musculaires lisses ne préserntent pas la striation caractéristique des autres éléments musculaires , par suite de leur pauvreté en filaments contractiles mais aussi parce que ceux-ci sont distribués d'une façon désordonnée dans le cytoplasme . Ces fibres forment la paroi des organes creux chez les vertébrés : tube digestif,vessie, vaisseaux, ... Ce sont des cellules fuselées , réunies en groupes fonctionnels par des jonctions lacunaires, ce qui permet une propagation électrotonique des excitations. Il n'existe pas de réticulum sarcoplasmique développé comme dans les fibres striées , et les mouvements de Calcium ( Ca2+) se font entre la membrane plasmique et le cytoplasme de la cellule.
Les fibres lisses peuvent développer des forces de tension même quand elles sont très étirées , par suite de la distribution aléatoire des myofilaments dans leur cytoplasme , alors que dans les fibres striées , un allongement excessif ne permet plus la formation de ponts d'union entre les deux catégories de filaments, et rend impossible la contraction; L'aspect général du potentiel d'action et de la réponse d'une fibre lisse est schématisé sur la figure précédente .
4. Motilité des cellules non musculaires
Sous le terme de motilité cellulaire, on envisagera la faculté que possède toute cellule non musculaire de se déplacer ou de mouvoir certains de ses compartiments ou organites . Le support morphologique de la motilité des cellules non musculaires peut être présenté par des cils, des flagelles, ou simplement par un assemblage beaucoup plus discret de composants protéiques associés en filaments de dimensions ou de formes variables.
4.1 Variété des mouvements cellulaires
Les mouvements cellulaires présentent une grande variété apparente par leur amplitude, ou par les structures plus ou moins différenciées qui les sous-tendent . Les quelques exemples suivants illustrent cette variété.
- divisions cellulaires : mouvements des organites et cytokinèse;
- déplacement des cellules autonomes : amibes, leucocytes , migration des cellules lors de l'embryogenèse ou du renouvellement des tissus;
- mouvements cytoplasmiques et membranaires associés à la phagocytose et à la pinocytose;
- mouvements associés à l'exocytose;
- mouvement des organites à l'intérieur des cellules : cyclose, transport axonique, migration des granules pigmentaires;
- propulsion assurée par des flagelles ( Zooflagellés, spermatozoïdes )
- mouvements ciliaires ; déplacement de la cellule ( Ciliés ) ou du fluide environnant ( épithéliums ciliés).
Les nombreuses données morphologiques et fonctionnelles accumulées à propose de la motilité cellulaire permettent de bien saisir non plus les différences , mais les similitudes entre les divers mécanismes moléculaires qui sont à la base de tous les mouvements cellulaires. Quelle que soit son amplitude , un mouvement nécessite un système générateur d'énergie , une structure sous jacente pour orienter la force et un signal déclencheur. Les structures qui assurent la cohérence de la motilité cellulaire mettent en oeuvre un petit nombre de protéines motrices. La commande de ces protéines est assurée par des protéines régulatrices dont la variété est plus marquée.
4.2 Le cytosquelette
4.2.1 Définition
Le terme de cytosquelette désigne l'ensemble de filaments protéiques microscopiques qui se rencontrent dans toutes les cellules étudiées jusqu'ici. Ce terme a l'inconvénient de ne pas rendre compte de la grande plasticité et de la labilité de cette interaction cellulaire. Il est conservé par commodité bien que certains auteurs lui préfèrent le terme de "motosquelette cellulaire", plus en rapport avec ce que l'on sait de ses fonctions .
4.2.2 Le réseau cytosquelettique
Les filaments observés dans les cellules sont classés en trois familles , sur des bases morphologiques étayées par des données biochimiques. La microscopie électronique à haute tension est susceptible de faire évoluer cette classification .
4.2.2.1. Microfilaments
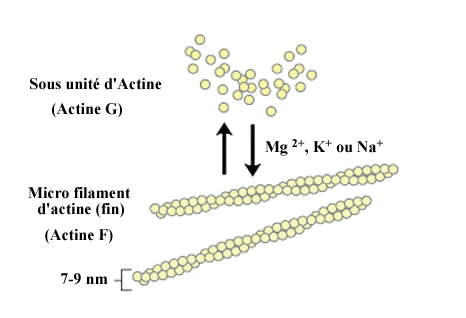
Les microfilaments sont rencontrés dans tous les territoires cellulaires . Il s'agit de filaments d'un diamètre variant de 4 à 7 nm, formés essentiellement d'actine, avec diverses protéines associées. Les filaments d'actine , révélés par immunofluorescence indirecte ou par d'autres techniques forment , soit des grands câbles tendus entre des points éloignés de la membrane cellulaire , soit un feutrage de petits filaments situés dans le cortex de la cellule , juste sous la membrane , surtout dans les zones où sont situés les récepteurs membranaires de l'endocytose spécifique . Dans certaines cellules, l'actine peut représenter jusqu'à 15 % des protéines totales : c'est le cas pour les cellules très mobiles , comme les Amibes , ou dans les plaquettes sanguines . Elle forme encore 2 % des protéines dans les hépatocytes de l'homme.
Les protéines associées aux filaments d'actine sont très variées :
- chaînes lourdes et légères de la myosine
- tropomyosine
- alpha actinide ( une protéine rencontrée dans les stries Z des fibres musculaires striées ).
- au total, près de 50 espèces protéiques différentes semblent pouvoir être associées au filaments d'actine .
La myosine est susceptible de former des ponts avec les filaments d'actine , comme dans les fibres musculaires ; ces interactions pourraient être à l'origine de mouvemenst de glissement des molécules.
La tropomyosine semble n'être associée aux filaments d'actine que lorsque la cellule est immobile et fixée à un support alors qu'elle n'est plus révélée par l'immunofluorescence indirecte quand la cellule est en mouvement .
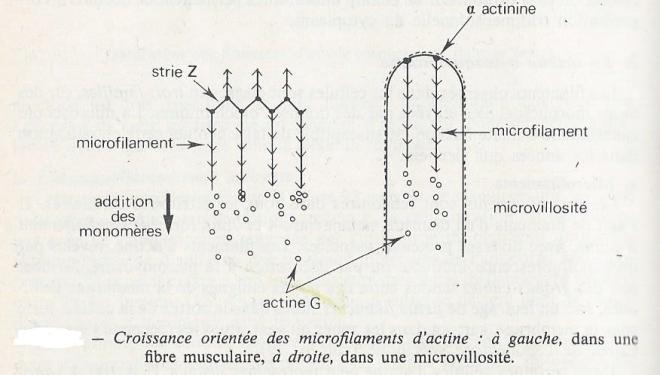
L'alpha actinine est associée aux microfilaments avec une disposition périodique, mais aussi dans les zones de la membrane où sont fixés des microfilaments . l'alpha actine aurait un rôle organisateur lors de la formation des filaments d'actine . ceci s'observe au niveau des stries Z de la fibre musculaire : lors de la différenciation des fibres musculaires striées squelettiques , la croissance des filaments d'actine s'effectue par addition de nouveaux monomères d'actine de façon centrifuge par rapport à la strie Z .
Les microfilaments présentent une conformation extrêmement labile : dans les fibroblastes , les câbles d'actine peuvent se dissocier ou former en quelques minutes , selon que la cellule est plus ou moins mobile , qu'elle est fixée ou non à un support, qu'elle est sur le point de se diviser ... Enfin, divers agents sont connus popur désorganiser les filaments d'actine : la cytochalastine B , alcaloïde tiré d'un champignon, a cette action.
L'actine G globulaire se polymérise en actine F (filament d'actine).
La polymérisation s'amorce par une phase de nucléation, où sont formés majoritairement des trimères. Les monomères s'assemblent ensuite suivant une double hélice, qui n'a donc pas de centre de symétrie. À l'une des extrémités, notée (+) ou extrémité barbue ou encore en brosse, les constantes cinétiques sont en ordre de grandeur 10 fois supérieures à celles de l'autre extrémité, notée (-) ou extrémité pointue. En outre, les monomères associés à l'ATP (ATP-actine), présents en majorité dans les cellules vivantes, ont plus tendance à polymériser que ceux associés à l'ADP (ADP-actine).
L'actine associée à un filament a tendance à hydrolyser son ATP. Cette propriété est, avec la polarité du filament, à l'origine du phénomène dit de « tapis roulant » (anglais : treadmilling). En effet, l'extrémité (+) va avoir tendance à capter en très grande majorité de l'ATP-actine, favorisant par conséquent la polymérisation à cette extrémité. En revanche, l'extrémité (-) étant moins active, l'actine du filament qui en est proche a passé plus de temps sous forme filamentaire, et est majoritairement sous forme d'ADP-actine. Par conséquent, à l'extrémité (-) l'équilibre est déplacé vers la dépolymérisation.

Ces deux déplacements d'équilibre concomitants font que la chaîne croît en permanence du côté (+) et décroît du côté (-). Si on maintient un monomère central fixe, l'ensemble de la chaîne semble donc se déplacer. L'apport d'énergie nécessaire pour maintenir cet état hors équilibre se fait dans le milieu liquide environant, où l'ADP-actine est régénérée en ATP-actine. Le terme « tapis roulant » suggère que les monomères quittant l'extrémité (-) reviennent se fixer à l'extrémité (+) après un passage en solution. Cependant, aucune masse n'est transportée macroscopiquement. Ce processus permet la réalisation d'un moteur moléculaire qui permet à certaines cellules de se déplacer au moyen d'un lamellipode. Il est aussi à l'origine du mouvement de la bactérie Listeria. Cependant, plusieurs autres protéines sont nécessaires et l'actine seule ne peut pas convertir l'énergie chimique d'hydrolyse de l'ATP en travail.
Les protéines associées à l'actine (en anglais, Actin associated proteins, ou AAP) sont la clef du contrôle par la cellule de son stock d'actine. Elles permettent de réguler la polymérisation et d'organiser spatialement les filaments. Elles sont à leur tour contrôlées par des protéines régulatrices qui s'insèrent dans le réseau complexe interagissant avec toute la cellule.

Protéines de réticulation
- Fimbrine : maintient les filaments serrés d'actine fasciculée.
- alpha actinine : protéine dimérique liant 2 microfilaments entre eux, les maintenant parallèles entre eux (point focal d'ancrage...). Elle se lie au pôle + pour permettre l'intéraction actine-myosine notamment dans le mouvement amiboïde.
- Filamine : bloque l'actine réticulée pour l'empêcher de passer en actine fasciculée.
- Villine : maintient les filaments serrés d'actine fasciculée, spécifique des microvillosités.
- Spectrine : permet l'accrochage du microfilament d'actine à la membrane plasmique

4.2.2.2 Les microtubules
- Les microtubules sont les plus gros des "filaments" intracellulaires. Ce sont des tubes de diamètre externe moyen 24 nm environ, qui délimitent une cavité axiale d'environ 15 nm. Leur longueur est variable , pouvant atteindre plusieurs micromètres dans les axones par exemple . Ce sont les microtubules qui forment les centrioles, l'armature des cils et des flagelles ( microtubules stables ), et les fibres fusoriales ( microtubules labiles) lors des divisions cellulaires. Ce sont également des microtubules labiles qui participent à la translocation intracellulaire des granules ( pigments des érythrophores par exemple ) ou des vésicules sécrétoires ( insuline des cellules B du pancréas par exemple ).

- Association et dissociation des tubulines. chaque microtubule est formé de dimères de tubuline alpha et tubuline bêta, deux molécules très semblables, de masse moléculaire de 55.000 u.m.a. A ces protéines majoritaires sont associées d'autres protéines , les " PAM" ( protéines associées aux microtubules ). Les tubulines isolées de diverses espèces sont très semblables, ce qui laisse penser que leur origine phylogénétique est très ancienne.
Les microtubules sont formés de dimères de tubuline. Ces derniers sont composés de deux sous-unités, la tubuline α et la tubuline β, qui sont liées par des liaisons non covalentes. Les dimères sont assemblés bout à bout en protofilaments, qui constituent la paroi des microtubules dont l'intérieur est vide. On compte généralement 13 protofilaments par microtubule.
Comme les dimères de tubuline s'imbriquent toujours dans le même sens, une extrémité des microtubules ne présente que des tubulines β, tandis que l'autre ne présente que des tubulines α; ces deux extrémités sont respectivement nommées (+) et (-). En raison de cette propriété, on dit que les microtubules sont polarisés.
Cet assemblage (les microtubules sont des polymères) est extrêmement dynamique. Les deux extrémités des microtubules polymérisent et dépolymérisent en permanence. L'état des extrémités varie selon la concentration locale de dimères de tubuline et des propriétés cinétiques dynamiques des deux extrémités des microtubules. In vitro, l'extrémité (+), constituée de tubulines β exposées au solvant, est celle qui polymérise le plus vite; l'extrémité (-), constituée de tubulines α exposées au solvant, est celle qui dépolymérise le plus vite. Ainsi, à l'état d'équilibre (in vitro), un microtubule est soumis à un processus dit detreadmilling ou "tapis roulant" pendant lequel sa longueur reste constante alors que le nombre de dimères de tubulines gagnés à une extrémité égale celui de dimères perdus à l'autre. Si l'une des extrémités est "capée" (ou biochimiquement modifiée), ce processus est altéré, tout comme la dynamique du microtubule. In vivo comme in vitro, on peut observer des effondrements rapides ou au contraire la stabilisation des microtubules. Ces deux mécanismes sont mis à profit lors des chimiothérapies dans lesquelles ont utilise de molécules qui modifient les propriétés dynamiques des deux extrémités des microtubules (par exemple, le taxol stabilise les microtubules, la colchicine, les vinblastines et autres vincristines, les déstabilisent).
Il y a trois phases dans la polymérisation des dimères de tubuline qui mène à la mise en place du microtubule : la nucléation, l'élongation et l'équilibre.
La phase de nucléation consiste en l'assemblage des hétérodimères α et β de tubuline concomitant à l'hydrolyse de la GTP (guanosine triphosphate) catalysée par la sous-unité β. Ce germe constitue la base sur laquelle le microtubule croît.
Lors de la phase d'élongation, à l'état stationnaire, le microtubule croît, alors que l'hydrolyse du GTP est retardée par rapport à l'incorporation des dimères de tubulines dans le corps du microtubule. In vitro, les dimères se lient aux deux extrémités libres du microtubule, bien que la polymérisation soit plus rapide à l'extrémité (+). In vivo, le pôle (-) du microtubule est stabilisé pour être lié au centre de nucléation (centrosome), quelle que soit sa localisation dans la cellule.
À l'équilibre, la longueur du microtubule est constante, alors que les processus d'élongation et d'effondrement spontané ont des vitesses égales.
Les microtubules sont susceptibles de s'effondrer totalement sur eux-mêmes in vitro comme in vivo.

La formation des microtubules se fait par auto-assemblage des molécules de tubuline alpha et bêta: le processus est sensible aux contractions locales de Ca2+ ( dissociation favorisée par le calcium ). La dissociation ou l'association des tubulines est réalisée in vitro très facilement. Diverses drogues , telles que la colchicine, la vincristine, ou la vinblastine , d'origine végétale , peuvent se fixer aux dimères de tubuline alpha et bêta et empêcher alors leur association en microtubules. Ceci explique le pourquoi antimitotique de ces drogues : les microtubules ne pouvant évoluer , la mitose ne se déroule pas au delà de la métaphase. Les sites de liaison de ces drogues sont masqués quand les microtubules sont assemblés . L'eau lourde (D2O) possède au contraire une rôle stabilisateur des microtubules polymérisés. Comme la colchicine , elle bloque les transports intracellulaires dépendants des microtubules , ce qui suggère que les microtubules ne peuvent participer à la motilité cellulaire que s'il existe la possibilité de déplacer l'équilibre entre les tubulines libres et les tubulines polymérisées. Dès que l'une des deux formes est "stabilisée", le transport ne peut avoir lieu.
4.2.2.3 Filaments intermédiaires
Les filaments de la classe intermédiaire ne rentrent pas dans l'une des catégories précédentes : leur diamètre est de l'ordre de 10 nm ( 8 à 14), ils sont souvent en relation avec la membrane nucléaire. Ce sont des filaments intermédiaires qui forment des tonofilaments convergents vers les desmosomes. Leur nature biochimique est variable selon les tissus: ils peuvent être composés de plusieurs classes de protéines regroupées sous le nom de cytofilines.
Quatre classes principales de filaments intermédiaires sont retenues, qui reposent sur leur distribution dans les divers types cellulaires et sur la nature biochimique des protéines constituantes :
- Filaments de kératine ;, distribués surtout dans les cellules épithéliales; les kératines forment une famille de protéines de masse moléculaire 42 à 65.000
- Neurofilaments, présents exclusivement dans les neurones ; trois polypeptides distincts sont caractérisés ( masses moléculaires 68.000, 160.000 et 210.000 u.m.a.).
- Filaments gliaux, uniquement rencontrés dans les cellules gliales ( par exemple les astrocytes ) : une espèce protéique caractérisée , de 52.000 u.m.a.
- Filaments constitués de vimentine ( 52.000 u.m.a.), de desmine ( 50.000 u.m.a.), de synémine ( 230.000 u.m.a) , ou d'une combinaison de ces trois espèces protéiques; cette catégorie de filaments semble avoir une distribution plus ubiquiste que les autres.
Les diverses classes de protéines des filaments intermédiaires semblent présenter des propriétés communes .
- Ce sont des protéines fibreuses organisées en alpha hélices, riches en cystéine ;
- Leurs conditions de polymérisation , in vitro, sont très voisines ;
- Elles possèdent des sites de phosphorylation , par des protéines kinases AMPc dépendantes qui pourraient être impliquées dans la détermination des sites d'agrégation ou de polymérisation en filaments.
4.2.2.4 Le réseau microtrabéculaire
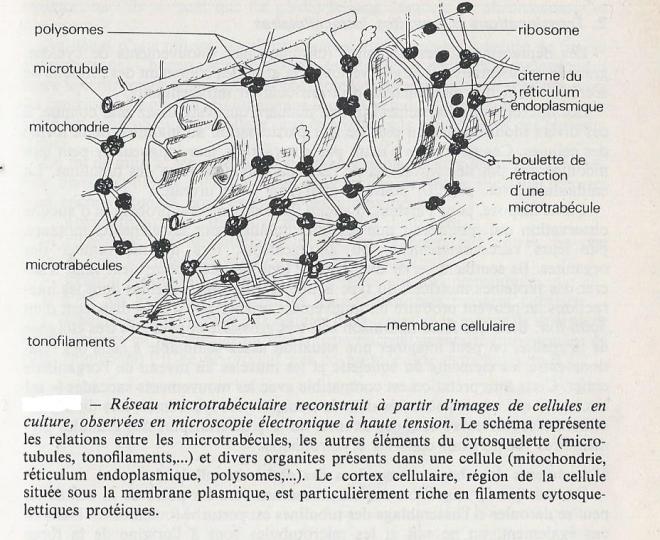
La microscopie électronique à haute tension a révélé, dans le cytoplasme de toutes les cellules étudiées jusqu'alors, un enchevêtrement complexe de filaments organisés selon un réseau tridimensionnel serré. Les organites cellulaires semblent accrochés à ce réseau qui établit par ailleurs de nombreux contacts avec les filaments et tubules du cytosquelette . Les filaments révélés par le microscopie électronique à haute tension sont appelés microtrabéculaires par suite de la ressemblance de la structure qu'ils forment avec la structure trabéculaire de l'os spongieux . Des protéines entrent dans leur constitution. Les microtrabécules sont considérées à l'heure actuelle comme une infrastructure spatiale favorisant la rencontre des enzymes ou des ribosomes avec leurs substrats respectifs, en des sites privilégiés plutôt que de manière aléatoire des structures douées d'une certaine forme de mémoire , dans la mesure où elles semblent pouvoir reprendre leur disposition spatiale initiale après l'avoir modifiée ( mémoire des formes ). Dans tous les cas , il apparaît que le cytoplasme n'est pas une simple solution visqueuse contenant des organites , mais plutôt un complexe très structuré dans lequel le réseau microtrabéculaire serait une unité fonctionnelle , le " cytoplaste " .
 4.3 Filaments du cytosquelette et motilité cellulaire
4.3 Filaments du cytosquelette et motilité cellulaire
4.3.1 Mouvements de type amoeboïdes
Ces mouvements regroupent tous les aspects de la motilité qui appellent une participation de la membrane plasmique de la cellule ; déformation, expansion, rétraction... Il est possible de les expliquer par des interactions entre les microfilaments d'actine et des protéines telles que la myosine , comme schématisé ci-après .
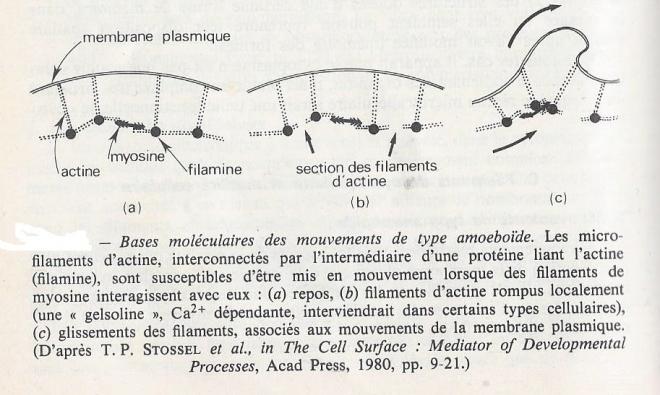
4.3.2 Translocation d'organites cellulaires.
Les déplacements des organites ( chromosomes, mouvements de cyclose; granules pigmentaires) ou des vésicules et granules contenant des produits de sécrétion sont des mouvements de translocation intracellulaire. Les microtubules participent d'une manière qui reste assez mal connue à ces divers mouvements , en plus de leur participation au maintien de la forme des cellules. Par exemple : deux familles de protéines « motrices » interagissent avec les microtubules. Ce sont les kinésines (130 kDa) qui se déplacent vers l'extrémité plus du microtubule et les dynéines (540 kDa), qui se déplacent vers l'extrémité moins (en direction du centrosome) (figure ci-dessous). Ces protéines motrices sont toujours associées à d'autres protéines. La kinésine est associée à une chaîne protéique légère (de 64 kDa) qui lui permet de fixer les organites cellulaires à transporter . La dynéine est emballée dans un complexe protéique constitué de six chaînes intermédiaires (de 53 à 80 kDa) et de six chaînes légères (de 8 à 22 kDa). Ce complexe permet aussi de fixer les organites. Les protéines motrices utilisent l'énergie dérivée de cycles répétés d'hydrolyse de l'ATP pour se déplacer le long du microtubule.Les kinésines sont des homodimères dans lesquels les deux molécules sont enroulées côté queue, laissant libre leurs têtes (domaine moteur) (revoir aussi la myosine-II, figure 4 de cette ressource).
Ces dimères se déplacent à la surface du microtubule (en se fixant uniquement à la  -tubuline) comme on marche sur les pierres d'un passage à gué : les deux têtes de kinésine se fixent tour à tour en effectuant à chaque fois un mouvement de semi-rotation, ce qui se traduit par une progression du dimère le long du microtubule. Le mécanisme de déplacement de la dynéine n'est pas encore élucidé.
-tubuline) comme on marche sur les pierres d'un passage à gué : les deux têtes de kinésine se fixent tour à tour en effectuant à chaque fois un mouvement de semi-rotation, ce qui se traduit par une progression du dimère le long du microtubule. Le mécanisme de déplacement de la dynéine n'est pas encore élucidé.
Les dimères de dynéine et kinésine peuvent être attachés, par leur côté queue, à des structures intracellulaires telles que neurofilaments, filaments intermédiaires, réticulum endoplasmique, Golgi, membrane cytoplasmique, chromosomes (kinétochores) et vésicules de sécrétion. En interagissant coté tête avec les microtubules, ils vont donc permettre le déplacement de ces structures cellulaires.
En rapport avec l'importance du transport le long de l'axone du neurone, les microtubules y sont particulièrement nombreux et durables. Leur stabilité est due à la présence de protéines associées comme MAP2 et Tau. La kinésine assure le transport vers l'extrémité plus du microtubule, c'est-à-dire le transport antérograde (du corps cellulaire vers l'arborisation terminale). Au contraire, la dynéine va assurer le transport vers l'extrémité moins, c'est-à-dire le transport rétrograde.
4.3.3 Mouvement des cils et flagelles
C'est par la flexion de leur faisceau de microtubules que les cils et flagelles peuvent se mouvoir. A la surface de l'épithélium respiratoire (bronches et trachée) les champs de cils ondulent d'une manière coordonnée, ce qui permet le déplacement unidirectionnel (vers l'extérieur) du mucus bronchique. Le battement est un phénomène actif, suivi d'une phase de récupération passive, au cours de laquelle le cil retourne à sa position initiale. Le mouvement d'un cil est produit par la flexion de sa partie centrale, l'axonème

L'axonème, est constitué d'une armature de microtubules arrangés en 9 doublets périphériques qui entourent un doublet central. Chaque doublet périphérique est dû à l'assemblage de deux microtubules qui mettent en commun 3 protofilaments ( sur les treize constitutifs d'un microtubule classique ).
Dans chaque doublet, un microtubule est associé à la dynéine. La dynéine interagit avec le doublet adjacent pour engendrer un mouvement de glissement d'un doublet sur l'autre (figure 26 ci-dessous). Comme la dynéine cytoplasmique (dans le transport des vésicules), la dynéine ciliaire a un domaine moteur qui hydrolyse l'ATP pour se déplacer le long d'un microtubule vers son extrémité moins.

Date de dernière mise à jour : 30/03/2018
Ajouter un commentaire

