- Accueil
- D.Sciences biologiques
- IV.Biologie animale ou zoologie
- 6.physiologie animale
- physiologie animale 4
physiologie animale 4
contraction musculaire
IV. CONTRACTION MUSCULAIRE ET AUTRES ASPECTS DE LA MOBILITE
1. Introduction
L'importance de la contraction musculaire dans la physiologie d'un organisme animal pluricellulaire est considérable. Des éléments musculaires interviennent non seulement lors de leur déplacement de certaines parties de l'organisme ( mouvement ) ou de l'organisme entier ( marche , nage, vol ) , mais aussi dans de nombreux mouvements internes qui mettent en jeu des forces de contraction : propulsion du sang, phénomènes vaso-moteurs, échange de matières avec le milieu environnant , progression des aliments dans le système digestif.
La masse musculaire totale ( fibres striées et fibres lisses ) de l'organisme humain représente environ 45 % de la passe corporelle et l'ensemble du tissus musculaire représente le plus gros consommateur de l'énergie ingérée chaque jour . La masse musculaire d'autres organismes est encore supérieure : l'escargot ou le thon , pour n'en citer que deux en sont des exemples .
La fibre des meuscles striés squelettiques de Mammifères constituait un modèle de choix pour étudier la contraction musculaire : sa spécialisation est telle que sa physiologie est déviée en quasi totalité vers la production de travail mécanique . Son étude a conduit par ailleurs à la compréhension des mécanismes plus généraux de la motilité cellulaire.
Le travail mécanique n'est pas limité aux tissus spécialisés dans le mouvement : toutes les cellules sont potentiellement mobiles ou susceptibles de présenter des modifications de leur morphologie ( interne ou externe ), au moins à certaines période de leur vie ( différenciation, division cellulaire, migrations , ...)
La motilité cellulaire peut également être assurée par l'activité des cils ou des flagelles.
La commande des muscles est nerveuse et la transmission neuromusculaire comprend l'ensemble des phénomènes permettant la libération d'acétylcholine au niveau de la jonction neuromusculaire et conduisant à la contraction musculaire. Les nerfs, comme les fibres musculaires, peuvent générer des potentiels d'action. Les potentiels d'actions issus des fibres nerveuses ne peuvent franchir la fente synaptique. La transmission entre le nerf et le muscle est sous la dépendance de l'acétylcholine libérée au niveau de la jonction neuromusculaire. L'acétylcholine va venir se fixer sur les récepteurs cholinergiques de la plaque motrice, entraînant l'ouverture du canal ionique du récepteur et une variation locale du potentiel membranaire. Quand cette modification atteint un potentiel seuil, un potentiel d'action musculaire apparaît avant d'entraîner une contraction musculaire.
2. Le muscle strié squelettique
2.1 Ultrastructure de la fibre musculaire striée squelettique
La physiologie de la fibre striée ne peut être comprise sans en avoir une bonne connaissance structurale .
2.1.1 Situation générale
Les muscles striés squelettiques sont formés de fibres musculaires insérées sur une charpente conjonctive. Le tissus conjonctif comprend une substance fondamentale peu abondante , riche en fibres de collagène et de réticuline. Les fibres musculaires n'ont pas de relation directe avec les os . On retient le terme de fibre musculaire et non de cellules musculaire striée squelettique car chaque entité est un élément plurinucléé, qui peut renfermer plusieurs centaines de noyaux parfois . La fibre est considérée comme un syncytium, c'est à dire un ensemble de cellules ayant fusionné et qui présentent las caractéristiques fonctionnelles d'une cellule géante.
Les fibres musculaires striées dont des éléments fuselés de grande taille ( 10 à 100µm de diamètre susqu'à 30 cm de longueur). entourés d'une membrane épaissie , le sarcolemme. L'intérieur de la fibre est remplie en presque totalité par des fibres parallèles ( myofibrilles , longs cylindres allongés dans le sens longitudinal de la fibre . Les fibrilles sont groupées en faisceaux de fibrilles et présentent une striation transverse périodique à l'examen microscopique.
L'espace laissé vacant entre les myofibrilles est occupé par le cytoplasme ( sarcoplasme ) et les divers organites de la fibre. Le réticulum sarcoplasmique présente un système complexe de canaux et de compartiments autour des myobibrilles . Les noyaux sont situés à la périphérie, dans des enclaves du sarcoplasme . On trouve également dans le sarcoplasme , les organites habituels de toute cellule : dictyosomes de l'appareil de Golgy, à un pôle de chaque noyau, mitochondries ( sarcosomes ) et des inclusions telles que le glycogène et un pigment apparenté à de l'hémoglobine , la myoglobine.
Trois dispositions anatomiques sont plus particulières à la fibre musculaire : le sarcolemme, les myofibrilles et le système des canaux.
2.1.2 Périphérie de la fibre : le sarcolemme
Le sarcolemme est formé par l'association de la membrane plasmique et d'une lame basale épaisse , riche en glycoprotéines et en fibres de réticuline ( les fibres de réticulines sont elles même formée de collagène et quelques glycoprotéines associées : elles sont d'origine conjonctive ). Le sarcolemme établit des relation étroites avec le réseau conjonctif intramusculaire et les nombreux capillaires qui sillonnent celui-ci . La membrane plasmique sensu stricto envoie des invaginations vers l'intérieur de chaque fibre musculaire , pour former le système T.
2.1.3 Les myofibrilles
Les myofibrilles accupent environ 80 % du volume de la fibre musculaire . On dénombre quelques centaines à quelques milliers par fibre, et sur une coupe transversale de muscle strié environ un million par mm2 . chaque myofibrille est un long cylindre de 1 à 2 µmsur plusieurs cm de longueur . La striation transversale périodique des myofibrilles provient de l'alternance de deux types de disques qui ne présentent pas la même réfringence à l'examen optique . Les disques A ( ou bandes A ) anisotropes et les disque I ( ou bandes I), isotropes. Chaque disque A présente à mi hauteur une bande claire , la strie H au milieu de laquelle se trouve se trouve la ligne M plus sombre. Au milieu de chaque disque I se trouve une strie Z; la terminologie des stries ( H, M,Z ) ne doit pas faire oublier qu'il s'agit là , de structures en disques.
Quelque soit l'état de contraction ou de relâchement du muscle , la hauteur de chaque disque A reste constante alors que les disques I ont une hauteur variable.
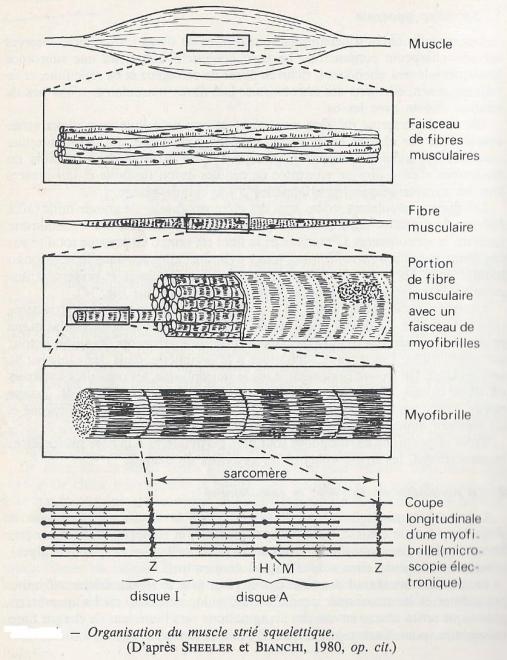 L'unité contractile est appelée sarcomère ; elle est formée d'un disque A et de deux demi disques I qui lui sont adjacents ; les stries Z partagent donc les myofibrilles en sarcomères. Les sarcomères de toutes les myobibrilles étant situés au même niveau dans une fibre musculaire , ils donnent l'aspect strié transversal caractéristique de ce type cellulaire.
L'unité contractile est appelée sarcomère ; elle est formée d'un disque A et de deux demi disques I qui lui sont adjacents ; les stries Z partagent donc les myofibrilles en sarcomères. Les sarcomères de toutes les myobibrilles étant situés au même niveau dans une fibre musculaire , ils donnent l'aspect strié transversal caractéristique de ce type cellulaire.
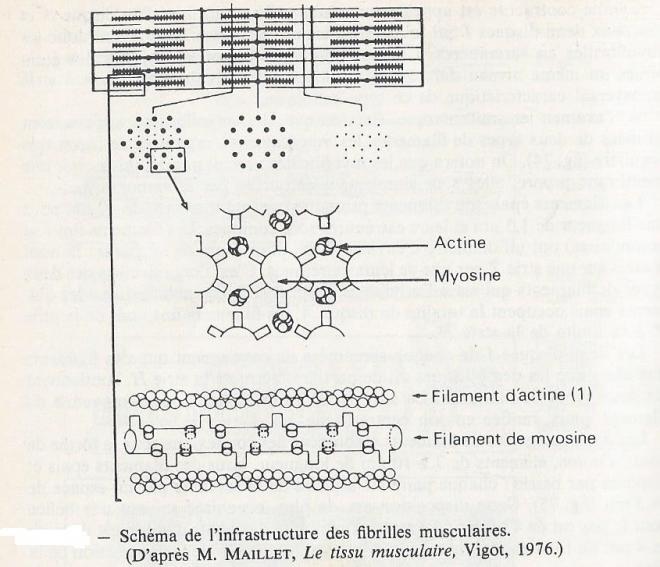
A l'examen en microscopie électronique , les myofibrilles apparaissent formées de deux types de filaments , les myofilaments , organisés de façon très régulière. On notera que les myofibrilles ne sont pas délimitées par une membrane propre, elles sont simplement entourées par le sarcoplasme.
Les filaments épais ( ou filaments primaires ) ont un diamètre de 10 nm pour une longueur de 1,5 µm et leurs extrémités sont coniques. Les filaments fins ( ou secondaires ) ont un diamètre de 6 nm pour 1 µm de longueur , ils sont insérés sur une strie Z par une de leur extrémité . C'est l'organisation des deux types de filaments qui est à l'origine de l'aspect strié des myofibrilles ; les filaments épais occupent la totalité du disque A , les filaments fins vont de la strie Z à la limite de la strie H. Les demi disques I de chaque sarcomère ne contiennent que des filaments fins alors que les demi disques A, de part et autre de la strie H contiennent les deux types de filaments . La strie H est formée de la partie moyenne du filament épais , renflée en son centre ( ligne M ).
Les deux catégories de filaments établissent des connections sous la forme de ponts d'union, éléments de 7 à 10 nm de longueur , issus des filaments épais et disposés par paires : chaque paire est séparée de la suivante par un espace de 14,3 nm . Cette disposition est, de plus, organisée selon une hélice dont le pas est de 42,9 nm . Au repos, l'extrémité des ponts d'union est distante de 4nm du filament fin; le contact n'est établi que lors de la contraction de la fibre.
Les coupes transversales révèlent que chaque filament épais est entouré de six filaments fins , ce qui donne une disposition très caractéristique , à motifs hexagonals.
2.1.4 système transverse et réticulum sarcoplasmique
a. Le système transverse
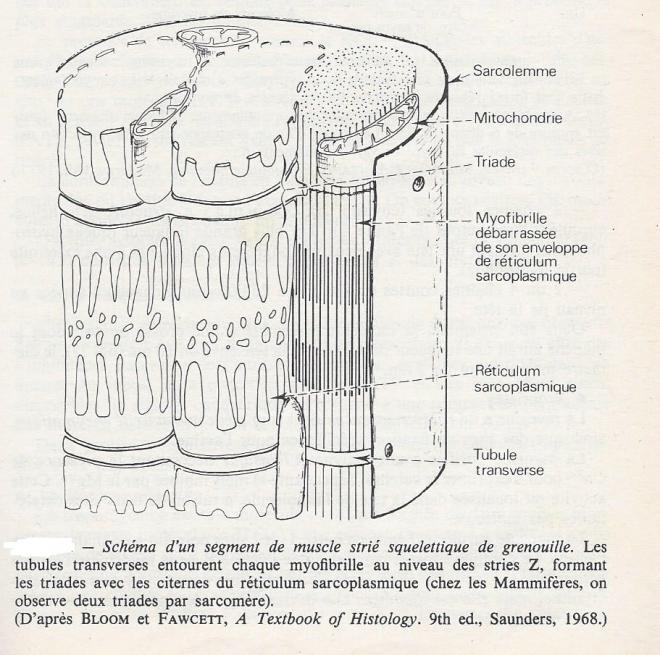
Appelé aussi système de tubules T, est formé par des invaginations de la membrane plasmique qui forment des réseaux transversaux, canaux cylindriques de 50 à 100 nm de diamètre, contournant les diverses myofibrilles à un même niveau des sarcomères et selon des plans perpendiculaires au grand axe de la fibre . La lumière des tubules T est ainsi en continuité avec le milieu extracellulaire, disposition qui permet une transmission rapide, en profondeur, des phénomènes électrophysiologiques affectant la membrane plasmique lors de la stimulation.
b. Le réticulum sarcoplasmique
Disposé en manchons fenêtrés et anastomosés autour des myofibrilles ; il donne naissance à des tubules longitudinaux de 50 à 80 nm de diamètre, qui tapissent la périphérie de chacune . La structure du réticulumest en rapport étroit avec la disposition périodique des sarcomères ; à intervalles réguliers, les manchons du réticulum sont dilatés pour former des sacs latéraux , ou citernes terminales , jouxtant les Tubules T . Sur les coupes longitudinales des myofibrilles, le tubule T est encadré par deux sacs latéraux et forment ainsi une triade . A ce niveau, la membrane du tubule T et celle du réticulum sarcoplasmique sont séparées par un espace de 12 à 15 nm, interrompu par des zones denses considérées comme des zones de couplages électrophysiologique entre les deux types de membranes. La disposition des triades , par rapport à la striation des myofibrilles , est variable selon le muscle considéré : elle est différente chez la grenouille , le lapin ou l'homme...
2.2 Les bases moléculaires de la contraction
L'essentiel des études concernant la contraction musculaire a été mené chez le lapin avant d'être généralisé à de nombreuses espèces . L'analyse biochimique des constituants de la fibre musculaire a permis d'enrichir d'une manière spectaculaire la connaissance structurale que l'on en avait. Les fibres musculaires renferment essentiellement deux espèces protéiques insolubles dans l'eau , l'actine et la myosine , molécules qui constituent la plus grande partie des filaments . Les protéines musculaires solubles dans l'eau ne représentent guère que 20 à 25 % des protéines totales. Cette fraction soluble correspond surtout aux enzymes de la glycolyse. Les myofilaments sont constitués surtout par la myosine et l'actine , mais ils renferment aussi d'autres protéines associées à la ligne Z ou à la ligne M, ou intervenant dans la régulation de la contraction . On envisagera successivement les protéines motrices et les protéines régulatrices.

2.2.1 Les protéines motrices
On préfèrera l'adjectif " motrices ", qui nous paraît plus adapté à la physiologie de ces protéines que l'adjectif " contractiles " classiquement utilisé ( les protéines ne se contractent pas, elles glissent seulement lors de la contraction ).
2.2.1.1 La myosine
- La molécule
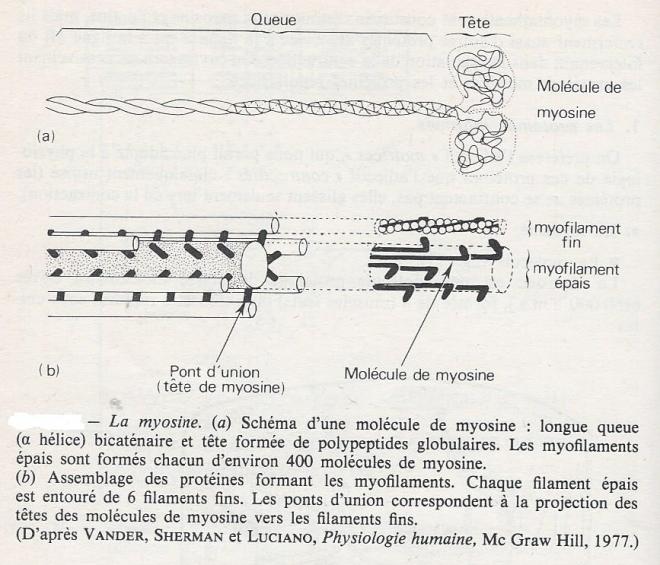
La myosine est une molécule protéique de masse moléculaire élevée ( 460.000 u.m.a), formée de 4 ( muscles lents) ou 6 ( muscles rapides ) sous-unités :
- 2 chaînes lourdes ( environ 200.000 u.m.a) à structure d'alpha hélice , enroulées l'une autour de l'autre sur leur plus grande longueur ( queue hydrophoble ) et formant une tête avec deux prolongements globuleux à une extrémité ( partie hydrophile ).
- 2 ou 4 chaînes courtes ( de 16.000 à 25.000 u.m.a chacune ) situées au niveau de la tête.

Dans son ensemble la molécule ressemble à une crosse de golf dont le manche aurait une longieur de 150 nm et la tête environ 10 nm, le diamètre moyen étant de 2 nm.
- Propriétés
La myosine a un rôle structural évident et possède une activité enzymatique, ainsi que des sites de fixation spécifiques pour l'actine. La myosine purifiée a une activité ATpasique nécessitant la présence de Ca2+ pour s'exprimer ( " Calcium dépendante ) mais inhibée par le Mg2+ . Cette activité est localisée dans la tête de la molécule à raison de deux sites catalytiques par molécule.
La myosine puréfiée présente en outre 1 ou 2 sites pouvant reconnaître et lier l'actine . Le complexe formé par liaison de l'actine et de la myosine est appelé actomyosine. L'activité ATpasique de la myosine persiste au sein de l'actomyosine , mais elle est modifiée : elle devient Mg2+ dépendante au lieu d'être inhibée par le Mg2+.
- agencement des molécules en faisceaux
Dans un myofilament épais ( 10 nm sur 1500nm), les longues molécules de myosine ( 150 nm) sont regroupées en faisceaux d'environ 400 unités, dans lesquels elles sont disposées tête-bêche par rapport à le zone M . Les molécules se chevauchent en partie et leurs têtes étant dirigées vers l'extérieur du faisceaux font saillie à la périphérie et sont réparties suivant une hélice régulière de pas 42,9 nm. Ces protubérances forment des ponts d'union , mentionnés plus haut, lors de la contraction . La disposition des molécules de myosine autorise un effet de pliure du segment droit lors de l'attachement de la tête de myosine à l'actine, pliure qui permet le glissement des deux types de filaments l'un par rapport à l'autre. .

La cohésion des faisceaux de molécules de myosine serait assurée par la protéine de la ligne M.
2.2.1.2 L'actine
L'actine est une protéine globulaire ( actine " G" ) de diamètre 5,5 nm, faite d'une chaîne de 376 acides aminés ( 41.785 u.m.a). La séquence des acides aminés qui la constituent est connue pour plusieurs espèces. C'est la protéine la plus abondante dans les filaments fins. En présence de sels neutres , comme le KCl, et d'ATP, les molécules d'actine G s'associent en un polymère fibreux ( l'actine " F"), formé de deux brins torsadés l'un autour de l'autre . Une molécule d'actine G peut fixer un Ca2+et une molécule d'ATP ( ou ADP). Lors de la polymérisatrion de l'actine G en actine f , chaque monomère rajouté nécessite l'hydrolyse d'une molécule d'ATP¨, l'ADP formé restant fixée sur le monomère alors que le phosphate est libéré.
La conformation de l'actine en filaments se retrouve au niveau des myofilaments fins où l'actine F forme l'âme du filament , on compte environ 350 molécules d'actine G dans chaque myofilament fin. L'actine associée à deux autres protéines, la desmines et la vimentine constitue aussi le squelette des stries Z.
2.2.2 Les protéines régulatrices
L'interaction entre la myosine des filaments épais et l'actine des filamùents fins ne se produit que lors de la contraction musculaire . Il existe en effet des ' inhibiteurs naturels " de l'interaction entre les protéines motrices dans un muscle au repos , à la condition que l'ATP et les ions Mg2+ soient disponibles ( la rigidité cadavérique correspond à une contraction permanente des muscles, consécutive à la cessation du renouvellement de l'ATP).
Deux protéines régulatrices de la contraction interviennent : le tropomyosine et la troponine .
2.2.2.1 La tropomyosine
La tropomyosine est une molécule protéique formée de deux chaînes identiques de masse moléculaire de 32.000 u.m.a environ environ chacune . La molécule forme une fibre de 40 nm sur 2 nmet les différentes molécules sont placées bout à bout, dans les deux gouttières dessinées par les polymères d'actine F, et compte tenu de sa longueur , elle s'étend sur 7 monomères d'actine . A chaque myofilament fin sont associées environ cinquantes molécules de tropomysosine.
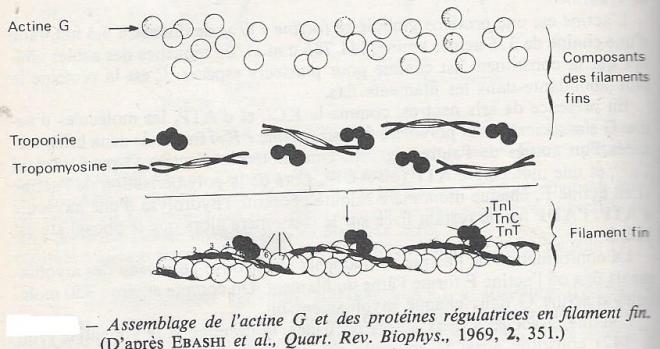
2.2.2.2 La troponine
La troponine (TN) est une protéine globulaire ( 80.000 u.m.a )formée de trois sous unités polypeptidiques dont les propriétés sont différentes.
- La TNC-C ( 18.000 u.m.a) peut lier quatre ions Ca2+ très fortement et change alors de conformation
- La TN-I ( 23.000 u.m.a ) est la sous unité inhibitrice ; elle comporte un site de reconnaissance spécifique de l'actine et c'est sa présence qui empêche l'interaction de la tête de myosine avec l'actine .
- La TN-T ( 39.000 u.m.a ) est la sous-unité qui fixe l'ensemble à la tropomyosine .
Chaque molécule de troponine est fixée au filament d'actine F par l'intermédiaire d'un site de laison spécifique de l'actine . et la tropomyosine par un autre site . on compte environ une molécule de troponine tous les 40 nm, au contact de l'une des extrémités de chaque molécule de tropomyosine.
2.2.3 Glissements moléculaires et contraction musculaire
Lors de la contraction d'un sarcomère, la longueur des deux catégories de filaments reste invariable : le mouvement provient d'un glissement relatif des deux types de filaments . Les filaments fins glissent entre les filaments épais vers le milieu du disque A. En se déplaçant , ils diminuent l'épaisseur du disque I et peuvent faire disparaître la bande H ; dans leur mouvement , ils entraînent les stries Z et c'est la multiplication de ce mouvement qui provoque un rapprochement des deux parties extrêmes de la fibre.
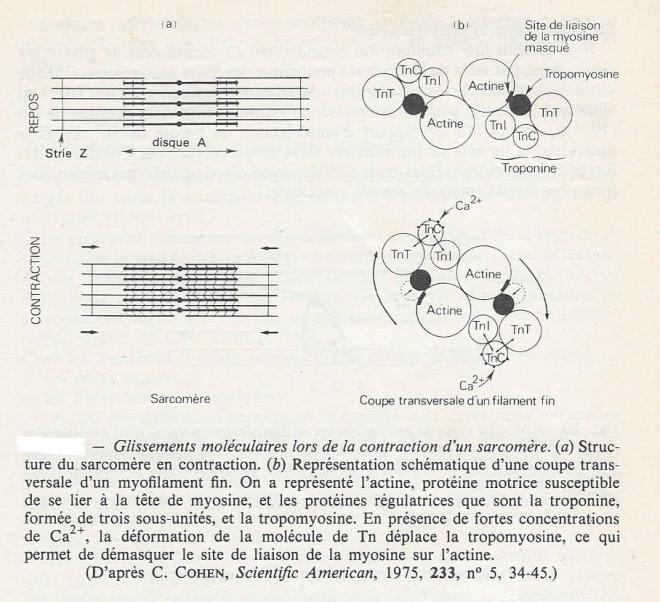
Le mouvement paraît continu lors de l'observation microscopique ; en réalité, il est provoqué par le répétition , un grand nombre de fois , d'un mouvement élémentaire de très petite amplitude. En présence d'un concentration de calcium suffisante ( Ca2+), la molécule de troponine ( sous unité TN-C) change de conformation , après avoir fixé 4 ions Ca2+ , et ceci permet à la tropomyosine de s'enfoncer davantage dans le sillon où elle se trouve , avec pour conséquence l'exposition du site de reconnaissance de la myosine situe sur l'actine G ( figure ci-dessus). La formation des ponts d'union entre myosine et filaments d'actine est alors possible . Après s'être fixée au filament d'actine , la tête de la molécule de myosine pivote et se déplace d'environ 10 nm, processus qui produit l'énergie mécanique de la contraction . Le Ca2+ est alors libéré, les liaisons sont rompues et le même mécanisme se reproduit plusieurs fois , avec à chaque fois progression du filament fin, de quelques nm. Le relâchement se produit lorsque la concentration locale du Ca2+ diminue : la troponine ne peut plus fixer le Ca2+, ce qui permet à la tropomyosine de reprendre sa position initiale , en masquant le site de liaison de la myosine à l'actine : les filaments glissent alors vers leur position initiale jusqu'à la prochaine contraction.
2.3 Mécanisme énergétique de la contraction
2.3.1 Mécanisme

La suite des évènements peut, en première approximation, être découpée en quatre étapes :
- Au repos, la myosine est couplée à de l'ADP et du phosphate inorganique (Pi). Après démasquage des sites de liaison de la myosine portés par l'actine en présence de calcium, les têtes de myosine vont se lier à l'actine.
- Le départ du phosphate inorganique, puis de l'ADP, va stabiliser la liaison actine-myosine et entraîner un changement de conformation de la myosine. L'angle que fait la tête de myosine avec la queue alongée va diminuer de 90° à 45°. Myosine et actine étant liées, ce changement de conformation va entraîner un mouvement relatif entre filaments fins et filaments épais. La configuration obtenue, stable en absence d'ATP, est appelée configuration rigor car elle est à l'origine de la rigidité cadavérique (rigor mortis).
- La liaison d'une molécule d'ATP sur la tête de myosine entraîne la dissociation de la liaison actine-myosine.
- Enfin l'hydrolyse de cet ATP en ADP + Pi entraîne un changement de conformation de la myosine : l'angle formé par la tête et la queue de myosine revient à sa valeur initiale. Au final, la tête de myosine s'est donc dépacée vers l'extrémité "plus" du filament d'actine (située côté strie Z).
Ce cycle peut se reproduire aussi longtemps que la concentration en calcium reste élevée. A chaque fois, la myosine se fixe une peu plus prés de l'extrémité "plus" du filament d'actine, c'est à dire plus prés du disque Z. Comme la même chose se produit à l'autre extrémité du filament de myosine, les deux disques Z se rapprochent, ce qui correspond à un raccourcissement du sarcomère
La contraction musculaire est provoquée par une augmentation de la concentration en calcium intracellulaire, le relâchement est donc obtenu par un retour à la concentration initiale.
L'augmentation de la concentration en calcium intracellulaire ne dure que quelques millisecondes. Le retour à la situation initiale est rapidement obtenu par l'action convergente de trois phénomènes :
- La fermeture rapide des canaux calciques
- La liaison du calcium sur différentes protéines (dont la troponine)
- Le pompage actif vers la lumière du reticulum sarcoplasmique par des ATPases calcium-dépendantes appelées SERCA.
On estime que le temps nécessaire pour ramener le taux de calcium intracellulaire à sa valeur de repos est de l'ordre de 30 ms. La concentration en calcium diminuant, on a dissociation du calcium lié à la troponine C, ceci entraînant le rétablissement de l'inhibition exercée par la troponine I sur la liaison actine-myosine. En conséquence, le muscle se relâche.
2.3.2 Besoins énergétiques immédiats
C'est donc l'ATP qui est utilisé comme carburant pour la contraction, mais sa concentration dans le srcoplasme est faible ( 2 à 4 mmol/l) et doit être régénérée rapidement . Plusieurs processus de régénération de l'ATp, de mise en jeu plus ou moins rapide , interviennent après ( ou pendant) la contraction. L'un des processus fait intervenir deux voies de transphosphorylation qui produisent de l'ATPà partir d'ADP :
- deux molécules d'ADP peuvent redonner de l'ATP ,
ADP + ADP <==> ATP + AMP, réaction catalysée par la myokinase, enzyme spécifique du muscle .
- L'ADP peur être " rechargée" en ATP à partir d'autres molécules riches en énergie présentes dans le cytoplasme , les phosphagènes. Chez les Vertébrés et quelques Invertébrés, la créatine phosphate représente le réservoir de liaisons phosphates, alors que chez les Invertébrés, c'est en général l'arginine phosphate :
créatine ( arginine ) - P + ADP <==> créatine ( arginine ) + ATP.
2.3.3 Adaptation énergétique lors des contractions
La réserve de phosphagène n'est pas illimitée et lors d'une contraction prolongée ( ou après la contraction ), la cellule doit reconstituer ses réserves de molécules phosphorylées. Le glycogène musculaire est immédiatemment disponible et il est dégradé en empruntant la voie de la glycolyse pour donner du pyruvate puis, selon les conditions d'oxygénation soit de l'acide lactique ( manque d'oxygène ), soit du dioxyde de carbone et de l'eau via le cycle de Krebs . La mobilisation du glycogène est réglée à la fois par un mécanisme hormonal et par la concentration locale de Ca2+ .
Chez les Vertébrés, il existe au moins deux classes de fibres musculaires :
- les fibres rapides
- les fibres lentes ( ou toniques )
En plus des différences concernant la rapidité et la durée des contractions ces deux catégories se distinguent par leurs aptitudes métaboliques : les fibres rapides renferment peu de myoglobine ( " fibres blanches " ) , beaucoup de réserves de glycogène et sont adaptées à des contractions rapides mais peu durables en conditions anaérobies; ; le métabolisme aérobie des fibres toniques leur permet au contraire des contractions durables , sans fatigue notable .
Les fibres musculaires font également appel à d'autres substrats énergétiques ( glucose, acides gras, corps cétoniques, acides aminés ) et la gestion des divers stocks énergétiques de l'organisme fait l'objet de régulations très précises qui s'envisagent dans le cadre plus général de l'adaptation à l'exercice musculaire d'un organisme .
2.4 de l'excitation à la contraction : le couplage électromécanique
Le stimulus normal d'une fibre musculaire striée squelettique est nerveux. Chaque fibre reçoit en effet une terminaison axonique issue d'un neurone moteur, au niveau d'une synapse neuro-musculaire , encore appelée jonction neuro-musculaire ou plaque motrice. L'information qui arrive au niveau de la terminaison nerveuse se manifeste sous forme d'un potentiel d'action et la réponse du muscle est une contraction. La séquence d'évènements qui relie le stimulus , parvenu à la fibre musculaire , à la contraction de celle-ci est appelée couplage électromécanique , ou couplage stimulus contraction.
2.4.1 La plaque motrice

La plaque motrice est un ensemble structural et fonctionnel constitué par :
- une terminaison axonique
- une partie adjacente de la fibre musculaire
- la fente synaptique entre les deux ;
La plaque motrice est une synapse de type chimique . La transmission du message nerveux se fait à son niveau par l'intermédiaire d'un transmetteur chimique , l'acétylcholine , libérée par la terminaison axonique et captée par la membrane de la fibre musculaire.
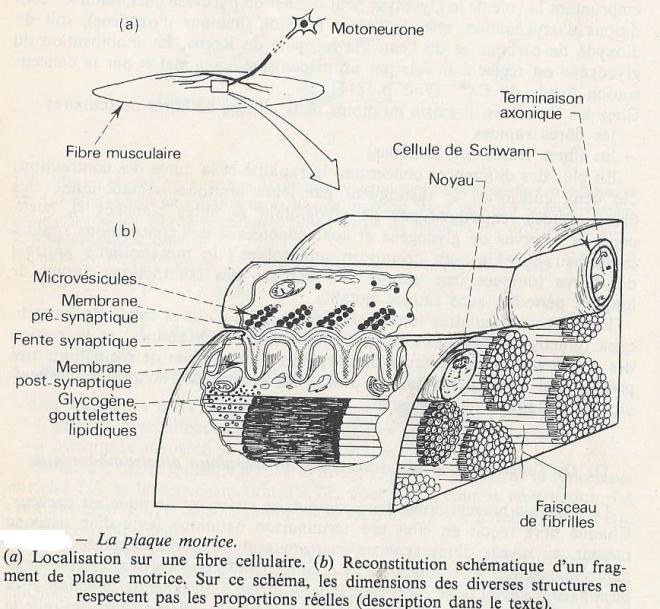
2.4.1.2 Composante nerveuse
La terminaison axonique perd le manchon de myéline lorsqu'elle arrive au voisinage de la fibre musculaire et seule une fine pellicule du cytoplasme de la cellule de schwann persiste sur les parties de l'axone qui ne sont pas tournées vers la fente synaptique. l'arborisation terminale de l'axone ( brins d'environ 1µm de diamètre) vient se loger dans des gouttières qui courent longitudinalement à la surface de la fibre musculaire. La membrane de la terminaison axonique forme la membrane présynaptique . Le cytoplasme de l'axone renferme des mitochondries , des grains de glycogène, éléments qui participent au métabolisme énergétique , un réticulum endoplasmique lisse et de nombreuses microvésicules d'environ 40 nm de diamètre dont certaines sont distribuées de manière aléatoire dans le cytoplasme de la terminaison axonique alors que d'autres sont disposées en files régulières sur les rides de la membrane présynaptique en regard des replis transversaux de la membrane postsynaptique. les microvésicules renferment chacune quelques 5.000 molécules d'acétylcholine .
L'absence de ribosomes à ce niveau de la terminaison nerveuse exclut toute possibilité de synthèses protéiques. Les enzymes nécessaires à la synthèse de l'acétylcholine ou aux réactions productrices d'énergie sont apportées, depuis le péricaryon, par le flux axonal.
2.4.1.3 Fente synaptique
C'est un espace de 20 à 40 nm qui sépare les membranes pré et post-synaptique . Elle est remplie de mucopolysaccharides.
2.4.1.4 composante musculaire
La membrane de la fibre musculaire ( membrane post synaptique ) présente un ensemble de replis transversaux ,par rapport à l'axe de la fibre, et dirigés vers l'intérieur du sarcoplasme. Ces replis ont une périodicité d'environ 1 à 2 µm et sont présents tout au long de la gouttière qui reçoit la terminaison nerveuse. leur ensemble forme l'appareil sous-neural et multiplie considérablement la surface membranaire à ce niveau.
2.4.2 L'acétylcholine, transmetteur de la jonction neuro musculaire.
2.4.2.1 Synthèse de l'acétylcholine
L'acétylcholine est formée par acétylation de la choline, réaction catalysée par une enzyme , la choline acétyltranférase ( " CAT"), présente dans le cytoplasme de la terminaison nerveuse. le radical acétate provient de l'acétyl-coenzyme aque produisent les mitochondries. Formée dans le cytoplasme , l'acétyl choline est ensuite stockée dans les microvésicules ( ou vésicules ).
2.4.2.2 Libération de l'acétylcholine
La libération de l'acétylcholine dans la fente synaptique est réalisée par exocytose du contenu des microvésicules.
En dehores de toute stimulation nerveuse, il se produuit une libération permanente , aléatoire de quelques vésicules , ce qui donne naissance aux potentiels miniatures enregistrés juste au niveau de l'appareil sous - neural . La libération synchgrone du contenu de plusieurs microvésicules d'acétylcholine dans la fente synaptique au niveau des " zones actives " , serait à l'origine de la dépolarisation élémentaire ( potentiels miniatures ) de la membrane post synaptique . on parle ainsi de libération quantique de l'acétylcholine ; les vésicules sont de tailles très voisines donc toute décharge d'acétyl choline libère un nombre de molécules qui ne peut être qu'un multiple du nombre moyen de 5000 donné plus haut.une exocytose massive est provoquée par la dépolarisation de la partie terminale de l'axone ( potentiel d'action ) ce sont environ 250 quanta qui sont libérés dans la fente synaptique ( 250 vésicules ). La fusion des membranes des microvésicules avec la membrane présynaptique , puis l'exocytose d'acétylcholine sont provoquées par l'ouverture de canaux Calcium voltage dépendants présents dans la terminaison axonique ; la concentration de Ca2+ extracellulaire étant très supérieure à la concentration intracellulaire , les ions Ca2+ s'engouffrent dans la terminaison et déclenchent la fusion des membranes . Seules les microvésicules situées au voisinage immédiat de la membrane sont recrutées lors de l'exocytose.
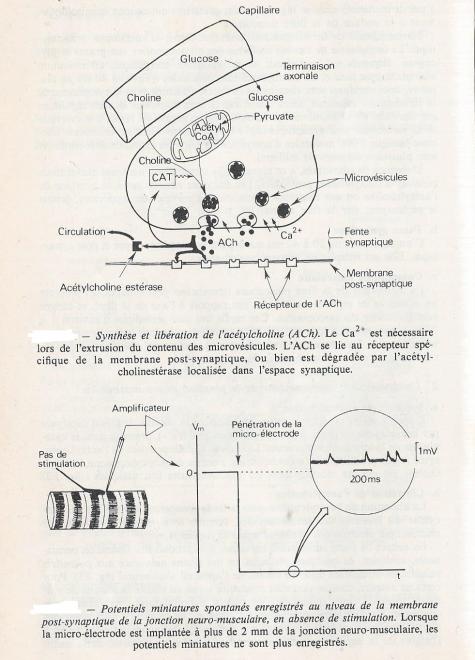
Le " délai synaptique " ( 200 à 300 µs ), qui correspond au retard de la propagation d'un potentiel d'action , lorsqu'il franchit une synapse , est liée à la durée du processus d'exocytose et non à la phase suivante , la liaison de l'acétylcholine à son récepteur . Le phénomène est fugace et la concentration de Ca2+ revient rapidement à son niveau initial dans le cytosol.
il est clair que la fusion de centaines de vésicules d'exocytose à la membrane présynaptique , lors de chaque potentiel d'action , aurait pour effet d'accroître considérablement la surface de la membrane si un mécanisme régulateur n'intervenait pas . Il existe effectivement une endocytose active qui permet à la fois le recyclage des membranes et celui des produits de l'action de l'acétylcholinestérase, enzyme d'inactivation de l'acétylcholine ; La choline est en outre absorbée par une pompe spécifique.
2.4.2.3 Le récepteur à l'acétylcholine
Les récepteurs nicotiniques de l'acétylcholine sont des homo- ou hétéro-pentamères transmembranaires de poids moléculaire 350 kiloDaltons. Ils sont constitués de 5 sous-unités (α2βγδpour le récepteur musculaire). Chaque sous unité est composée principalement de deux domaines: extracellulaire et membranaire. Le domaine extracellulaire forme le site de fixation des ligands à l'interface entre deux sous-unités (dont une sous-unité α). Le domaine membranaire forme un tunnel, ou canal, permettant le passage à travers la membrane des ions sodium, potassium ou calcium. Ce sont donc des canaux cationiques relativement peu sélectifs. Les nAChRs contiennent tous les éléments nécessaires à la conversion d'un signal chimique (libération d’ACh dans la synapse) en message électrique (de dépolarisation de la membrane cellulaire) : les sites de reconnaissance de l'ACh et un canal cationique qui sont couplés l'un à l'autre.
2.4.2.4 Potentiel de plaque motrice et contraction
Leur activation provoque l'entrée de Na+, ce qui produit une dépolarisation localisée appelée potentiel de plaque motrice (PPM). Ce PPM ouvre les canaux Na+ voltage-dépendant et déclenchent un potentiel d'action classique. Celui-ci parcourt la fibre musculaire et pénètre dans le tubule transverse, où il stimulera la libération du calcium contenu dans le réticulum sarcoplasmique. L'élévation de la concentration intracellulaire en ions calcium provoque la contraction des muscles squelettiques - action du Ca2+ sur la troponine - C - ( voir plus haut) .
2.4.2.5 Les potentiels de plaque motrice ( PPM ) , notion de PPSE et PPSI
Un potentiel postsynaptique excitateur (PPSE) est un changement de la valeur du potentiel de membrane (dans le sens d'une dépolarisation) localisé dans le neurone postsynaptique. Cette dépolarisation est causée par un mouvement d'ions (cations) à travers la membrane, lui-même permis par l'ouverture de récepteurs postsynaptiques (canaux membranaires) provoqué par les neurotransmetteurs largués dans l'espace synaptique par l'axone ou le dendrite d'une cellule présynaptique.
En neurosciences, un potentiel postsynaptique excitateur est une réduction temporaire du potentiel de membrane postsynaptique provoqué par un flux d'ions dont le potentiel de repos est positif (sodium et calcium principalement) entrant dans la cellule postsynaptique. Cela constitue l'opposé du potentiel postsynaptique inhibiteur (PPSI), qui est généralement causé par un flux entrant d'ions négatifs dans la cellule. Un potentiel postsynaptique est dit excitateur s'il facilite le déclenchement d'un potentiel d'action dans le neurone. Les PPSE peuvent aussi être dues à une diminution des charges positives sortantes, tandis que les PPSI sont parfois dues à une augmentation des charges positives sortantes. Le flux d'ions qui provoque un PPSE est appelé courant excitateur postsynaptique.
Les PPSE et les PPSI sont des potentiels additifs. Quand des PPSE multiples surviennent sur un même patch de membrane postsynaptique, alors leurs effets combinés sont simplement la somme des PPSE individuels. Les plus grands PPSE sont dus à une plus grande dépolarisation de la membrane qui du coup, augmente la chance que la cellule postsynaptique atteigne le seuil de déclenchement d'un potentiel d'action.
2.4.2.6 De la fixation de l'acétylcholine sur le récepteur au potentiel d'action Au repos, le canal ionique du récepteur est fermé. La fixation d'une molécule d'ACh sur chacune des deux sous unités  provoque une modification de la conformation allostérique du récepteur entraînant l'ouverture du canal ionique. La taille du canal ionique en position ouverte (0,65 nm) permet le passage des ions (Na+, K+, Ca2+) . Seuls les cations sont concernés et il n'y a que peu de sélectivité . Cependant, les mouvements potassiques sont proches de zéro en raison du gradient électrochimique qui va freiner la sortie des ions potassiques. En revanche, pour le sodium, le gradient de concentration et la différence de potentiel vont attirer massivement les ions sodiques à l'intérieur de la cellule musculaire. Il en est de même pour le calcium mais sa concentration extra-cellulaire est beaucoup plus basse que celle du sodium. Ainsi, durant l'ouverture du canal ionique d'un récepteur jonctionnel, environ 103 ions sodium vont pénétrer dans la cellule . La durée d'ouverture du canal ionique est dépendante du type de récepteur et de l'agoniste. L'acétylcholine va quitter le récepteur en un temps beaucoup plus bref que sa durée d'ouverture moyenne (1 ms).
provoque une modification de la conformation allostérique du récepteur entraînant l'ouverture du canal ionique. La taille du canal ionique en position ouverte (0,65 nm) permet le passage des ions (Na+, K+, Ca2+) . Seuls les cations sont concernés et il n'y a que peu de sélectivité . Cependant, les mouvements potassiques sont proches de zéro en raison du gradient électrochimique qui va freiner la sortie des ions potassiques. En revanche, pour le sodium, le gradient de concentration et la différence de potentiel vont attirer massivement les ions sodiques à l'intérieur de la cellule musculaire. Il en est de même pour le calcium mais sa concentration extra-cellulaire est beaucoup plus basse que celle du sodium. Ainsi, durant l'ouverture du canal ionique d'un récepteur jonctionnel, environ 103 ions sodium vont pénétrer dans la cellule . La durée d'ouverture du canal ionique est dépendante du type de récepteur et de l'agoniste. L'acétylcholine va quitter le récepteur en un temps beaucoup plus bref que sa durée d'ouverture moyenne (1 ms).
L'acétylcholine est libérée en continue et spontanément depuis les terminaisons nerveuses, en l'absence de toute stimulation. Ce phénomène entraîne de discrets changements du potentiel de repos de la plaque motrice . La libération spontanée d'un quantum d'ACh est responsable d'un MEPP (miniature end plate potential) ou potentiel de plaque miniature d'une amplitude de moins d'un millivolt et durant quelques millisecondes. Il est probable qu'un quantum représente le contenu d'une vésicule. Ces potentiels de plaque miniature surviennent de façon aléatoire à une fréquence variable et sont abolis par les curares. Le potentiel de plaque miniature est trop petit pour produire une contraction musculaire car il ne peut générer un potentiel de plaque atteignant le seuil nécessaire à l'apparition d'un potentiel d'action .
L'arrivée d'un potentiel d'action au niveau d'une terminaison nerveuse entraîne la libération simultanée de 40 à 200 vésicules (soit 1 à 1,5 106 molécules d'acétylcholine) provoquant l'ouverture simultanée de plusieurs milliers de pores . L'entrée massive d'ions sodium ainsi générée entraîne la dépolarisation de la plaque motrice appelée potentiel de plaque. Le potentiel de plaque n'est pas propagé mais décroît d'intensité avec la distance et le temps. Quand un potentiel de plaque atteint le potentiel seuil (-50 à -40 mV), il déclenche l'ouverture de canaux sodiques dépendants du potentiel et l'apparition d'un potentiel d'action . Ce potentiel d'action répond à la loi du « tout ou rien » et se propage à tout le sarcolemme car les canaux sodiques sont distribués tout au long de la fibre musculaire.
Lors de l'arrivée d'un potentiel d'action au niveau de la terminaison nerveuse, la quantité d'acétylcholine libérée est en excès par rapport à celle nécessaire pour générer un potentiel de plaque qui atteigne le seuil et permette l'apparition du potentiel d'action musculaire. En effet, la stimulation de seulement 6 % des récepteurs postsynaptiques à l'acétylcholine est suffisante pour déclencher un potentiel d'action. Ce phénomène permet d'expliquer le concept de marge de sécurité de la transmission neuromusculaire . Des stimulations répétitives de l'axone moteur entraînent des variations de l'amplitude du potentiel de plaque. En effet, la première stimulation provoque une diminution du nombre des quanta d'ACh immédiatement disponibles, de telle sorte qu'avec une fréquence des stimulations de l'ordre de 5 Hz on observe une diminution progressive de l'amplitude du potentiel de plaque entre la première et la cinquième stimulation. Grâce à la marge de sécurité, ce phénomène n'a pas de conséquence sur l'efficacité de la transmission neuromusculaire et de la contraction.
2.4.2.7 Du potentiel d'action à la contraction musculaire
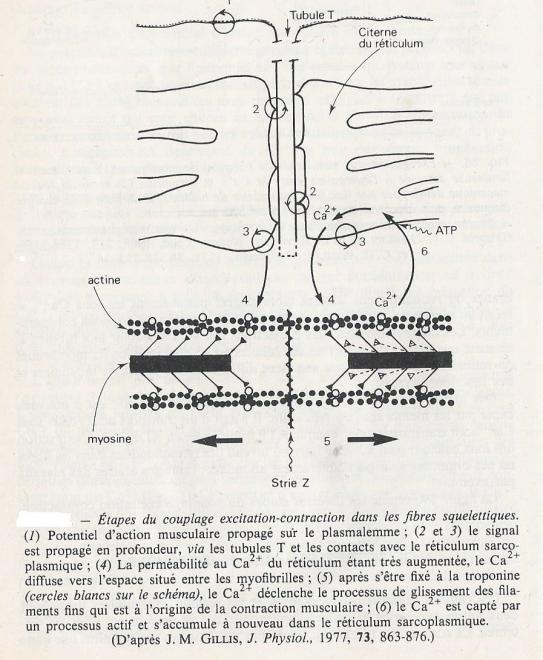
C'est le tubule transverse ( tubule T) qui assure le couplage excitation-contraction. Il correspond à l'association de la membrane plasmique et d'un domaine de la membrane du réticulum sarcoplasmique. Le réticulum sarcoplasmique est une structure liée à la membrane cellulaire musculaire dont le principal rôle est de servir de réservoir pour les ions calcium . Deux canaux calciques jouent un rôle. Le canal calcique dépendant du potentiel de la membrane plasmique musculaire, appelé récepteur aux dihydropyriridines, et le canal calcique dépendant du potentiel de la membrane du réticulum sarcoplasmique, appelé récepteur à la ryanodine. La diffusion du potentiel d'action est transmise au niveau des tubules transverses où l'ouverture de ces canaux calciques provoque la libération brutale du calcium du réticulum sarcoplasmique dans le cytoplasme. Ces canaux calciques sont dépendants du potentiel et spécifiques pour l'ion calcium. L'entrée de calcium dans la cellule est passive car le sarcoplasme présente une concentration de calcium beaucoup plus basse que celle du milieu extérieur et du réticulum sarcoplasmique. Le calcium se fixe à la troponine et induit un changement de conformation de cette molécule qui va supprimer l'inhibition de la liaison entre actine et myosine, permettant la contraction musculaire. Le retour à la relaxation musculaire nécessite la diminution de la concentration de calcium qui permet au complexe troponine-tropomyosine d'exercer de nouveau l'inhibition de la liaison actine-myosine. La captation du calcium par le réticulum sarcoplasmique est active et nécessite de l'énergie.
Les curares entraînent une baisse simultanée des phénomènes électriques et mécaniques, ils ne modifient pas le couplage excitation-contraction. À l'opposé, le dantrium, traitement spécifique de l'hyperthermie maligne, agit en aval du potentiel d'action musculaire qui n'est pas affecté. Le dantrium agit sur le couplage excitation-contraction en inhibant la libération de calcium du réticulum sarcoplasmique et l'interaction actine-myosine.
Date de dernière mise à jour : 05/07/2021
Ajouter un commentaire
