|
A l'état basal, l'intérieur des neurones présente un potentiel négatif, le potentiel de repos de la membrane. Il est mesurable au moyen de deux microélectrodes, l'une insérée dans le cytosol de la cellule, l'autre en dehors de la cellule. La face interne de la membrane du neurone est négative par rapport à l'extérieur. La différence de potentiel entre les deux faces de la membrane dépend du type de neurone; il est généralement d'environ -65 mV. Cette différence de potentiel électrique s'explique par les flux ioniques transmembranaires eux-mêmes liés à deux mécanismes:
La différence entre les concentrations d'un ion donné s'appelle le gradient de concentration. Un ion a spontanément tendance à se diriger selon un gradient de concentration c'est-à-dire des régions de plus forte concentration vers les régions de plus faible concentration pour cet ion: ce mouvement s'appelle la diffusion. Le phénomène de diffusion traduit l'existence de mouvements aléatoires de molécules qui traversent la membrane cellulaire soit en empruntant les pores membranaires soit, dans le cas des substances liposolubles, en traversant la matrice lipidique de la membrane.
Trois acteurs principaux interviennent dans la génèse du potentiel de repos: les milieux salés de part et d'autre de la membrane, la membrane elle-même, et les protéines transmembranaires .
1.1.6.2 Les acteurs du potentiel de membrane au repos
Les pompes ioniques Une consommation d'énergie est nécessaire pour déplacer des ions à l'encontre de leur gradient de concentration. La source d'énergie utilisée permet de classer les pompes en deux catégories:
NB: L'ATP (adénosine triphosphate) est le produit du métabolisme oxydatif dans la mitochondrie. L'ATP est un nucléotide composé d'une base nitrée (l'adénine), d'un pentose (le ribose) et de trois radicaux phosphate. Les deux derniers radicaux phosphate sont liés au 3e radical par des liaisons riches en énergie, extrêmement labiles, permettant une libération relativement aisée des radicaux phosphate en fonction des besoins énergétiques de la cellule. L'hydrolyse d'une molécule d'ATP correspond à la formation d'une molécule adénosine diphodphate et d'une molécule d'acide phosphorique s'accompagnant d'une libération d'énergie: hydrolyse d'ATP en ADP + Pi + énergie. C'est l'énergie provenant des substances nutritives cellulaires qui permet le renouvellement du stock d'ATP. 95% de l'ATP cellulaire est synthétisé dans la mitochondrie sous l'action de l'enzyme ATP synthétase. Cette enzyme utilise l'énergie fournie par les mouvements d'ions hydrogène pour convertir l'ATP en ADP. L'ATP joue un rôle fondamental dans trois principales catégories de fonctions cellulaires: 1) transport membranaire, 2) synthèse des composés chimiques, 3) travail mécanique (contraction musculaire). Figure. Pompes ioniques à ATPase : Pompe à Na+/K+ ATPase
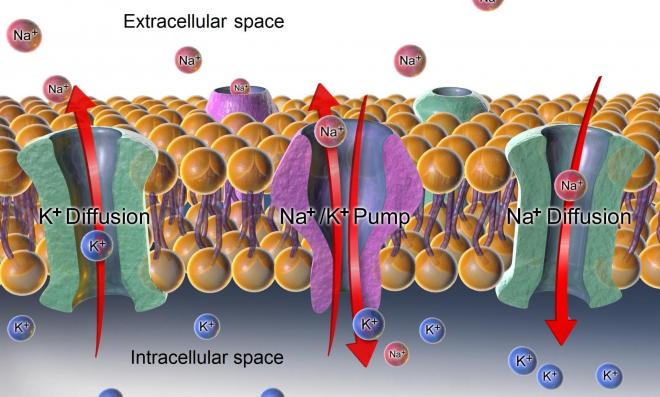   Ca2+/H+ ATPase.
Figure. Pompes échangeuses d’ions. 1.1.6.3 Les gradients de concentration ionique Les pompes ioniques sont à l'origine des gradients de concentration transmembranaires au repos que les canaux ioniques exploiteront ensuite pour produire le potentiel d'action. Le liquide extracellulaire contient d'importantes quantités de sodium et de faibles quantités de potassium; le liquide intracellulaire est caractérisé par une composition opposée. Les gradients de concentration ionique sont créés et maintenus par des protéines transmembranaires appelées pompes ioniques qui accumulent activement le potassium à l'intérieur de la cellule et rejettent du sodium à l'extérieur de la cellule, créant ainsi des différences de concentration ionique. Ce transport nécessite une dépense énergétique par hydrolyse de l'ATP. Le gradient de concentration intracellulaire en K+ est prépondérant dans la genèse du potentiel de repos (le gradient extracellulaire en Na+ joue un rôle moindre). Les concentrations intra et extracelluaires du sodium et du potassium sont approximativement
1.1.6.4 La perméabilité sélective des membranes La perméabilité sélective des membranes est principalement due aux canaux ioniques, protéines transmembranaires très diverses qui permettent à certains ions de franchir la membrane, par diffusion passive, selon leur gradient de concentration. Un canal ionique transmembranaire est typiquement un assemblage de 4 à 6 molécules protéiques semblables qui forment un pore ). La composition des sous-unités varie d'un canal à l'autre et détermine ses propriétés spécifiques . La sélectivité ionique est déterminée par le diamètre du canal central et la nature des groupement protéiques qui le tapissent, plus précisément par une région particulière dénommée boucle du port, située au niveau du pore lui même . On trouve ainsi des canaux potassiques, sélectivement perméables au K+, des canaux sodiques, perméables au Na+, des canaux calciques au Ca2+... La possibilité d'ouverture-fermeture ("gating") des canaux ioniques selon les modifications du micro-environnement local de la membrane est une propriété importante de la plupart de ces canaux . Si les pores des canaux ioniques s'ouvrent ou se ferment en réponse aux variations du potentiel de membrane, on parle de canaux voltage-dépendants. Figure. Exemple de canal ionique: le canal sodique.
1.1.6.5 Constitution du potentiel d'équilibre La constitution du potentiel de repos peut être envisagé schématiquement en quatre étapes à partir d'un modèle séquentiel simplifié.
NB: Etant donné que 3 ions Na+ sont pompées vers l'extérieur pour 2 ions K+ pompés vers l'intérieur, il apparaît un déficit net en charges positives à l'intérieur de la cellule, c'est-à-dire une négativité à l'intérieur de la cellule. Ce mécanisme, qui génère une différence de potentiel faible (de -4 mV) est insuffisant pour expliquer la totalité du potentiel de repos. Il contribue dans une faible proportion à l'apparition du potentiel de membrane au repos en s'ajoutant au principal mécanisme, la fuite de potassium.
Figure: pompe ionique transmembranaire Na/K ATPase
En conditions réelles, le potentiel de repos du neurone tient en fait à l'effet conjugué des déplacements des ions K+ et Na+.
Equation de Goldman-Hodgkin-Katz : L'équation de Goldman-Hodgkin-Katz est une généralisation de l'équation de Nernst pour le cas d'une membrane renfermant plusieurs types de conductances. Dans le cas d'une membrane séparant deux solutions renfermant un mélange NaCl + KCl et perméables à ces trois ions, on démontre que le potentiel de membrane Avec
Il est aisé de généraliser cette équation au cas où plus de trois espèces ioniques sont concernées. En pratique, on élimine les autres conductances soit en les inhibant à l'aide d'inhibiteurs spécifiques des canaux, soit en substituant l'ion perméant par un qui ne l'est pas.
|
- Accueil
- D.Sciences biologiques
- IV.Biologie animale ou zoologie
- 6.physiologie animale
- Physiologie animale 1
Physiologie animale 1
PHYSIOLOGIE ANIMALE
1. Physiologie cellulaire (Prérequis : biologie cellulaire)
1.1 LA MEMBRANE PLASMIQUE ET LES TRANSPORTS MEMBRANAIRES
1.1.1 Introduction
La membrane plasmique constitue une barrière séparant les compartiments intra et extracellulaires. La composition et les propriétés de cette barrière déterminent sa perméabilité à différentes substances. Les transports membranaires peuvent être considérés de deux points de vue.
Le point de vue thermodynamique prend en compte les forces qui déterminent la traversée de la membrane, on doit distinguer :
- Les tranports passifs qui s'effectuent spontanément en utilisant l'énergie résultant de la dissipation d'un gradient de potentiel chimique ( ou éventuellement életrochimique ) ;
- Les transports actifs qui utilisent une source d'énergie externe, généralement celle procurée par une réaction métabolique exergonique, pour transporter une substance et créer ou renforcer un gradient de potentiel chimique ( ou électrochimique ).
Les cellules étant des systèmes vivants fonctionnant à l'état stationnaire hors de l'équilibre thermodynamique, les transports actifs contrecarrent en permanence le retour à l'équilibre par les transports passifs.
Le point de vue mécanistique ( qui étudie le mécanisme ) et cinétique s'intéresse aux mécanismes sous-jacents au transport et à l'intensité des flux qui en résultent. Ce point de vue est différent du précédent en ce sens que le même état stationnaire peut être obtenu par des transports ayant des cinétiques bien différentes.
En termes de mécanismes, les transports membranaires font intervenir des interactions plus ou moins spécifiques avec les composants de la membrane , particulièrement les protéines . Ces interactions sont minimales dans le cas des transports passifs s'apparentant à la diffusion mais elles deviennent très importantes et spécifiques pour les transports facilités passifs et surtout pour les transports actifs.
Nous allons d'abord nous attacher à dégager les grands principes permettant de comprendre ces deux aspects des transports membranaires , en particulier en ce qui concerne les ions, particules chargées dont le transport fait intervenir des forces de nature à la fois chimique et électrique . Ces principes trouveront ensuite leur application dans quelques exemples ayant une importance centrale dans la physiologie de la cellule et de l'organisme.
1.1.2 Rappel concis/ structure et composition de la membrane plasmique
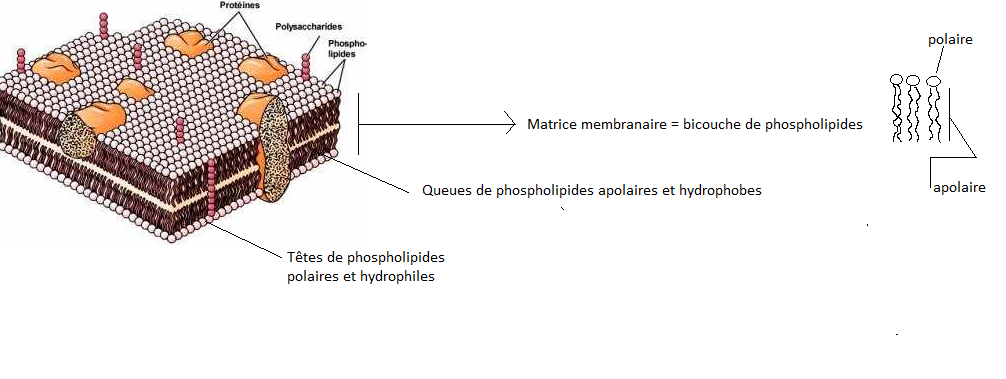
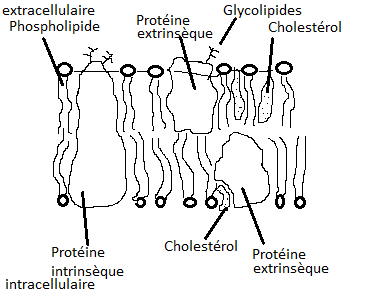
Composition simplifiée de la membrane :
1- Phospholipides
Les phospholipides sont des molécules amphiphiles comportant une tête phosphoryle estérifiée par divers composés ( Ethanolamine, Choline, Sérine ...), et fortement polaire et une "queue" hydrophobe constituée de deux chaînes d'acides gras. Ces molécules s'organisent spontanément un bicouche de 4-5 nm d'épaisseur dans les membranes.
Les têtes polaires hydrophyles se disposant vers les milieux aqueux extra et intra cellulaires, tandis que les queues hydrophobes se font face vers l'intérieur de la membrane, la bicouche contient aussi des molécules plus ou moins amphiphiles comme le cholestérol.
2- Protéines membranaires
Celles-ci sont enchâssée dans la bicouche, reposant à la surface externe ou interne ( protéines extrinsèques ) ou traversant complètement la membrane ( protéines intrinsèques ).Les protéines intrinsèques comportent en général un domaine intra-membranaire constitué d'une ou plusieurs hélices alpha formées d'acides aminés hydrophobes et de domaines extra et intra cellulaires.
La membrane plasmique est donc une mosaïque de plages hydrophiles et hydrophobes que différentes substances pourront traverser en fonction de leurs tailles et de leurs affinités physico-chimiques. De plus, cette mosaïque n'est pas figée mais fluide, modifiée sans cesse par des remaniements comportant en particulierun déplacement et un renouvellement, en particulier latéral, des molécules phospholipides et des protéines ( théorie de la mosaïque fluide ).
1.1.3 Perméabilité passive des membranes biologiques
1.1.3.1 Perméabilité membranaire à l'eau
Nous allons évoquer la perméabilité membranaire à l'eau en l'absence de gradient osmotique et en présence de celui-ci.
A. En l'absence de gradient osmotique
L'hématie de Mammifère placée dans une solution de NaCl à 9 gr . L -1 ne change pas de volume, indiquant qu'il n'y a pas de transfert net d'eau au transfert de la membrane ( flux net d'eau nul ). Une telle solution est dite isosmotique ( sa concentration osmotique, ou concentration totale en solutés osmotiquement actifs en osmoles par litres, ou encore sa concentration en eau en môle d' H2O par litres de solution, sont égales à celles du liquide intracellulaire ), et isotonique elle ne provoque pas de changement de volume de la cellule ). Cependant même si le flux d'eau net est nul , des molécules d'eau traversent la membrane. En effet, les cellules deviennent radioactives en présence d'un marqueur extracellulaire comme l'eau tritiée HTO. Cette entrée d'eau tritiée ( accompagnée d'eau H2O ) correspond à un flux unidirectionnel entrant , Je (H2O) en mol-1.m-2.s mesurable à partir du flux radioactif , qui est nécessairement compensé par l'existence d'un flux unidirectionnel sortant Js(H2O) de même amplitude :
Je = Js d'où Jnet = Je - Js = 0.
Les flux mis en évidence dans ces conditions expérimentales sont dits flux diffusionnels . En effet, ils obéissent aux lois de la diffusion simple et sont en particulier proportionnels à la concentration de la substance considérée ( içi H20 ) dans le comportement d'origine :
Je = Pd . Ce et Js = Pd . Ci
Ce etCi étant les concentrations extracellulaires ( Ce ) et intracellulaires (Ci ) de l'eau (en mol . m-3) . Le coefficient de proportionnalité Pd (en m . s-1 , soit les dimensions d'une vitesse ) est le coëfficient de perméabilité diffusionnelle .
Si Ce est différent de Ci ( conditions anisosmotique ), on voit que le flux net diffusionnel n'est pas nul :
Jnet (diff) = Je - Js = Pd(Ce-Ci)
Un flux net proportionnel à la différence de concentration caractérise une cinétique linéaire de diffusion simple . Ces notions ne s'appliquent pas seulement à l'eau mais évidemment aussi à bien d'autres substances.
B. En présence d'un gradient osmotique
Si la solution extracellulaire de NaCl a une concentration inférieure à 9 gr/L, l'hématie gonfle. Cette solution est dite hypoosmotique ou hypotonique . De même, une solution hyperosmotique ou hypertonique entraîne une réduction du volume cellulaire. Ces variations de volume traduisent des flux nets entrant et sortant d'eau, dits flux osmotiques, mesurables en termes de changement de volume ( m3 . s-1) et convertibles en flux molaires ( mol . s-1 ) en divisant par le volume molaire de l'eau ( v en m3 . mol-1 ). Les flux nets osmotiques sont proportionnels à la différence de pression osmotique ( pi = RTCsol , Csol étant la concentration totale en solutés osmotiquements actifs, T la température absolue en Kelvin K et R la constante d'état des gaz parfaits, 8,31 J-1.K-1.mol), entre les deux faces de la membrane :
Jnet ( osmo) ( en m3 . s-1) = k (pii- pie)
Jnet (osmo) ( en mol . s-1) = k(RT/v).(Ci(sol) - Ce(sol))
Le coëfficient k.RT/v = P0 ( en m.s-1 ) est dit coefficient de perméabilité osmotique .
Si les coefficient de perméabilité diffusionnelle et osmotique sont identiques dans les membranes purement phospholipidiques, il n'en est pas de même dans les systèmes membranaires ou épithéliaux réels , ou P0 est trouvé le plus souvent largement supérieur à Pd , ceci indique que les mécanismes sous-jacents à ces deux types de perméabilité à l'eau sont différents . On sait à présent que la perméabilité diffusionnelle résulte de l'agitation thermique des molécules d'eau qui traversent principalement la bicouche lipidique. La perméabilité osmotique s'explique principalement par un mouvement d'eau à travers de pores de la membrane sous l'influence de force osmotiques ( osmose ) ou hydrodynamique ( filtration ) . Ces pores spécifiquement perméables à l'eau ont été récemment identifiés à des protéines intrinsèques dénommées " canaux à eau " ou " aquaporines " .
1.1.3.2 Perméabilité aux solutés neutres
De nombreux solutés neutres ( non chargés électriquement ) peuvent traverser passivement les membranes en suivant leur gradient de concentration . Une large part de cette perméabilité correspond à une simple diffusion et correspond à une cinétique linéaire , le flux net transmembranaire étant proportionnel à la différence de concentration.
Jnet(sol) = P(sol) . ?C(sol)
P(sol) étant un coefficient de perméabilité en m.s-1
Pour les soluté non polaires , le coefficient de perméabilité est d'abord d'autant plus élevé que la masse molaire est faible. Comme pour le coefficient de diffusion en milieu homogène , le coefficient de perméabilité membranaire tend à diminuer de façon proportionnelle à l'inverse de la racine carrée de la masse molaire M ( Loi de Graham ):
P(sol)~ k.1/M1/2
Cette relation n'est cependant que très approximative car la perméabilité membranaire aux solutés neutres est aussi très dépendante du caractère plus ou moins liposoluble de la molécule. Ainsi la perméabilité corrigée des effets de masse molaire ( k = P(sol).M1/2) est elle souvent liée directement au coefficient de partage ( huile/eau) ou (octanol/eau) de la substance . Ceci indique que l'accès à la phase lipidique de la membrane est déterminant pour la perméabilité des solutés neutres au travers des membranes biologiques.
1.1.3.3 La perméabilité passive aux électrolytes
Les bicouches phospholipidiques sont très peu perméables aux molécules électriquement chargées, en particulier aux ions organiques, comme l'indique une résistance électrique élevée ( environ 108 Ohms.cm2 contre 103Ohms.cm2 pour les membranes plasmiques biologiques). Les ions inorganiques traversent passivement les membranes biologiques essentiellement au niveau des protéines intrinsèques spécialisées, ouvrant des pores au travers de la membrane et dénommées canaux ioniques. Ces canaux ioniques sont extrêmement divers et spécialisés , assurant le passage spécifique de certains ions tout en étant très peu perméables pour d'autres. L'assortiment de canaux ioniques présents dans la membrane détermine sa perméabilité qui est souvent très sélective, c'est à dire plus marquée pour certains ions que pour d'autres . La sélectivité ionique des membranes plasmiques est à la base de nombreux phénomènes électriques membranaires.
Le passage passif des ions au travers des membranes est assimilable à une électrodiffusion en ce sens que les forces qui le déterminent résultent non seulement de différences de concentration ( ou différence de potentiel chimique ) , mais aussi du champs électrique transmembranaire, si la membrane est électriquement polarisée ( différence de potentiel ou ddp électrique delta E). Dans ce cas les flux unidirectionnels sont une fonction directe du potentiel électrochimique u de l'ion considéré dans le compartiment d'origine :
![]()
où z est la valence de l'ion considéré avec son signe , F le Faraday ( charge électrique en coulombs d'une môle de charges élémentaires soit 96500Cb.mol-1) et E le potentiel électrique en volts.
Le flux net dépend alors de la différence électrochimique ![]() exprimée en joules . mol-1 d'énergie utilisable pour le transport :
exprimée en joules . mol-1 d'énergie utilisable pour le transport :
![]()
où les indices 1 et 2 correspondent aux deux compartiments séparés par la membrane , R est la constante d'état des gaz parfaits ( 8,41.K-1.mol-1)et T la température en K ; le terme RTln(C1/C2) représente la différence d'énergie potentielle chimique liée à à la différence des concentrations C1 et C2 et le terme zF(E1-E2) = zFEm la différence d'énergie liée à la ddp électrique transmembranaire ![]() . Il faut noter qu'un flux ionique correspond à un transport de charge et donc à un courant électrique . Les courants transmembranaires sont portés par des ions et non par des électrons comme dans les conducteurs métalliques . Un flux de une môle de charges par seconde et par mètre carré correspond à 96500Cb.m-2.s-1
. Il faut noter qu'un flux ionique correspond à un transport de charge et donc à un courant électrique . Les courants transmembranaires sont portés par des ions et non par des électrons comme dans les conducteurs métalliques . Un flux de une môle de charges par seconde et par mètre carré correspond à 96500Cb.m-2.s-1
ou 96500A.m-2
1.1.4 Les transports facilités passifs
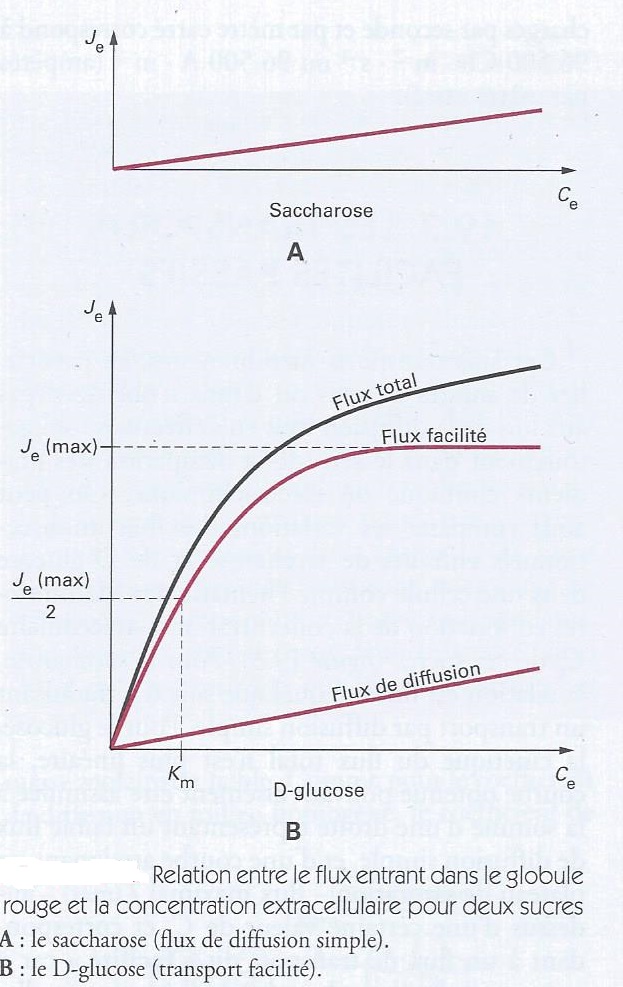
Certains transports membranaires, en particulier de solutés neutres ou d'ions n'obéissent pas aux lois de la diffusion tout en s'effectuant obligatoirement dans le sens de la dissipation des gradients chimique ou électrochimique. On peut ainsi comparer les variations des flux unidirectionnels entrants de saccharose et de D-Glucose dans une cellule comme l'hématie des Mammifères en fonction de la concentration extracellulaire Ce de sucres. Pour le saccharose , la relation est linéaire quel que soit Ce, traduisant un transport par diffusion simple. Pour le glucose la cinétique du flux total n'est plus linéaire , la courbe obtenue pouvant être aisément assimilée à la somme d'une droite représentant un faible flux de diffusion simple et d'une courbe atteignant un plateau de saturation - flux maximal Je(max) - au dessus d'une certaine valeur de Ce et correspondant à un flux de transport dit " facilité" car il peut atteindre des valeurs très supérieures à celle du flux de diffusion simple. La cinétique de saturation traduit l'existence d'un transporteur membranaire capable de lier le glucose sur la face externe de la membrane puis de le transférer sur la face interne à la faveur d'une modification conformationnelle ( translocation ) , la dissociation du complexe gluco-transporteur permettant alors de libérer le sucre dans l'espace intra-cellulaire. Les facteurs limitants de ces processus sont d'une part le transporteur , et donc de sites de transport disponibles , par unité de surface de membrane. D'autre part, les vitesses de combinaison, de translocation et de dissociation du complexe. Lorsque Ce est suffisamment élevé, tous les sites de liaison deviennent occupés (saturation) et le flux ne peut plus augmenter. Les protéines membranaires assurant le transport facilité du D-glucose appartiennent à une famille de transporteur GLUT ( pour GLUcose transporteur ) .
comportant de nombreuses isoformes connues, ayant des propriétés particulières et réparties de façon spécifique dans divers tissus.
Les changements de conformation nécessaires aux transports facilités requièrent de l'énergie qui est simplement fournie par la dissipation du gradient de concentration ( transport passif) sans apport métabolique externe . La liaison transporteur/molécule transportée est analogue à la liaison enzyme/substrat et les transports facilités passifs obéissent en général aux lois de la cinétique enzymatique . En particulier , la cinétique de saturation suit la relation de Michaelis -Menten :
Je =( Jmax . Ce )/(Km + Ce ).
où Jmax est le flux facilité maximum à saturation et Km la concentration pour laquelle le flux est égal à la moitié du flux maximal. Km caractérise l'affinité du transporteur pour le substance transportée ( figure ci-dessus). En effet, plus Km est faible , plus la liaison est aisée et plus la facilitation est importante à faible concentration de substrat transporté. Comme les réactions enzymatiques, les transports facilités présentent souvent un haut degré de spécificité . Ainsi, le transporteur GLUT1 de l'hématie, facilité le transport du D-Glucose , mais pas celui du L-Glucose. Ils peuvent aussi être inhibés de façon compétitive ou non compétitive ( voir biochimie ).
1.1.5 Les transports actifs
Par définition, les transports actifs s'effectuent contre les gradients de concentration ( ou contre le gradient électrochimique pour les électrolytes ). De ce fait, ils nécessitent une source externe d'énergie . Autrement dit, alors qu'un transport passif dissipe l'énergie d'un gradient électrochimique, un transport actif utilise une source d'énergie externe pour la transformer en gradient électrochimique . Les transports actifs font nécessairement intervenir un transporteur membranaire et, en conséquence, les flux actifs font toujours intervenir une cinétique de saturation.
Selon la nature de la source d'énergie et le mode de couplage entre cette source et le transport , on distingue deux types de transports actifs : les primaires et les secondaires .
1.1.5.1 Les transports actifs primaires
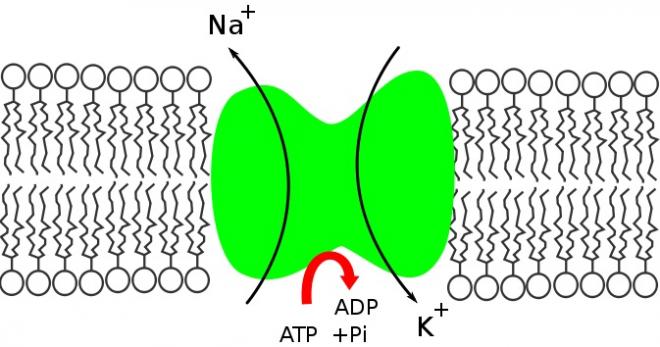
La source d'énergie, dans ce cas, est métabolique, résultant presque toujours de l'hydrolyse de l'ATP pour les transports actifs primaires localisés à la membrane plasmique. Le couplage est direct puisque la protéine membranaire concernée est à la fois le transporteur et l'enzyme ATPase responsable de l'hydrolyse de l'ATP.
Toutes les cellules animales contiennent une concentration intracellulaire élevée de K+ alors que celle de Na+ est au contraire beaucoup plus faible que celle du milieu extracellulaire . Ceci résulte de l'activité de la pompe Na+/K+ qui est le prototype des transports actifs primaires et qui assure un rejet de Na+ hors de la cellule en même temps qu'une absorption de K+ . En raison de la faible concentration intracellulaire de Na+ et de la faible perméabilité de la membrane à cet ion , le flux unidirectionnel sortant passif de Na+ : (Js (Na+)=PNa . Ci(Na+)) , est négligeable et le flux sortant total est donc pour l'essentiel un flux actif résultant de l'activité de la pompe. La mesure de ce flux sortant permet de mettre en évidence les principales caractéristiques des transports actifs cellulaires de Na+ et de K+ :
- Le flux sortant actif de Na+ est immédiatement inhibé par suppression de K+ extracellulaire, démontrant ainsi le couplage étroit entre la sortie de Na+ et l'entrée de K+ au niveau d'un transporteur commun .
- Le flux sortant actif de Na+ est inhibé en présence de substances telles que le cyanure ou le dinitrophénol qui inhibent la production mitochondriale d'ATP dans la cellule. Cette source d'énergie est cependant très spécifique puisque d'autres nucléotides-phosphates tels que le GTP ou l'ITP n'ont pas d'action. De plus l'ATP n'est actif que s'il est admninistré du côté interne de la membrane ;
- Le flux actif est une fonction saturable de [Na+ ] intracellulaire, de [K+] extracellulaire et de [ATP] intracellulaire, indiquant que le cycle de fonctionnement comporte une liaison de ces substrats au transporteur ;
- Le flux actif de Na+ aussi bien que l'activité ATPasique dépendant de Na+ et de K+ sont bloqués par des inhibiteurs spécifiques comme l'ouabaïne, glycoside extrait de la digitale , qui agit par inhibition non compétitive en se liant au transporteur en un site localisé sur la face extracellulaire. Ceci souligne l'association au sein d'un même complexe protéique membranaire de la fonction de transport actif et de l'activité enzymatique qui fournit l'énergie nécessaire. Pour l'hydrolyse de une môle d'ATP, 3 môles de Na+ et 2 môles de K+ sont transportées de sorte que la pompe est électrogénique , générant un courant transmembranaire sortant.
D'autres exemples de transports actifs primaires couplés à l'hydrolyse de l'ATP sont donnés par les pompes à (Ca2+ ATPases) et à protons ( H+ ATPases, H+/K+ ATPase).
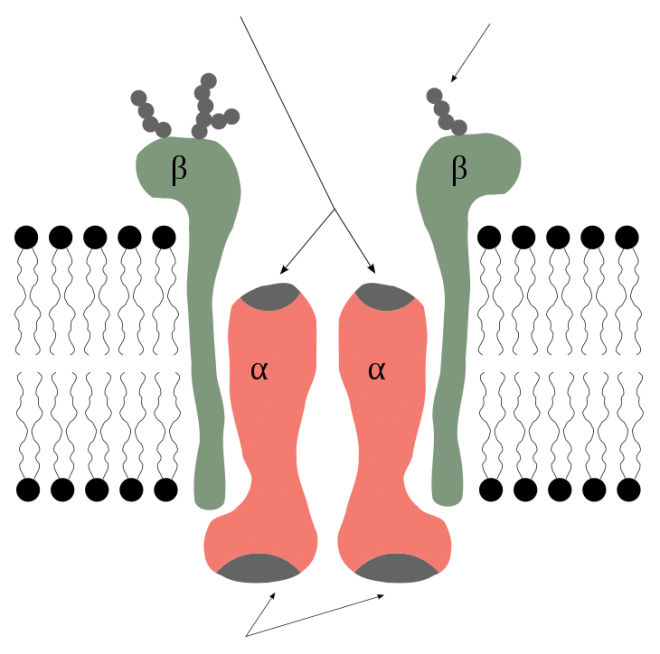
La pompe sodium est composée de plusieurs sous-unités :
la sous-unité  est la sous-unité catalytique. Elle a 10 segments transmembranaires (M1-M10). On en connaît quatre isoformes avec un poids moléculaire réparti de 110 à 113 kDa.
est la sous-unité catalytique. Elle a 10 segments transmembranaires (M1-M10). On en connaît quatre isoformes avec un poids moléculaire réparti de 110 à 113 kDa.
la sous-unité 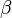 aurait plus un rôle d'auxiliaire, pour l'adressage de l'oligomère, la stabilisation de la structure du complexe protéique et participerait à l'hydrolyse de l'ATP. Elle est aussi impliquée dans la liaison de la ouabaïne, l'inhibiteur de la pompe sodium. Elle a un segment transmembranaire, et un poids moléculaire d'environ 60 kDa.
aurait plus un rôle d'auxiliaire, pour l'adressage de l'oligomère, la stabilisation de la structure du complexe protéique et participerait à l'hydrolyse de l'ATP. Elle est aussi impliquée dans la liaison de la ouabaïne, l'inhibiteur de la pompe sodium. Elle a un segment transmembranaire, et un poids moléculaire d'environ 60 kDa.
la sous-unité 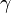 n'est pas essentielle à l'activité de la pompe sodium. Elle n'est pas exprimée dans tous les types cellulaires. Son expression dans des cellules HEK modifie l'affinité de la pompe à l'ATP, et sa présence dans le néphron modifie l'affinité avec les ions sodium et potassium. Il est permis de penser que d'autres sous-unités modifient les propriétés biophysiques de la pompe de la même manière.
n'est pas essentielle à l'activité de la pompe sodium. Elle n'est pas exprimée dans tous les types cellulaires. Son expression dans des cellules HEK modifie l'affinité de la pompe à l'ATP, et sa présence dans le néphron modifie l'affinité avec les ions sodium et potassium. Il est permis de penser que d'autres sous-unités modifient les propriétés biophysiques de la pompe de la même manière.
Fonctionnement de la pompe :

Cycle de la pompe sodium-potassium. L'ion sodium est figuré en pourpre, l'ion potassium en bleu turquoise. l'ATP est figuré par un hexagone ; le groupement H3PO4 par un carré. L'extérieur de la cellule est vers le haut. Ce schéma réactionnel est quelque peu dépassé depuis la démonstration d'un nouveau modèle de fonctionnement s'inspirant du modèle des canaux ionique : la pompe étant alors décrite comme un canal ionique à doubles portes couplées
- Dans l'état E1, la pompe a une forte affinité avec l'ATP (Kd = 0,1 à 0,2 µM) et avec Na+ (Kd = 0,19 à 0,26 mM).
- La pompe peut alors être phosphorylée par le phosphate
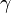 de l'ATP. Trois ions Na+ sont enfermés.
de l'ATP. Trois ions Na+ sont enfermés. - La pompe passe de l'état E1 à l'état E2. Elle perd sa forte affinité pour le sodium (K1/2 = 14 mM) et acquiert une forte affinité pour le potassium (Kd
 0,1 mM). Les trois ions Na+ sont relargués dans le milieu extracellulaire,
0,1 mM). Les trois ions Na+ sont relargués dans le milieu extracellulaire, - et 2 ions K+ s'associent à la pompe.
- La liaison du potassium provoque une déphosphorylation spontanée de la pompe qui enferme 2 ions K+.
- L'ATP intracellulaire facilite le relargage des ions K+, ce qui provoque un passage de l'état E2 à l'état E1. Alors que l'affinité de l'ATP avec la pompe à l'état E2 était très faible (K1/2 = 0,45 mM), elle redevient importante à l'état E1. Le cycle peut recommencer.
- Il ne faut pas oublier qu'il s'agit à chaque fois d'équilibre chimique. C'est la juxtaposition de tous ces états parmi une grande population de canaux qui aboutit à un flux net d'ions Na+ vers l'extérieur et d'ions K+ vers l'intérieur.
1.1.5.2 Les transports actifs secondaires
Dans ce cas, l'énergie nécessaire au transport actif d'une substance provient de la dissipation du gradient chimique ( ou électrochimique ) d'une autre substance dont le mouvement passif est couplé au transport actif. Le couplage s'effectue au niveau d'une protéine membranaire jouant le rôle de transporteur pour les deux composés qui peuvent être déplacés soit dans le même sens ( co-transport ou symport ) soit en sens inverse ( échange ou antiport ) .
Un exemple de ce type de transport est le co-transport sodium/glucose effectué par une famille de protéines dites SGLT ( pour Sodium dependent Glucose Transporters ) et assurant l'absorption intestinale du D-Glucose ainsi que sa réarbsorption au niveau du néphron proximal. Ce transporteur permet le couplage entre l'entrée simultanée d'un ion Na+ ( passive selon le gradient électrochimique ) et d'une molécule de glucose , qui est ainsi concentré activement dans la cellule et ressort passivement à l'autre pôle de la cellule par un transport facilité. La pompe Na+/K+ est bien sûr nécessaire pour maintenir le gradient électrochimique du Na+ et le couplage des transports actifs secondaires avec les sources d'énergie métabolique n'est donc qu'indirect. Le co-transport Na+/glucose se traduit par une entrée nette de charges électriques positives et est donc de ce fait électrogène . Ceci veut dire à la fois qu'il peut influencer la ddp électrique et être influencé par celle-ci .
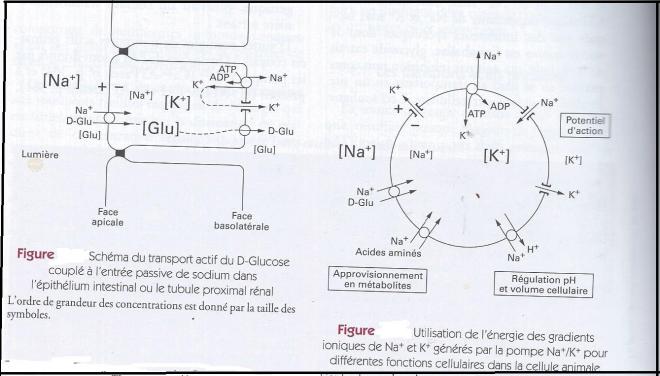
Du point de vue fonctionnel , les transporteurs actifs primaires et secondaires correspondent à un mode très important d'utilisation de l'énergie de l'énergie produite par la cellule. Les ATPases membranaires et en particulier la pompe Na+/K+ transforment une partie de l'énergie métabolique cellulaire en gradients de concentrations ioniques . Cette nouvelle forme d'énergie est en fait une réserve qui peut être utilisée par les transports actifs secondaires qui assurent au moins trois ensembles de fonctions cellulaires : des fonctions d'approvisionnement en métabolites ( glucose, acides aminés,...) des fonctions d'homéostasie du milieu cellulaire ( régulation du pH, du volume, du Calcium, ... ect intracellulaires) , des fonctions de génération de signaux cellulaires : potentiel d'action et potentiels synaptiques ( voir figure ci-dessus).
1.1.6 Conséquences électriques membranaires de la perméabilité passive à des solutés ioniques
1.1.6.1. Potentiels de membrane de repos
1.1.7 Transports par exocytose et endocytose
1.1.7.1 Mécanisme général
Les transports par endocytose et exocytose sont intermittents . Ils font intervenir un transit de substances ( solutés et solides ) dans des vésicules membranairescloses, formées soit par invagination de la membrane plasmique, soit à la suite d'un bourgeonnement des membranes du réticulum endoplasmique ou de l'appareil de Golgy.
Les deux mécanismes sont fondamentalement identiques; ils diffèrent par le sens dans lequel s'effectue le mouvement . Les vésicules closes isolent une partie du milieu qui peut être considéré comme un territoire extracellulaire , par analogie avec le milieu extérieur que représente la lumière du tube digestif pour un organisme. Les mécanismes qui permettent les échanges entre le contenu des vésicules et le cytoplasme sont comparables à ceux qui sont connus pour la membrane plasmique ( diffusion, diffusion facilitée, transports actifs ).
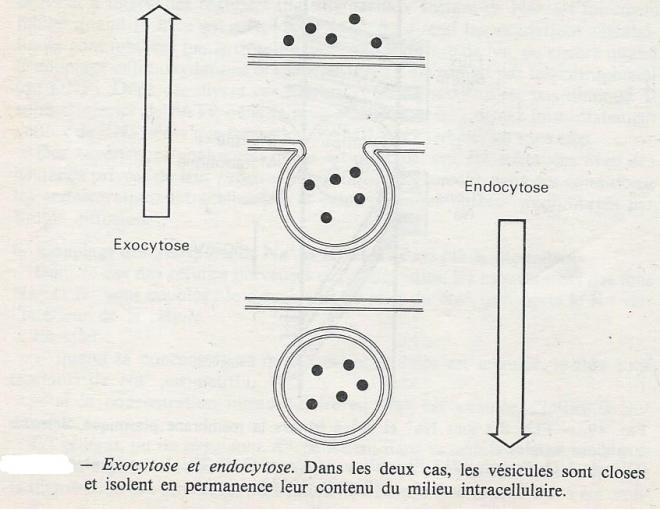
Endocytose et exocytose concernent des molécules ou des particules dont la nature ou la dimensionne permettent pas la traversée de la membrane plasmique par d'autres mécanismes . Ce sont des mécanismes actifs au sens donné plus haut : ils consomment de l'énergie , ce qui leur permet de mettre en oeuvre parfois des mouvements de grande amplitude ( phagocytose). Lors de la phagocytose de bactéries pat les leucocytes , le métabolisme de ceux-ci augmente considérablement : on enregistre une augmentation de la consommation d'oxygène , de la captation de glucose, de la dégradation du glycogène intracellulaire,en même temps que la synthèse de phospholipides membranaires est stimulée.
1.1.7.2 L'endocytose
L'endocytose est un terme qui regroupe tous les processus permettant à la cellule d'intégrer une partie de la périphérie cellulaire, avec son contenu. Son importance quantitative peut être considérable : des fibroblastes ( cellules du tissus conjonctif ) de souris, en culture , internalisent l'équivalent de 50% de leur surface membranaire par heure. Selon l'importance du phénomène , on distingue la pinocytose et la phagocytose , qui ne sont que les formes extrêmes de la série.
a. Pinocytose
De petits volumes de milieu extracellulaire sont capturés par des invaginations de la membrane plasmique , puis des pincements localisés de celle-ci entraînent la formation de petites vésicules d'un diamètre inférieur en général à 1 nm . La formation des vésicules fait intervenir un glissement des microfilaments du cytosquelette , étape consommatrice d'énergie. L'étape initiale comporte souvent sinon toujours , une fixation des substances qui déclenchent le processus, à des sites particuliers de la membrane plasmique.
b. Dans le cas d'endocytose spécifique, la phase de reconnaissance , la phase de reconnaissance du substrat susceptible d'être internalisé , fait intervenir des récepteurs spécifiques . Ce mécanisme a été bien décrit pour un certain nombre de protéines, ou de peptides dont le rôle dans la croissance , la nutrition ou la différenciation des cellules animales est important : insuline, facteur de croissance de l'épiderme ( EFG) , immunoglobulines maternelles, lipoprotéines de faible densité ( LDL ), hormone chorionique humaine ( HCG ) , transcobalamine II ( transport de vitamine B12), etc.
Date de dernière mise à jour : 02/09/2018
Ajouter un commentaire





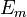 a pour valeur :
a pour valeur :![E_m = \frac{RT}{F} \ln{ \left( \frac{ P_{Na^{+}}[Na^{+}]_{ext} + P_{K^{+}}[K^{+}]_{ext} + P_{Cl^{-}}[Cl^{-}]_{int} }{ P_{Na^{+}}[Na^{+}]_{int} + P_{K^{+}}[K^{+}]_{int} + P_{Cl^{-}}[Cl^{-}]_{ext} } \right) }](https://upload.wikimedia.org/math/c/5/5/c5511bcbfd050a36a019193112fbe3bb.png)



