- Accueil
- D.Sciences biologiques
- IV.Biologie animale ou zoologie
- 5.anatomie comparée des Vertébrés
- Rappel - Embryologie
Rappel - Embryologie
LE DEVELOPPEMENT DES VERTEBRES
Les Vertébrés se développent uniquement par reproduction sexuée.
Remarque : Une trentaine d'espèces de Lézards d'Amérique du Nord et d'Arménie ( sur environ 3000) et une espèce de serpent, semblent se reproduire normalement par parthénogenèse.
La reproduction asexuée qui joue un rôle si iomportant chez certains Invertébrés ( Coelentérés, Bryozoaires, Tuniciers ) y est totalement inconnue .
Le développement de l'oeuf fécondé se fait dans l'eau chez les Vertébrés ovipares à fécondation externe : Cyclostomes, Amphibiens, la plupart des Poissons. Il commence dans les voies génitales femelles chez les ovipares à fécondation interne et s'achève dans l'eau ( Chondrichtyens ) ou dans l'air ( Reptiles, oiseaux, Mammifères monotrèmes ).
Chez les Vertébrés vivipares , obligatoirement à fécondation interne , l'oeuf se développe en totalité dans les voies génitales femelles : Mammifères Marsupiaux et Euthériens, divers Sélaciens, Téléostéens, Amphibiens et Reptiles.
I. LES OEUFS DES VERTEBRES
A. Charge en vitellus
Les oeufs des Vertébrés se répartissent en 3 catégories selon leur richesse en Vitellus.
On désigne sous le nom de vitellus ou lécithe, les substances organiques de réserve accumulées dans l'ovule au cours de sa genèse . De nature glucidique , lipidique ou protidique elles sont utilisées par l'embryon au cours de son développement . Chez les espèces ovipares ( et chez quelques espèces vivipares où l'embryon ne reçoit aucun apport nutritif d'origine maternelle ), le vitellus représente l'unique source énergétique avant le début de l'alimentation.
1° Oeufs hétérolécithes
Le vitellus est abondant et dispersé dans le cytoplasme sous forme de plaquettes ou de gouttelettes. Sa répartition est hétérogène ( d'où le nom ) avec cependant une accumulation plus importante au pôle inférieur de l'oeuf en équilibre appelé pour cette raison pôle vitellin ou végétatif. Le noyau est excentré vers le pôle supérieur ou pôle animal . Cette disposition du vitellus traduit nettement la polarité de l'oeuf. De tels oeufs sont caractéristiques des Amphibiens ( fig 1 , A) où leur diamètre est de 1 à 2 mm. Les Lamproies (les Cyclostomes) et tous les "Ostéichtyens" primitifs ( Chondrostéens, Holostéens, Brachioptérygiens, Dipneustes ) ont également des oeufs hétérolécithes dont le diamètre peut atteindre 7 mm
2° Oeufs télolécithes
Le vitellus est particulièrement abondant et se sépare du cytoplasme, celui-ci est reporté au pôle animal avec le noyau, où il constitue un disque aplati, le disque germinatif ( fig 1 B et C). Ces oeufs atteignent des tailles gigantesques ( jusqu'à 90mm de diamètre ) du fait de leur richesse en vitellus. Ils sont caractéristiques des sauropsidés ( reptiles et oiseaux ) et des Mammifères monotrèmes ainsi que des Myxines ( Cyclostomes ) des Chondrichtyens, des Téléostéens et du Coelacanthe.
3° Oeufs alécithes
Ce type d'oeuf dépourvu de vitellus ( ou très pauvre en vitellus extrudé dès les premières divisions de segmentation : Marsupiaux, Cheval ) caractérise les Mammifères vivipares : Marsupiaux et Euthériens. Il conrrespond très certainement à une perte secondaire de vitellus qui serait faite au cours de l'évolution de ces Mammifères à partir d'ancêtres reptiliens à oeufs télolécithes . Ces oeufs sont de très petite taille.
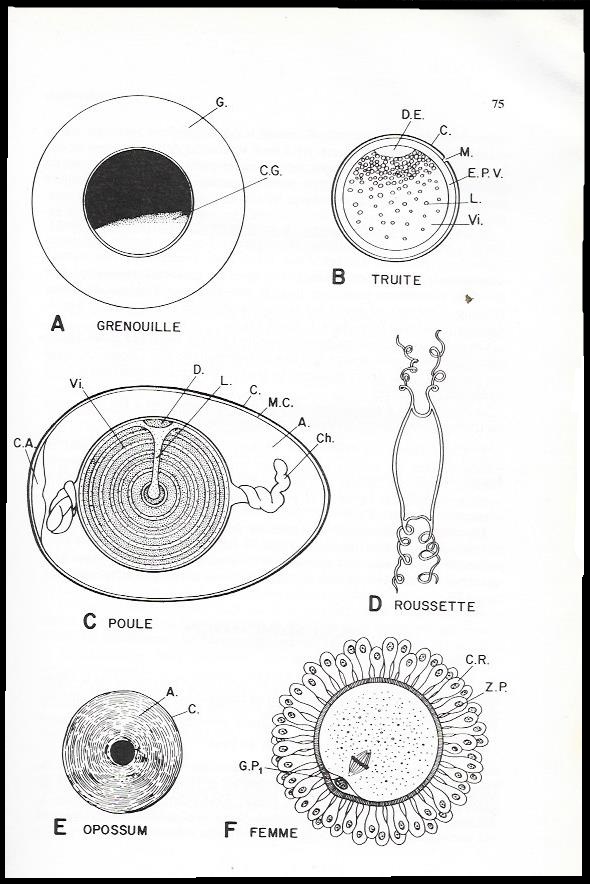
Planche I.1 : dans cette planche nous voyons : oeufs de Vertébrés
A : Oeuf hétérolécithe fécondé de Grenouille entouré d'une gangue mucopolysaccharidique ( G.). L'hémisphère animal est pigmenté en noir par des grains de mélanine . Le croissant gris ( C.G.) marque le plan de symétrie de l'oeuf.
B : Oeuf télolécithe fécondé de truite. Le cytoplasme est concentré dans le disque embryonnaire en entraînant les gouttelettes huileuses ( L.) qui s'accumulent à son voisinage . La coque ( C.) est percée d'un micropyle ( M.). E.P.V. : espace périvitellin ; Vi : vitellus.
C. Oeuf télolécithe fécondé de Poule ( d'après Witschi ) : A. : albumine ; C. : Coquille ; C.A : chambre à air ; Ch : chalaze ; D. : disque germinatif ; L : latebra ; M.C : membranes coquillères ; Vi. vitellus disposé en couches concentriques alternativement jaunes ( pointillés denses) et blanches ( pointillés lâches ).
D : Oeuf télolécithe de Roussette entouré de sa coque dont les angles se prolongent en vrilles.
E : Oeuf de Marsupial ( Opposum ) ( d'après McCrady ) entouré d'une couche d'albumine ( A. ) et d'une membrane coquillère ( C.).
F : Ovule de femme au moment de la ponte ( d'après Dollander ). L'ovule d'un diamètre de 250 µ est pondu entouré de la zone pellucide ( Z.P.) et de cellules folliculeuses de la corona radiata ( C.r.). Il vient d'expulser son premier globule polaire ( G.P1) et il est en métaphase de deuxième division de maturation.
B. Structures accessoires
L'oeuf des Vertébrés se développe généralement après s'être entouré de sécrétions du tractus génital femellez, à rôle protecteur et nourricier.
1° Chez les Vertébrés ovipares à fécondation externe ( Cyclostomes, Amphibiens, la plupart des ostéichtyens ) des structures à rôle protecteur sont disposées autour de l'oeuf vierge pendant son cheminement dans le tractus génital . L'oeuf hétérolécithe des Amphibiens s'entoure d'une gangue mucopolysaccharidique qui s'imbibe d'eau dès la ponte, gonfle et prend un aspect gélatineux ( Planche 1 fig A ). L'oeuf télolécithe des téléostéens et des Myxines s'entoure d'une coque rendue rigide par tannage quinonique de protéines. Un orifice ou micropyle permet le passage des spermatozoïdes lors de la fécondation ( Planche 1 fig B ).
2° Chez les Vertébrés ovipares à fécondation interne ( Chondrichtyens, reptiles, Oiseaux, Mammifères Monotrèmes ) l'oeuf télolécithe , s'entoure d'abord de plusieurs couches d'une solution de protéines , à rôle nutritif constituant le blanc de l'oeuf ( Planche 1 fig C). Puis l'ensemble est enfermé dans des membranes protéiques dont la plus externe s'entoure de calcite ( reptiles, Oiseaux) ou durcit par tannage quinonique plutôt que par kératinisation ( sélaciens ) (Planche 1 figure D). Ces structures accessoires proviennent de l'activité sécrétoire d'une région spécialisée du tractus génital femelle ( glande nidamentaire des chondrichtyens par exemple) ou de divers segments du tractus déposant successivement leurs sécrétions ( Amniotes ).
La fécondation a nécessairement lieu dans la partie tout à fait antérieure du tractus génital avant le dépôt de ces structures accessoires.
3° L'oeuf vierge des Mammifères vivipares ( Marsupiaux, Euthériens ), est pondu entouré de cellules folliculeuses ovariennes constituant la corona radiata. Entre ces cellules et l'ovule s'interpose une membrane pellucide, anhiste, sécrétée par l'ovocyte et peut être aussi par les cellules folliculeuses ( planche 1 figure F ). Les cellules folliculeuses se dissocient rapidement après la fécondation et l'oeuf s'entoure chez beaucoup d'espèces ( Marsupiaux , rongeurs ...) d'une sécrétion albumineuse de l'oviducte , plus ou moins épaissie, qui rappelle le blanc de l'oeuf des Reptiles mais ne semble pas avoir de rôle nutritif ( Planche 1 fig E ).
II. LA SEGMENTATION
A. Définition
La segmentation consiste en une série de divisions successives de la cellule oeuf ( sans changement de volume total ) en cellules filles de plus en plus petites , les blastomères, qui restent coalescentes.
B. Segmentation et charge en vitellus de l'oeuf
La segmentation est grandement influencée par la charge en vitellus de l'oeuf. Les oeufs alécithes et hétérolécithes où le vitellus n'est pas séparé du cytoplasme ont une segmentation totale , c'est à dire intéressant toute la cellule-oeuf. Au contraire , les oeufs télolécithes à vitellus séparé du cytoplasme ont une segmentation partielle qui laisse le vitellus indivis.
La segmentation est dite égale quand les blastomères sont sensiblement de même taille . C'est le cas des oeufs alécithes et télolécithes où , pour des raisons différentes , les blastomères sont dépourvus de vitellus . Dans les oeufs hétérolécithes , les blastomères sont plus ou moins chargés de vitellus selon leur position dans le germe . Le vitellus ralentit les mitoses et les blastomères se divisent d'autant moins rapidement qu'ils sont plus riches en vitellus . La segmentation est alors inégale et les blastomères du pôle végétatif ou macromères sont toujours plus gros que ceux du pôle animal ou micromères.
C. Segmentation totale des oeufs hétérolécithes . Exemple de l'oeuf de Grenouille rousse ( Planche 2 figures A à F )
La segmentation de l'oeuf de Grenouille rousse débute environ 2 heures et demie après la fécondation à 15-17 °. D'abord égale jusqu'au stade IV , elle devient inégale dès le stade VIII. Dès ce moment , les macromères du pôle végétatif se divisent plus lentement que les micromères du pôle animal, et la segmentation perd son synchronisme initial. Une cavité , la cavité de segmentation ou blastocoele , apparaît alors par écartement des blastomères. Du fait de leur différence de taille , elle est excentrée vers le pôle animal. La segmentation dure environ 24 heures ( à 15-17°). Elle aboutit à une blastula creuse faite de plusieurs milliers de blastomères.
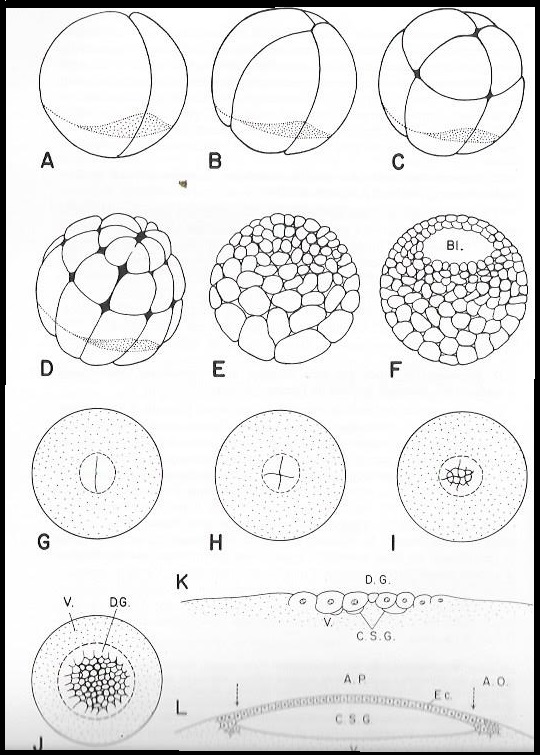
Planche II. 2: Segmentations .
A-F : Segmentation totale de l'oeuf hétérolécithe de Grenouille ( schématique d'après Huettner)
A. : Stade II. B : Stade IV. C : Stade VIII. D.: Stade XXIV.
E. : Morula
F. : Blastula
G-L : Segmentation partielle discoïdale de l'oeuf télolécithe de Poule
G.J : Disque germinatif en vue polaire
K.L : Coupes sagittales de blastula jeune (K), et agée ( L) montrant la formation de la cavité sous germinale (C.G.S) entre les blastomères du disque germinatif ( D.G) et le vitellus ( V) et des aires opaque ( A.O) et pellucide ( A.P) Ec : Ectophylle.
D. Segmentation totale des oeufs alécithes des Mammifères ( Marsupiaux et Euthériens). Exemple de l'oeuf de Femme ( Planche 3, figure A)
La segmentation de l'oeuf de femme est très lente. Le stade 2 blastomères ne serait atteint qu'au bout d'une trentaine d'heures après la fécondationet le stade à 4 blastomères 40 à 50 heuresaprès la fécondation. La morulaà 16 blastomères arriverait dans la cavité utérine au cours du 4ème jour encore entourée par la zone pellucidede l'ovule , mais libérée des cellules folliculeuses de la corona radiata qui se sont détachées dans la trompe. Pendant les 48 heures qui suivent , c'est à dire au cours des 5è et 6 è jours , l'oeuf reste libre dans la cavité utérine , perd sa zone pellucide et se creuse d'un blastocoele par écartement des blastomères.Le blastocoele s'accroît rapidement et les blastomères se répartissent en deux ensembles : une assise périphérique ou trophoblaste et un petit massif interne appendu à un pôle du trophoblaste , le bouton embryonnaire. Cette blastula caractéristique des mammifères est appelée blastocyste. L'embryon se développe à partie du seul bouton embryonnaire . Le trophoblaste participe à la formation d'une structure nourricière annexe à l'embryon , le placenta;
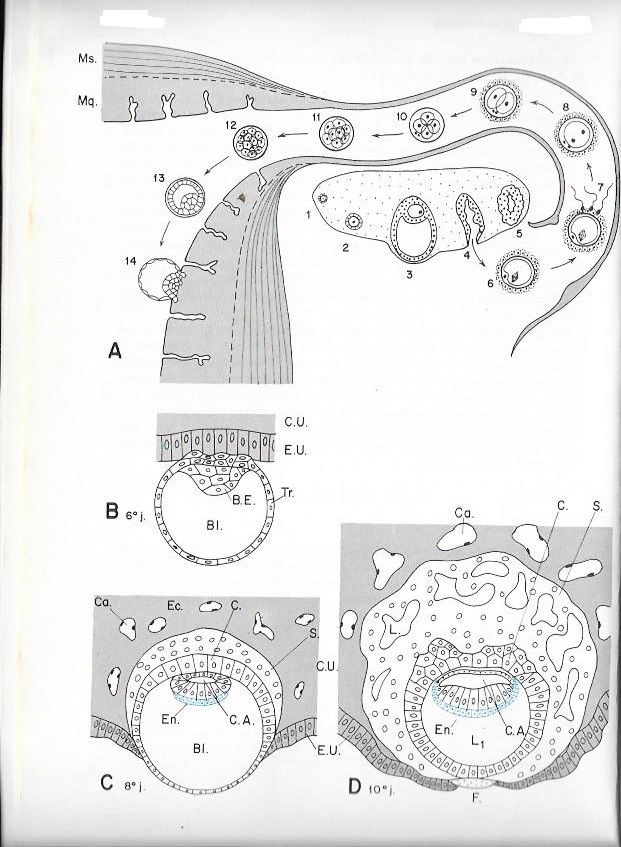
Planche II. 3 : Segmentation et nidation de l'oeuf humain
A : Coupe longitudinale schématique d'une trompe de Fallope et d'une partie de l'utérus résumant les premiers stades du développement de l'oeuf de la maturation de l'ovocyte à la nidation
1. Follicule primaire ; 2. Follicule secondaire ; 3 Follicule cavitaire de de Graaf ; 4 : ponte ovulaire ; 5 corps jaune ; 6 : expulsion du premier globule polaire ; 7-8 : Fécondation et expulsion du second globule polaire. 9 : Stade II; 10 : Stade IV; 11 Stade VIII ; 12 : Stade XVI; 13 : Blastocyste libre; 14 : Implantation ( d'après Hamilton, Boyd et Mossman )
B-D : Coupes sagittales schématiques au cours de la nidation ( d'après Dollander )
B : 6ème jour
C : 8ème jour
D : 10ème jour
B.e : Bouton embryonnaire ; Bl : blastocoele ; C : cytotrophoblaste ; Ca : capillaires utérins ; C.A : cavité amniotique ; CU : conjonctif utérin ; ; Ec : ectophylle ; F : caillot de fibrine ; L : lacunes de syncitiotrophoblaste ; L1 : lécithocoele primaire : Mq : muqueuse utérine ; Ms : musculeuse utérine ; S. Syncitiotrophoblaste ; Tr : trophoblaste.
E. segmentation partielle discoïdale des oeufs télolécithes. Exemple de l'oeuf de Poule ( Planche 2 figures G à L )
La segmentation de l'oeuf de Poule commence à environ 4 h 1/2 à 5 h après la fécondation, alors que l'oeuf qui chemine dans l'oviducte est déjà entouré de son albumine et de ses membranes coquillères. Elle est dicoîdale car elle n'intéresse que le petit disque germinatif nucléé( blastodisque ) qui coiffe l'énorme masse de vitellus . Elle se fait d'abord par des plans méridiens qui coupent le disque germinatif en tranches régulières. Ces tranches se subdivisent ensuite ensuite par des plans transversaux irréguliers puis par des plans horizontaux qui stratifient la couche unique de blastomères . Ainsi se forme 16 h après la fécondation un blastoderme fait de 4 à 5 assises cellulaires superposées. Sa partie centrale est séparée du vitellus par une fente étroite : la cavité sous-germinale improprement appelée blastocoele , formée progressivement par coalescence d'espaces initialement isolés , remplis de liquide , apparus précocement à la face intérieure des cellules les plus ventrales du germe.
En fin de segmentation ( 16 à 18 h après la fécondation ), les blastomères des couches inférieures du blastomère central s'arrondissent, se détachent et tombent dans la cavité sous germinale . Cette partie du blastoderme devenue unistratifiée et plus claire constitue l'aire pellucide. A sa périphérie , le blastoderme resté pluristratifié au contact du vitellus correspond à l'aire opaque , plus sombre Ce processus d'amincissement du blastoderme commence dans sa future partie puis gagne sa future partie antérieure. Il est la première indication de la polarisation antéro-postérieure du germe. Sa signification reste encore inconnue.
III. LA GASTRULATION
A. Définition
La gastrulation est la phase du développement embryonnaire au cours de laquelle les feuillets embryonnaires se mettent en place. Elle se réalise par un ensemble de mouvements cellulaires , les mouvements morphogénétiques , qui remanient la disposition des blastomères de la blastula et les répartissent en trois assises ou feuillets à partir desquels s'édifient les organes de l'embryon puis de l'adulte : un feuillet externe ou ectoblaste , un feuillet moyen ou mésoblaste et un feuillet interne ou entoblaste.
B. La gastrulation des oeufs hétérolécithes. Exemple de l'oeuf de Grenouille rousse ( planches 4 et 5 ).
La gastrulation est un phénomène complexe qui nécessite la mise en oeuvre de plusieurs techniques d'observation : observation directe du germe , marquage des blastomères par des colorants vitaux permettant de suivre leur évolution à la surface du germe, coupes sagittales réalisées à des stades successifs après marquage, permettant de suivre l'évolution de ces marques à l'intérieur du germe.
1 ° Observation directe du germe
La gastrulation débute dès la fin de la segmentation sans aucun stade de repos. Elle se manifeste en premier lieu par l'apparition d'un sillon transversal légèrement arqué vers le bas, situé un peu en dessous de la zone qu'occupait le croissant gris de l'oeuf fécondé ( le croissant gris s'est estompé au cours de la segmentation ). Ce sillon traduit le début de l'invagination du matériel superficielau niveau de sa lèvre dorsale , légèrement en surplomb par rapport aux macromères vitellins. Il correspond à l'apparition du blastopore et matérialise le plan de symétrie bilatérale du futur embryon déjà défini à la fécondation. Le sillon blastoporal s'allonge par ses bords latéraux qui s'incurvent d'abord en demi-cercle , puis en anse de panier et finalement en un cercle qui entoure les macromères vitellins clairs constituant le bouchon vitellin . Au cours de cette évolution , le matériel superficiel s'étend latéralement , puis ventralement en même temps que le sillon blastoporal s'invagine progressivement au niveau des lèvres dorsales, puis latérale et ensuite ventrale du blastopore. Les macromères vitellins sont ainsi peu à peu recouverts par les micromères du pôle animal sauf au niveau du bouchon vitellin où ils restent visibles. Ce bouchon vitellin n'a d'ailleurs qu'une existence transitoire. Il devient de plus en plus petit par resserrement de l'anneau blastoporal et disparaît finalement en profondeur, quand cet anneau est réduit à une courte fente longitudinale 24 h après la fin de la segmentation.
2° Marques colorées et leur évolution. Territoires présomptifs
La technique des marques colorées permet, par une sorte de tatouage de certains blastomères , de suivre leur déplacement et leur évolution à la surface du germe et d'analyser ainci les mouvements qui se produisent au cours de la gastrulation ( Planche 4 ).
Planche II.4
A : Sillon blastoporal
B : Blastopore en anse de panier
C : Bouchon vitellin
D : Régression du bouchon vitellin
E : Disparition du bouchon vitellin
F : Territoires présomptifs d'une jeune blastula. vue latérale gauche.
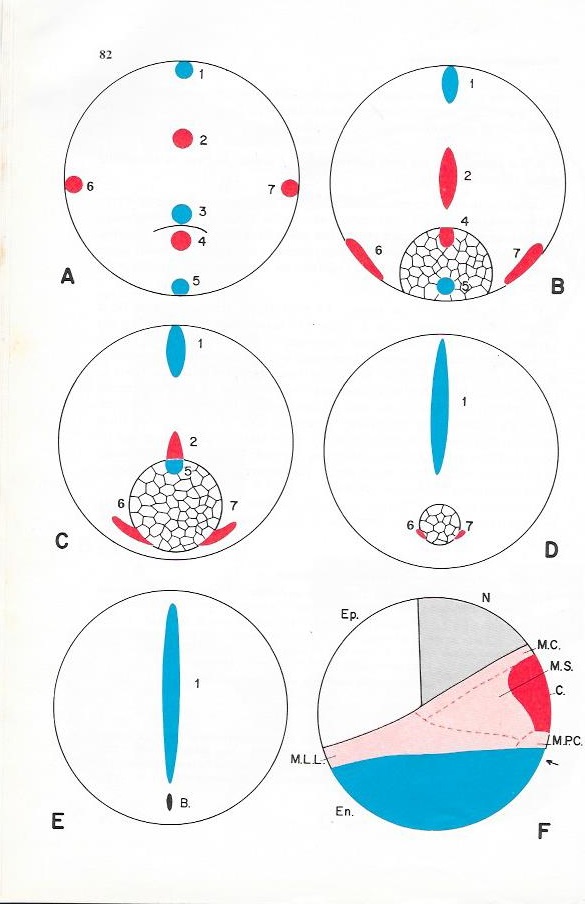
(La flèche indique la position de la future encoche blastoporale) B : Blastopore ; C: Cordomésoblaste ; En : Ectoblaste ; Ep : Epiblaste ; M.C : Mésoblaste caudal ; M.L.L : Mésoblaste des lames latérales ; M.PC. : Mésoblaste précordal : M.S : Mésoblaste somitique ; N : Neuroblaste.
Elle permet également de repérer à la surface du germe, dès la fin de la segmentation , des territoire dont la destination est toujours rigoureusement la même dans un développement normal . Ces territoires sont qualifiés de présomptifs car il est encore possible de modifier expérimentalement leur destinée, ce que l'on traduit aussi en disant qu'ils ne sont pas encore déterminés.
La technique la plus simple permettant de repérer des territoires présomptifs contiste à "tatouer" les blastomères par des colorants vitaux , ce qui permet de suivre facilement leur évolution au cours du développement ultérieur. On peut ainsi établir , par une exploration systématique de la surface du germe , une carte des territoires présomptifs .
Sur une telle carte ( Planche 4.4 F ), l'ectoblaste présomptif occupe à peu près un hémisphère , légèrement décalé par rapport à l'hémisphère animal . L'entoblaste présomptif occupe une calotte au pôle végétatif . Entre les deux s'intercale un anneau qui représente les territoires présomptif du cordo-mésoblaste . Le territoire ectoblastique présomptif est partagé en deux par un demi cercle séparant les territoires présomptif de l'épiblaste ( futur épiderme ) et du neuroblaste ( futur système nerveux ). Le territoire cordal présomptif est situé dans la partie la plus large de l'anneau cordomésoblastique , au dessus de l'encoche blastoporale . La limite inférieure de l'ectoblaste présomptif légèrement inclinée par rapport à l'équateur fait donc la séparation entre le futur matériel ectoblastique qui reste superficiel après la gastrulation et les futurs matériels cordomésoblastiques et entoblastiques qui s'évaginent au cours de la gastrulation.
3° Coupes sagittales
( Planche III.5 )
Les mouvements complexes de la gastrulation se comprennent mieux en étudiant des coupes sagittales réalisées avec des stades successifs . Ils peuvent schématiquement se ramener à 4 mouvements simples simultanés.
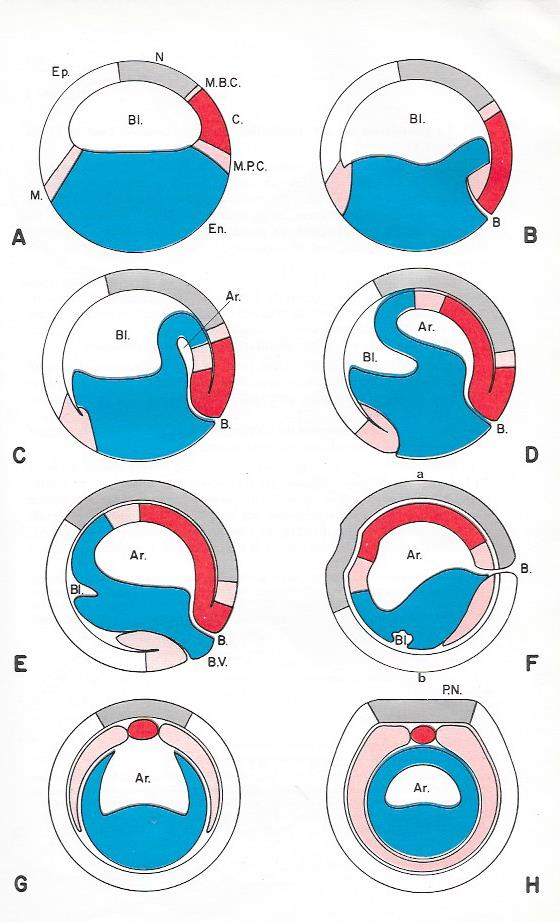 Planche III.5 : Gastrulation de l'oeuf de grenouille
Planche III.5 : Gastrulation de l'oeuf de grenouille
A - F : Coupes sagittales schématiques
G-H : Coupes transversales ; G : selon a-b du stade F ; H : coupe correspondant à un stade plus agé
Ar : archentéron ; B : Blastopore ; Bl : Blastocoele ; B.V : Bouchon vitellin ; C : Cordoblaste ; E : Entoblaste ; Ep : Epiblaste ; M : Mésoblaste ; M.B.C : Mésoblaste du bourgeon caudal ; M.PC : Mésoblaste précordal ; N : Neuroblaste ; P.N. : Plaque neurale .
1. Un mouvement d'invagination . Il fait s'enfoncer à l'intérieur du germe les territoires cordo-mésoblastiques et entoblastiques présomptifs primitivement superficiels. Il en résulte la formation d'une cavité, l'archentéron ouverte au niveau du blastopore. Le mouvement débute au niveau de la lèvre dorsale du blastopore par l'invagination du futur matériel cordal . Il se poursuit au niveau des lèvres latérales du blastopore par l'invagination du futur matériel mésoblastique et s'achève au niveau de la lèvre ventrale du blastopore par l'invagination du futur matériel entoblastique.
Le cordomésoblaste présomptif s'invagine par un véritable enroulement autour des lèvres blastoporales et se réfléchit en profondeur . L'entoblaste présomptif, au contraire , ne fait que s'enfoncer progressivement en basculant à l'intérieur du germe . Ce mouvement réduit peu à peu le blastocoele qui devient finalement virtuel.
2. Un mouvement d'élongation. Il intéresse le futur matériel mésoblastique et surtout le futur matériel ectoblastique . Celui -ci s'étale en effet jusqu'aux lèvres blastoporales grâce à une multiplication cellulaire active et tend ainsi à recouvrir toute la surface externe du germe en un vaste mouvement d'enveloppement appelé épibolie .
3. Un mouvement de convergence . Il regroupe dans le plan sagittal de la gastrula les territoires de la future corde et du mésoblaste axial ( futures somites ), initialement étalés sur la blastula avant l'invagination .
4. Un mouvement de divergence. Il intéresse le futur matériel mésoblastique des lames latérales, initialement très localisé à la surface du germe , mais qui s'étale en profondeur après convergence et invagination et double presque tout l'ectoblaste.
C. La gastrulation des oeufs télolécithes, premier exemple : l'oeuf de truite
L'oeuf de Truite est un oeuf volumineux ( 3,5 à 5 mm de diamètre ) dont la segmentation partielle discoïdale aboutit à une discoblastula , comparable à celle de l'oeuf de Poule . La carte des territoires présomptifs établie en suivant l'évolution des marques colorées est donnée à la figure A de la planche 6.
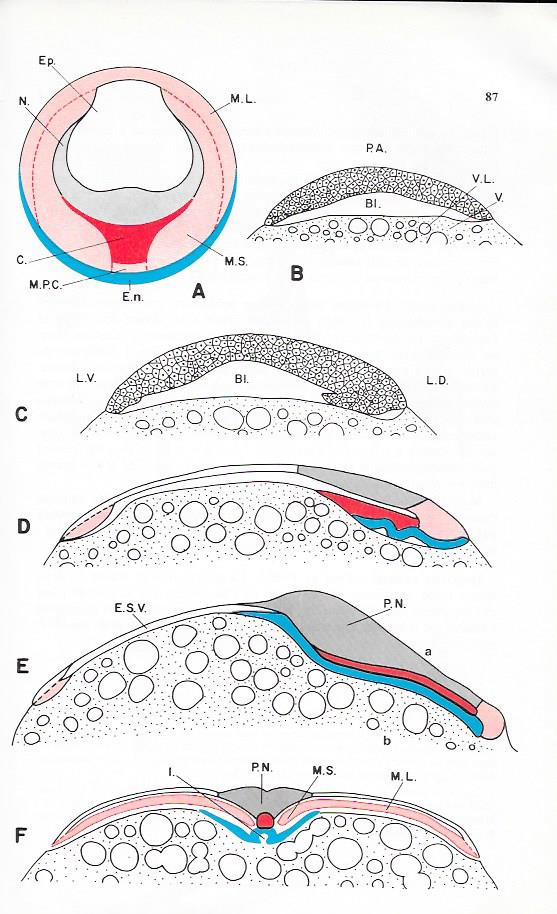 Planche III.6 : Gastrulation de l'oeuf télolécithe de truite.
Planche III.6 : Gastrulation de l'oeuf télolécithe de truite.
A : Carte des territoires présomptifs ( d'après Pasteels ).
B-E : Coupes sagittales du blastoderme ( d'après Witschi ).
B : Blastula
C: Début de gastrulation
D : Gastrulation âgée
E : jeune neurula. Formation des premiers somites
F : coupe transversale du même stade selon a-b ( d'après Witschi ).
Bl. : Blastocoele ; C. : Cordoblaste ; En. : Entoblaste ; Ep. : Epiblaste ; E.S.V. : Epithélium du sac vitellin ; I. : Intestin ; L.D. : Lèvre dorsale du blastopore ; L.V : Lèvre ventrale du blastopore. ; M.L. : Mésoblaste des lames latérales ; M.P.C : Mésoblaste précordal ; M.S. : Mésoblaste somitique : N. : Neuroblaste ; P.A : Pôle animal ; P.N. : Plaque neurale ; V. : Vitellus ; V.l : Vacuole lipidique.
La répartition de ces territoires offre de grandes analogies avec celle des Amphibiens. Ces ressemblances vont se retrouver dans la mise en place de ces territoires.
La gastrulation qui dure 5 jours à 10 °C met en jeu, les mêmes types de mouvement que dans l'oeuf de Grenouille ( invagination, élongation, convergence, divergence ), mais la présence de la masse vitelline inerte entraîne évidemment quelques particularités importantes.
Deux phénomènes essentiels, simultanés , doivent être distingués.
- D'une part une invagination des futurs matériels cordo-mésoblastiques et entoblastiques initialement superficiels qui se réalise sur tout le pourtour du disque germinatif, avec toutefois une importance variable selon l'emplacement.
- D'autre part une extension du disque germinatif qui s'étale à la surface du vitellus et l'enveloppe progressivement.
1. Invagination. Elle commence à un point légèrement épaissi du bord du blastodisque , le noeud terminal, qui correspond à la future région médio-dorsale de l'embryon . A ce niveau l'entoblaste présomptif s'enroule autour d'une sorte de charnière représentée par le bord du blastodisque et s'étale en une lame entoblastique directement à la surface du vitellus . Le futur territoire cordal suit le même mouvement et s'insinue entre l'entoblaste et l'ectoblaste. Le mouvement d'invagination s'étend latéralement au matériel somitique puis gagne la partie diamétralement opposée du disque où s'invagine le matériel des lames latérales.
Le mouvement d'invagination est maximum au niveau du noeud terminal qui s'allonge progressivement vers l'arrière par convergence du matériel ectoblastique à son niveau , tandis qu'il invagine sous cet ectoblaste l'entoblaste et la corde . Le noeud terminal représente donc la zone embryogène qui édifie l'embryon en commençant par la future région céphalique , pratiquement fixe au niveau du pôle animal et en l'achevant par la région caudale qui s'allonge progressivement au cours de la gastrulation.
2. Extension . En même temps que se produit ce mouvement d'invagination périphérique le disque germinatif s'étale à la surface du vitellus et l'enveloppe progressivement. Ce bord "d'enveloppement" constitue donc un véritable blastopore qui d'une part enfouit le vitellus à l'intérieur du germe et d'autre part, invagine de façon continue le cordo-mésoblaste . La région du noeud terminal où s'invagine la corde est donc homologue à la lèvre doirsale du blastopore de la Grenouille , les régions latérales au lèvres latérales et la région diamétralement opposée à la lèvre ventrale . Ce blastopore annulaire entoure la masse vitelline , homologue au bouchon vitellin de l'oeuf de Grenouille . Quand il a franchi l'équateur de l'oeuf, il se referme progressivement puis disparaît quand le rvêtement du vitellus par les bords du disque germinatif est achevé. Malgré ces analogies , la gastrulation de l'oeuf de truite diffère par un point essentiel de la gastrulation de l'oeuf de grenouille : le germe reste massif pendant toute la mise en place des feuillets , il n'est creusé d'aucune cavité : en particulier la cavité archentérique est absente
Deuxième exemple : l'oeuf de Poule .
La gastrulation se réalise en deux temps : elle commence dès le début de l'incubation par la mise en place de l'hypoblaste primaire , futur entoblaste extraembryonnaire ; elle se poursuit et s'achève par la mise en place de l'entoblaste intraembryonnaire et du cordomésoblaste .
Planche III. 7 : Gastrulation de l'oeuf télolécithe de Poule , Vues polaires du blastoderme.
Pour chaque stade, le blastoderme est coupé en deux moitiés : la moitié gauche indique la localisation des principaux territoires présomptifs sur l'ectophylle . La moitié droite représente les territoires ento- et cordomésoblastiques invaginés, l'ectophylle étant enlevé ( d'après Vakaet ).
C : Corde dorsale ; E1 : Hypoblaste primaire ( ou entoblaste extraembryonnaire) ; E2 : Entoblaste embryonnaire ; Ep : Epiblaste ; L.L Lames latérales; L.P : Ligne primitive ; M.E.E : Mésoblaste extra-embryonnaire de l'aire vasculaire ; N : Neuroblaste ; N.H : Noeud de Hensen ; P.C. : Prolongement céphalique ; S : Somites .
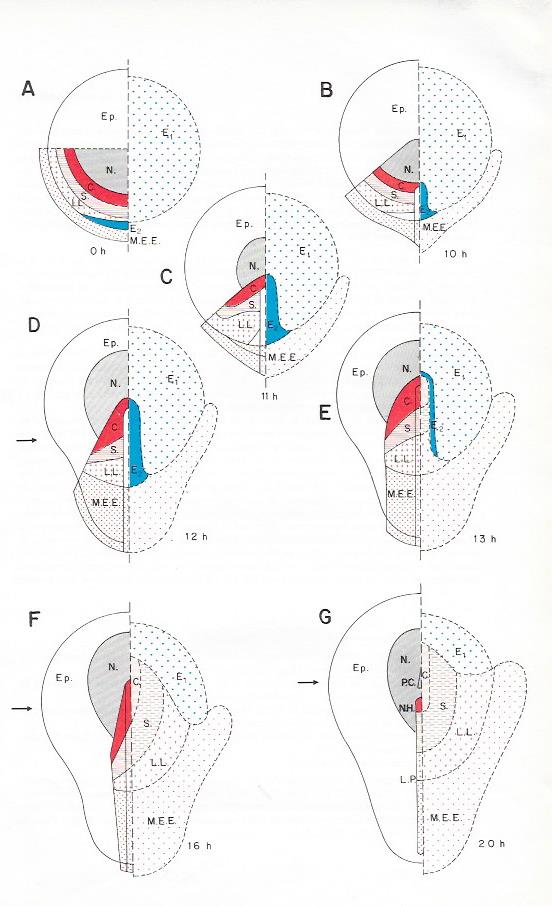
1) Mise en place de l'hypoblaste primaire . Elle débute aussitôt après la ponte et s'achève vers là 8è heure d'incubation. Le blastoderme est alors diblastique . Son feuillet superficiel ou " ectophylle " est doublé d'un feuillet profond , l'hypoblaste primaire : futur entoblaste extra-embryonnaire ( du sac vitellin ). Son origine semble double : une partie provient d'une polyinvagination verticales des cellules du blastoderme de l'aire pellucide, qui débute dans la future région postérieuredu blastoderme et progresse vers l'avant ( comme la cavité sous germinale ) , une autre proviendrait d'une migration horizontale de cellules du bord de l'aire opaque . Cet hypoblaste primaire contient les cellules germinales primordialesqui se rassembleront dans le croissant germinal antérieur de l'aire opaque.
2) Mise en place de l'entoblaste intraembryonnaire et du cordomésoblaste ( planche 7). Elle commence dès la mise en place de l'hypoblaste primaire et se traduit par un épaississement du quandrant postérieur postérieur de l'aire pellucide ( figure B ) consécutif à une accumulation de blastomères provenant de toute la surface de l'ectophylle . Cet épaississement évolue à la façon d'un éventail qu'on referme autour d'un axe situé au centre de l'aire pellicide ( figures C-D ) . Au terme de ces mouvements morphogénétiques , l'épaississement est réduit à une ligne sombre : la ligne primitive ( figure E ) qui indique le futur axe antéro-postérieur de l'embryon.
Le blastoderme s'étale progressivement à la surface du vitellus, mais plus rapidement dans la région postérieure où se situe la ligne primitive . Il prend ainsi une forme ovalaire puis s'allonge en une sorte de raquette à gros manche , tandis que la ligne primitive s'accroît à l'avant et atteint sa longueur maximale vers la 18è heure d'incubation . Elle est légèrement déprimée en forme de gouttière à sa surface et se termine en avant par un épaississement temporaire : le noeud de Hensen.
La première partie du matériel de l'ectophylle correspondant au territoire présomptif de l'entoblaste intra-embryonnaire s'invagine au niveau du noeud de Hensen , ,puis de la partie antérieure de la ligne primitive et s'insère au centre de l'hypoblaste primaire qu'il repousse progressivement vers la périphérie. Le feuillet entoblastique est donc de deux populations cellulaires d'origine, de structure et de comportement différent : les cellules de l'hypoblaste primaire, futur entoblaste extra embryonnaire , à la périphéries , mises en place les premières et les cellules de l'entoblaste intraembryonnaire , au centre ayant envahi secondairement l'hypoblaste primaire .
Une seconde partie de l'ectophylle correspondant au territoire présomptif du cordomésoblaste converge vers la ligne primitive sur toute sa longueur et s'invagine entre l'ectophylle et l'hypoblaste primaire . Le territoire présomptif du mésoblaste extraembryonnaire s'invagine le premier , en même temps et en arrière de l'entoblaste intraembryonnaire ( figures C-D ) ; celui du mésoblaste intraembryonnaire ( corde, somites, lames latérazles )un peu plus tard, après l'entoblaste intraembryonnaire et au niveau ( fig E-F-G).
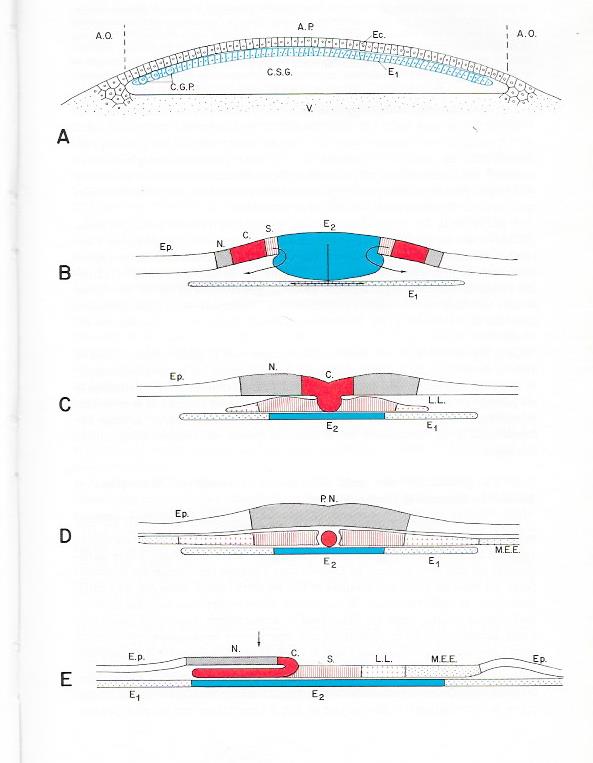
Planche III.8. Gastrulation de l'oeuf télolécithe de Poule
A. Coupe sagittale d'un blastoderme diblastique après 8 h d'incubation. L'hypoblaste primaire ( E1) est en place sous l'ectophylle ( Ec)
B. Coupe transversale ( au niveau de la flèche de la figure D , planche 7) d'un blastoderme de 12 h au cours de l'invagination de l'entoblaste intraembryonnaire E2.
C Coupe transversdale ( au niveau de la flèche de la figure F , planche 7 ) d'un blastoderme de 16 h au cours de l'invagination du cordo-mésoblaste.
D. Coupe transversale au niveau de la flèche de la figure G , planche 7 et de la figure E ci-dessous ) d'un blastoderme de 20 h.
E. Coupe sagittale du même embryon.
A.O : Aire opaque ; A.P : aire pellucide ; Corde ; C.G.P. : Cellules germinales primordiales ; C.S.G : Cavité sous germinale ; E. : Hypoblaste primaire ( Entoblaste extra-)embryonnaire ); E2 : Entoblaste embryonnaire ; Ec : Ectophylle ; Ep. : Epiblaste ; L.L. : Lames latérales ; M.E.E. : Mésoblaste extraembryonnaire de l'aire vasculaire ; N. : Neuroblaste ; P.N. : Plaques neurales ; S. : Somites ; V. : Vitellus.
 La ligne primitive fonctionne donc comme un blastopore étiré antéro-postérieurement . Son extrémité antérieure le noeud de hensen où s'invagine le matériel cordal ( et, exceptionnellement chez lOiseau , l'entoblaste intraembryonnaire ) représente donc sa lèvre dorsale, ses deux bords latéraux parallèlkes , les lèvres latérales du blastopore de la grenouille , mais celles-ci restent jointives en l'absence de cavité archentérique . Une fois invagine entre entoblaste et ectoblaste , le matériel cordal s'allonge en une tigelle cylindrique , la corde dorsale , visible par transparence ( prolongement céphalique ) tandis que le matériel mésoblastique ( somites, lames latérales) s'étale en deux grandes ailes latérales ( figures F-G).
La ligne primitive fonctionne donc comme un blastopore étiré antéro-postérieurement . Son extrémité antérieure le noeud de hensen où s'invagine le matériel cordal ( et, exceptionnellement chez lOiseau , l'entoblaste intraembryonnaire ) représente donc sa lèvre dorsale, ses deux bords latéraux parallèlkes , les lèvres latérales du blastopore de la grenouille , mais celles-ci restent jointives en l'absence de cavité archentérique . Une fois invagine entre entoblaste et ectoblaste , le matériel cordal s'allonge en une tigelle cylindrique , la corde dorsale , visible par transparence ( prolongement céphalique ) tandis que le matériel mésoblastique ( somites, lames latérales) s'étale en deux grandes ailes latérales ( figures F-G).
Les mouvements morphogénétiques qui président à la gastrulation de l'oeuf de Poule sont donc comparables à ceux déjà signalés à propos de l'oeuf de Grenouille : élongation générale des différents territoires présomptifs, convergence du matériel superficiel vers la ligne primitive , invagination du matériel cordomésoblastique ( et entoblastique intraembryonnaire ) au niveau de la ligne primitive et divergence très accusée du mésoblaste des lames latérales qui s'insinue et s'étale entre ectoblaste et entoblaste.
A partir de la 22è heure d'incubation, le noeud de Hensen recule, la ligne primitive se raccourcit progressivement et le prolongement céphalique s'accroît d'autant. Les feuillets mis en place par la gastrulation dans la région antérieure de l'embryon commencent à se différencier : le tube neural se forme , les premiers somites apparaissent . Mais la gastrulation n'en est pas pour autant terminée dans la région postérieure de l'embryon où la ligne primitive continue à mettre en place le cordo-mésoblaste de la partie postérieure du tronc.
Ce n'est que vers la 48è heured'incubation que la gastrulation s'achève avec la disparition de la ligne primitive . A ce moment, les régions céphaliques et roncale antérieure de l'embryon sont déjà bien différenciées : l'encéphale est partagé en 5 vésicules, les vésicules optiques sont formées et le cristallin se met en place , la première paire de fentes viscérales est percée, le coeur est fonctionnel et la circulation est établie , 26 paires de somites sont individualisées.
D. La gastrulation des oeufs alécithes de Mammifères Marsupiaux et Euthériens. Exemple de l'oeuf de Femme.
Bien que la segmentation de l'oeuf de ces Mammifères soit totale, comme celle des oeufs hétérolécithes, la mise en place des feuillets embryonnaires rappelle au contraire celle des oeufs télolécithes des Sauropsidés. Cette particularité est très certainement en rapport avec l'origine reptilienne des Mammifères . La mise en place des feuillets se fait en deux temps, mais elle va s'intriquer avec la différenciation de structures extra-embryonnaires , les annexes embryonnaires qui, chez les Sauropsidés , apparaissent beaucoup plus tard. Cette accélération de la formation des annexes embryonnaires est évidemment en relation avec l'absence de vitellus dans l'oeuf et la nécessité d'une nutrition maternelle.
1° Mise en place de l'entoblaste ( Planche 3, figures C et D) . Après deux ou trois jours de vie libre dans la cavité utérine ( soit au cours du 6è ou du 7è jour après la fécondation), le blastocyste se fixe à l'épithélium utérin puis pénètre par effraction dans la muqueuse utérine où il s'installe définitivement.
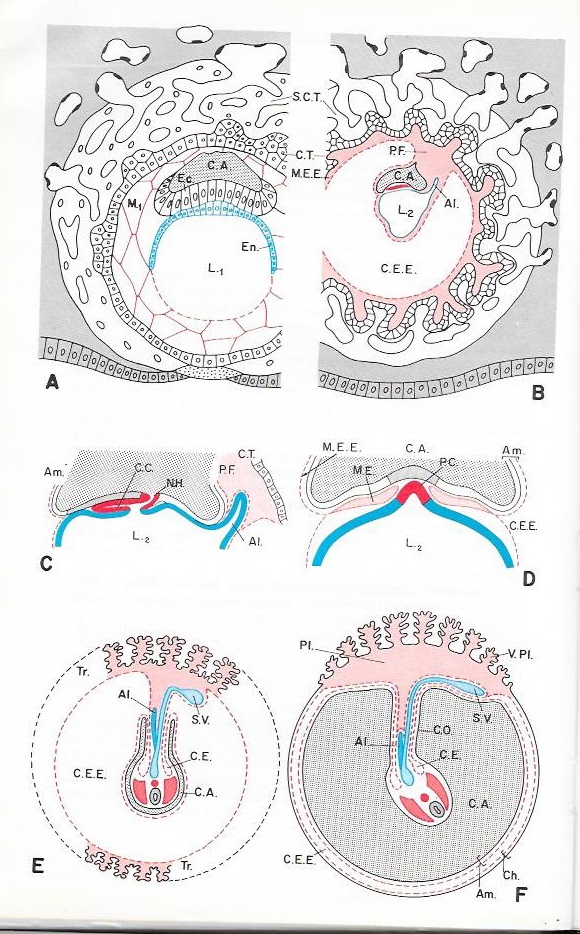
Planche III. 9 : Gastrulation et mise en place des annexes embryonnaires de l'embryon humain.
A : Embryon 13 jours : Coupe sagittale schématique ( modifié d'après Dollander ).
B : Embryon d'environ 19 jours : Coupe sagittale schématique ( modifié d'après Witschi ).
C : Détail de l'embryon de 19 jours : coupe sagittale schématique de la ligne primitive
D : Coupe transversale schématique du même embryon au niveau du canal cordal fissuré
E : Coupe transversale schématique d'un embryon au début du deuxième mois. Les villosités syncitiotrophoblastiques sont développées sur tout le pourtour du chorion ( chorion diffus )
F :Coupe transversale schématique d'un embryon au début du troisième mois . Les villosités syncytiotrophoblastiques sont localisées à la région du pôle de fixation ( placenta discoïdal ).
Al. : Allantoïde ; Am. : Amnios ; C.A : Cavité amniotique ; C.C : Canal chordal ; C.E : Coelome embryonnaire; Ch : Chorion ; C.O : Cordon ombilical ; C.T : Cytotrophoblaste ; Ec : Ectophylle ; En . : Entophylle ; L1 : Lécithocoele embryonnaire ; M1 : Mésenchyme primaire ; M.E : Mésoblaste embryonnaire ; M.E.E : Mésoblaste extra-embryonnaire ; N.H : Noeud de Hensen ; P.C : Plaque cordale ; P.F : Pédicule de fixation ; Pl : Placenta discoïdal ; S.C.T : Syncytiotrophoblaste ; S.V : Sac vitellin; T.R : Trophoblaste ; V.Pl : Villosité placentaire.
54 ou 48 heures après cette nidation ( soit au cours du 8ème jour après la fécondation ) le feuillet entoblastique apparaît à la face inférieure du bouton embryonnaire, opposé au pôle d'implantation. L'origine de l'entoblaste n'est pas encore clairement définie . Il proviendrait soit d'une simple délamination du bouton embryonnaire , soit d'une invagination localisée des cellules du trophoblaste qui glisseraient à la face inférieure du bouton embryonnaire.
- Au cours du 8 ème jour le bouton embryonnaire se creuse d'une cavité amniotique limitée par un épithélium simple, mince à son toit, plus épais à son plancher où il constitue l'ectophylle. Cet ectophylle doublé de l'entoblaste constitue le disque embryonnaire diblastique , à partir duquel se différenciera l'embryon. Ce disque est homologue au blastoderme diblastique de pouletau moment de la ponte et va évoluer de la même façon.
- Dès le 10ème jour , des éléments probablement détachés du trophoblaste se disposent à la surface interne de celui-ci et s'organisent en un mésenchyme primaire , réprésentant l'ébauche du mésoblaste extraembryonnaire ( Planche 9 fig A). A partir de ce moment, le trophoblaste s'accroît plus vite que la cavité amniotique et il se décolle de cette dernière . En même temps l'entoblaste prolifère et de referme ventralement vers le 14 ème jour en une cavité homologue à un sace vitellin , mais dépourvue de vitellus : le lécithocoele ( pl 9 figure B ). L'espace compris entre le trophoblaste externe et les deux cavités internes ( cavité amniotique et lécithocoele ) est occupé par le réseau de cellules du mésenchyme primaire.
- A la fin de la seconde semaine , ce mésenchyme se condense en males minces contre le trophoblaste d'une part, contre la cavité amniotique et lécithocoele d'autre part en ménageant une cavité , le coelome extra embryonnaire . Ce coelome est ainsi limité par une paroi de mésoblaste extra-embryonnaire constituant contre le trophoblaste et contre la cavité amniotique la somatopleure, et contre le lécithocoele la splanchnopleure. L'embryon à la fin de la seconde semaine est ainsi réduit à un disque diblastique résultant de l'affrontement des deux cavités amniotiques et lécithocoelique. L'ensemble de l'embryon et de ces deux cavités est entouré de la cavité coelomique extraembryonnaire , revêtue extérieurement par le trophoblaste . Un pédicule de fixation relie la somatopleure amniotique à la somatopleure du trophoblaste . Il représente la toute première ébauche du cordon ombilical. Un diverticule entoblastique , ébauche de l'allantoïde, le pénètrera ultérieurement.
2° Mise en place du cordomésoblaste ( Planche 9 figures C et D )
- Elle débute vers le 16ème jour par l'apparition de la ligne primitive . Celle-ci s'accroît vers l'avant et atteint sa longueur maximale vers le 19è jour. Elle est renflée en noeud de Henzen et se continue par le prolongement céphalique . L'invagination du matériel cordomésoblastique aboutit à la formation de la corde axiale et des deux ailes de mésoblaste qui s'étalent entre ectoblaste et entoblaste et se raccordent à la périphérie du disque embryonnaire au mésoblaste extra embryonnaire déjà en place.
Le prolongement céphalique se présente chez l'homme et divers Mammifères ( Rat, Souris, Chien, Taupe, ...) sous forme d'un tuble ouvert au niveau du noeud de Hensen , le canal cordal . Une fissuration intéressant le plancher du canal cordal et le toit du lécithocoele permet l'étalement du canal en une plaque cordale qui s'incorpore dans la région médiane au toit du lécithocoele . Elle s'en séparera ultérieurement .
- au 20ème jour la ligne primitive régresse, le noeud de Hensen recule : la gastrulation s'achève
Pour l'organogenèse qui suit le développement embryologique , voir dans ce site : http://www.vdsciences.com/pages/sciences-biologiques/biologie-animale/organogenese/
IV LES ANNEXES EMBRYONNAIRES
A. Définition
On désigne sous le nom d'annexes embryonnaires des organes provisoires situés en dehors du corps de l'embryon, qui n'interviennent pas dans la formation de ses propres organes mais qui assurent sa protection et sa nutrition. A la naissance, les annexes sont abandonnées ou progressivement résorbées.
B. Annexes embryonnaires et conditions biologiques du développement
L'apparition et le développement des annexes embryonnaires sont liés à trois facteurs essentiels du développement embryonnaire : la richesse de l'oeuf en vitellus et son mode de segmentation, la nécessité du développement de l'embryon en milieu aquatique, la rétention de l'oeuf dans les voies génitales maternelles et l'établissement éventuel de liaisons entre le foetus et sa mère.
1° Segmentation partielle des oeufs télolécithes : le sac vitellin. .
Pour les annexes embryonnaires voir dans ce site : http://www.vdsciences.com/pages/sciences-biologiques/biologie-animale/organogenese/organogenese-vertebres-12.html
Date de dernière mise à jour : 11/12/2015
Ajouter un commentaire




