- Accueil
- E. Chimie
- VI .Biochimie
- I.Biochimie structurelle COMPLET
- I. Biochimie structurelle 3
I. Biochimie structurelle 3
5. Les enzymes
Ces notions élémentaires sur les protéines devront être détaillées ultérieurement mais envisageons d'abord quelques notions sur les enzymes constituant une des deux grandes classes de protéines.
Une enzyme est une protéine se caractérisant par une action catalytique sur la cinétique d'une réaction chimique qui serait nulle ou très lente en l'absence d'enzyme. Dans cette définition 3 aspects importants apparaissent :
1) par sa présence, l'enzyme accélère la vitesse de réactiondans un sens ou dans l'autre sans modifier l'équilibre de la réaction,
2) les enzymes sont des catalyseurs et répondent doncà la définition des catalyseurs, c'est à dire qu'elles sont présentes en petites quantités dans les cellules (une espèce enzymatique est représentée au mieux par quelques dizaines de mg pat kg de tissus frais. ); d'autre part, puisque les enzymes sont des catalyseurs elles restent inchangées au cours de la réaction , ou plus exactement, la structure enzymatique présente avant la réaction est retrouvée après la réaction. Pendant la réaction, on peut observer des modifications
3) les enzymes sont des protéines , elles ont donc toutes les caractéristiques des protéines . Ce sont des macromolécules construites par l'assemblage d'acides aminés pour constituer des chaînes peptidiques et l'organisation spatiale d'une ou plusieurs chaînes.. Les poids moléculaires des enzymes actuellement connues ( environ 2000) varient d'environ 10.000 à 2.106
Une propriété qui n'apparaît pas dans la définition donnée plus haut est la SPECIFICITE , c'est à dire la " capacité " dont dispose une enzyme pour reconnaître les molécules qu'elle est capable de modifier . Certaines enzymes ont une "pécificité absolue ", ces enzymes catalysent une réaction donnée et une seule , ex : l'arginase qui catalyse la transformation d'arginine en ornithine, l'uréase qui catalyse la libération d'un ammonium à partir de l'urée. Le nombre des enzymes de ce type n'est pas très élevé . Plus généralement , les enzymes ont une "spécificité relative " . La spécificité peut dans ce cas être une :
- spécificité de groupe : l'enzyme agit sur des molécules qui ont des groupes fonctionnels particuliers , ex/ un groupe méthyl , amine, phosphate
- spécificité de liaison : l'enzyme agit sur un type de liaison chimique sans tenir compte du reste de la structure moléculaire ; ex/ coupure de liaison peptidiques dans une protéine pour libérer des a.a. ( protéases ).
- spécificité stéréochimique : l'enzyme agit sur un isomère optique ou stérique particulier , ex/ les isomérases.
Hormis quelques noms anciens qui ont été conservés ( pepsine, trypsine, chymotrypsines, toutes trois des protéases ), tous les noms d'enzymes se terminent par la syllabe ase , devant le nombre croissant d'enzymes découvertes, une classification et une numérotation ont été adoptées sur la recommandation d'une commission internationale des enzymes, le système répartit les enzymes en classes d'après le type de réaction catalysée : un nom indiquant la nature de la réaction catalysée et un numéro d'identification sont attribués à chaque enzyme, ce qui permet une identification précise de chaque espèce enzymatique.


Ex. L'enzyme catalysant la réaction suivante : ATP + créatine <=> ADP + phosphocréatine
nom usuel : créatine kinase.
nom systématique : ATP créatine phosphotransférase
code : E.C 2.7.3.2
Certaines enzymes doivent leur activité à la structure protéique uniquement , d'autres nécessitent en outre des structures non-protéiques ou cofacteurs. Le cofacteur peut être soit un
CO-ENZYME, c'est à dire une substance organique de poids moléculaire peu élevé ( matériel dialysable ), thermostable et faiblement attachée à l'enzyme proprement dite : cet attachement est attaché notamment par des liaisons hydrogène
Ex : pyridoxal phosphate , ATP , NAD, NADP qui sont des facteurs important pour le métabolisme cellulalire.
Soit un GROUPEMENT PROSTHETIQUE ; c'est à dire une substance organique dialysable thermostable fermement attachée à l'enzyme ( par une liaison covalente )
Ex : thiamine, FAD,coenzyme A, ( contrairement au nom donné.
Soit un ION METALLIQUE : qui aura un rôle d'activateur dans une réaction biochimique.
Ex : Fe++, Cu++, Zn++,Mn++,Mg++,Ca++,Mo++.
Soit la COMBINAISON DE DEUX FACTEURS CO-ENZYME + METAL
Le complexe composé de la fraction protéique ( appelé aussi APO-ENZYME ) et du COFACTEUR est dénommé HOLOENZYME.
:L'activité enzymatique peut dans certains cas ne s'exprimer qu'après une modification de la structure primaire de la protéine.

Cette activation est catalysée par l'enzyme elle-même. De même, le trypsinogène est transformé en trypsine active par le clivage d'un hexapeptide, catalysé par une enzyme : l'entérokinase. Enfin, le chymotrypsinogène est transformé en chymotrypsine active par l'action de la trypsine qui enlève 2 fragments de 2 a.a dans la séquence de l'enzyme. Une fois activées, ces trois protéines du système digestif permettent la dégradation des protéines ingérées. Il n'existe pas de réaction inverse permettant de reconvertir ces enzymes en leur forme inactive ( appelée aussi zymogène ), aucune régulation de l'activité de ces enzymes n'est donc possible.
La modulation de l'activité enzymatique par des modifications covalentes de la structure des enzymes existe néanmoins et sera détaillée ultérieurement lors de l'étude du métabolisme du glycogène. Signalons aussi dès maintenant que l'activité enzymatique peut être modulée de manière non covalents . Ce point sera détaillé ultérieurement lors d'études métaboliques.
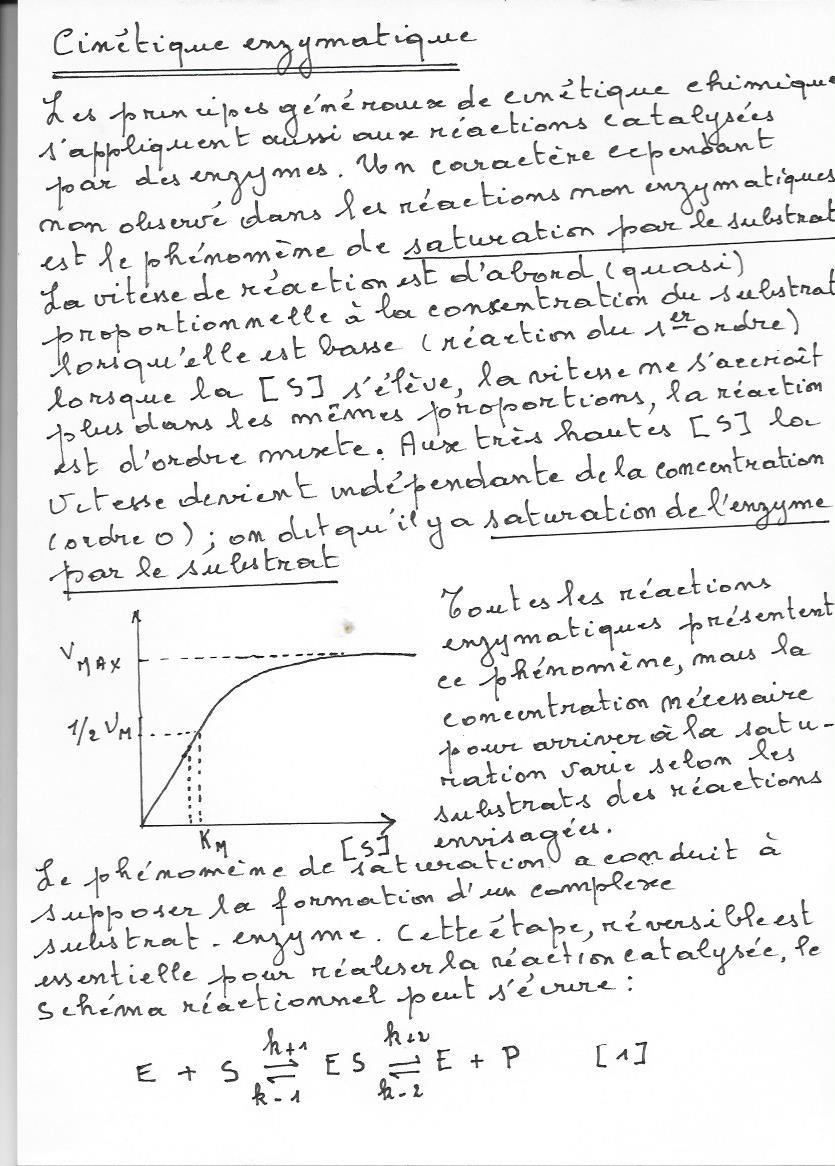



uuuuuuuuuuuuuuu
Date de dernière mise à jour : 09/01/2017
Ajouter un commentaire

