- Accueil
- E. Chimie
- VI .Biochimie
- I.Biochimie structurelle COMPLET
- I.Biochimie structurelle 2
I.Biochimie structurelle 2
PROTIDES/PROTEINES
1. Définition :les protéines sont des composés organiques complexes et aminés, qui sont trouvés dans toute cellule vivante, ce sont les molécules les plus abondantes des cellules représentant au moins 50 % du poids sec de ces dernières. Les protéines jouent un rôle fondamental dans l'architecture et dans le fonctionnement cellulaires : il s'agit respectivement des protéines de structures d'une part et, les protéines enzymatiques, ou enzymes d'autre part.
2. Classification
La classification est relativement simple :
- Protides simples ou non hydrolysables ------> acides aminés.
- Protides qui après hydrolyse donnent un petit nombre d'acides aminés ( 2 à 50 ) --------> peptides.
- Protides contenant un grand nombre d'acides aminés ------> protéines.
3. L'acide aminé
3.1 Structure générale
Les protéines peuvent avoir des poids moléculaires très élevés, mais par hydrolyse acide, on obtient une structure moléculaire relativement simple : c'est l'unité élémentaire de la protéine protéine, les acides aminés . Ils répondent à la formule générale suivante :
COOH : fonction acide.
NH2 : fonction amine.
R est l'unique partie variable de la molécule.
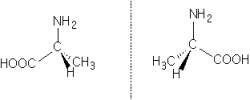
Le carbone asymétrique implique la présence d'isomères ( D et L ) optiquement actifs dont on peut déterminer la filiation optique
A gauche sur la figure précédente, l'isomère D et à droite l'isomère L.
Les acides aminés naturels ( utilisés par l'être vivant ) appartiennent toujours à la série L
3.2 Propriétés générales de l'a.a
- Point de fusion élevé : bien souvent au dessus de la température de décomposition . Pourquoi ? Ce sont des substances polaires ; le travail nécessaire pour fusionner des substances polaires est plus grand que le travail nécessaire pour fusionner des substances non polaires.
- Hydrophobicité
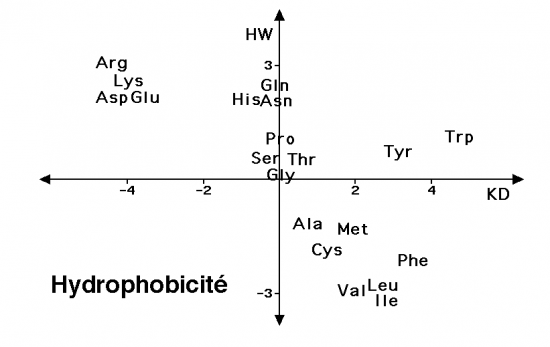
Le caractère hydrophobe ou hydrophile des radicaux des acides aminés qui constituent les protéines repose sur la possibilité pour les atomes de ces radicaux d’échanger des liaisons hydrogène avec l’eau qui entoure la protéine. La cohésion naturelle des molécules d’eau tend à rapprocher les radicaux des acides aminés hydrophobes (« liaison » hydrophobe) et à diminuer la surface de contact entre les domaines hydrophobes de la protéine et l’eau environnante.Pour montrer cette propriété, plusieurs critères ont été mesurés pour chacun des acides aminés constitutifs des protéines : un indice d’hydrophobie (Kyte and Doolittle) en abcisse et un indice d’hydrophilie (Hopp and Wood) en ordonnées.Le graphe obtenu illustre très visiblement les groupes d’acides aminés : aliphatiques, soufrés, neutres, aromatiques, acides ou basiques
.
- Polarité
Le caractère polaire ou apolaire des radicaux des acides aminés qui constituent les protéines est très important pour comprendre la structure et les fonctions de ces radicaux dans les domaines de la protéine et les sites spécifiques qu’ils incluent. L’eau étant un solvant polaire, la polarité des radicaux influence la pénétration des molécules d’eau au sein de la protéine.
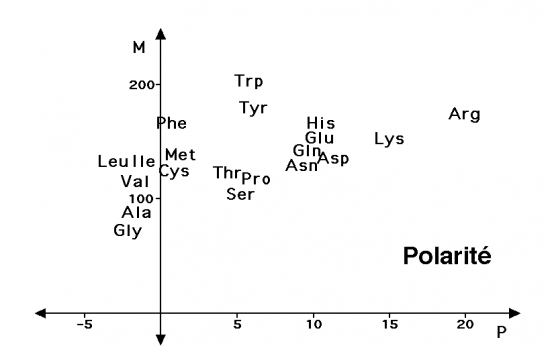
Pour montrer cette propriété, plusieurs critères peuvent être pris en compte pour chacun des acides aminés constitutifs des protéines : un indice de polarité (différence d’énergie libre lors du passage d’un solvant apolaire à un solvant polaire) en abcisse et la masse moléculaire en ordonnées.
Le graphe obtenu range les acides aminés d’une manière toute différente de l’image précédente. L’arginine et la lysine apparaissent comme beaucoup plus polaires que les acides aspartique ou glutamique; le glycocolle et l’alanine dont les radicaux sont apolaires, rejoignent les acides aminés aliphatiques bien qu’ils soient beaucoup moins hydrophobes.
- Charges
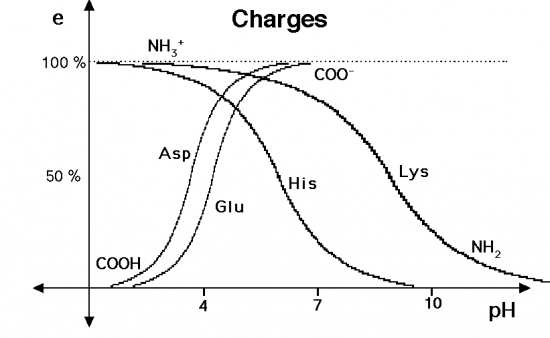
Les fonctions ionisables des radicaux des acides aminés sont d’autant plus protonnées que le milieu est plus riche en ions H+, c’est à dire que le pH est plus faible.
Ainsi les radicaux des acides aspartique et glutamique passent de la forme COOH à pH < 2 à la forme COO- à pH > 7. A pH = 3,7, 50 % des radicaux d’acide aspartique sont protonnés ; c’est le pK de la fonction acide de ce radical. Pour l’acide glutamique, le pK est de 4,25.
De même la fonction amine de la lysine passe de la forme protonnée NH3+ à pH < 2 à la forme NH2 à pH 14. Le pK est de 8,9.
Au pH des compartiments cellulaires (environ pH = 6), beaucoup de fonctions ionisables (Asp, Glu, Lys, Arg) sont porteuses d’une charge, ce qui permet à la protéine de faire des liaisons électrovalentes pour stabiliser sa structure tertiaire ou quaternaire ou pour fixer un ligand.
De même, à pH = 6 le noyau imidazole de l’histidine est à moitié protonné (pK = 5,9) ce qui permet d’échanger plus facilement les hydrogènes dans les réactions chimiques catalysées par les enzymes.
- Spectre d'absorption
Les radicaux aromatiques de certains acides aminés (Phe, Tyr, et surtout Trp) ont la propriété d’absorber la lumière ultra-violette.Sur ce graphe les ordonnées représentent l’absorption de la lumière transmise en fonction des longueurs d’onde représentées en abcisse.L’absorption à 280 nm est due principalement aux noyaux phénols des tyrosines, parce que cet acide aminé est plus fréquent que le tryptophane, qui est pourtant beaucoup plus opaque à cette longueur d’onde.L’absorption de la lumière UV à 280 nm est caractéristique des protéines et sert à doser ces protéines lorsqu’elles sont en solution dans l’eau et qu’il n’existe pas d’autres molécules absorbant la lumière UV à cette longueur d’onde (acides nucléiques par exemple)
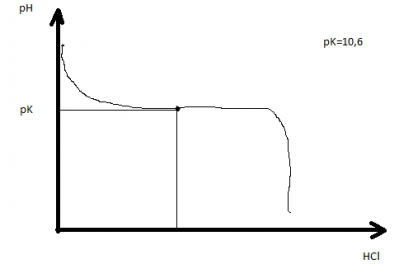
- courbe de titrage
Rappel : titrage de l'acide acétique par la soude ( titrage d'un acide faible par une base forte ).
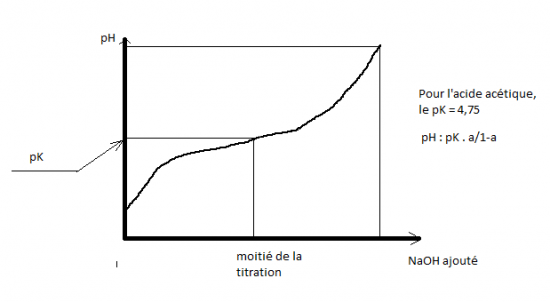 Autre exemple , titration de la phénylalanine par HCl ( titrage d'une base faible par un acide fort )
Autre exemple , titration de la phénylalanine par HCl ( titrage d'une base faible par un acide fort )
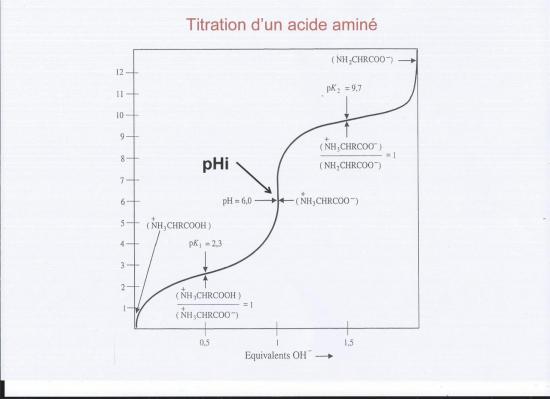
Les acides aminés sont des diacides ( -COOH et NH3+ ), la titration successive de ces deux fonctions acides correspond à deux pK successifs, pK1 = 2,34 ( COOH) et pK2 (NH3+.) = 9,78
Calcul du pKa ( acide faible ) : exemple
L'acide se transforme donc en base conjuguée par perte d'un proton et dans la réaction inverse , la base se transforme en son acide conjugué par fixation d'un proton.
La constante d'équilibre de dissociation du proton dissociation d'un acide est la constante de dissociation acide , désignée par Ka . Pour simplifier les calculs et permettre des comparaisons , on considère les bases sous leur forme protonée . Le Ka d'une base comme l'ammoniac ( NH3 ) fournit une valeur de la force acide de son acide conjugué NH4+ pour l'acide acétique, on a :
Polyacides biologiques
Cas d'un polyacide minéral
Cas d'un polyacide aminé :
- Remarque préalable
- Schéma général de titration d'un acide aminé ( polyacide )
- Les acides aminés sont des Zwitterions
On dispose donc de 3 valeurs pk1, pHi, pK2 pour caractériser les divers acides aminés, on peut y ajouter la nature du groupe R qui peut apporter d'autres pK s'il y a d'autres fonctions acide ou amine et le poids moléculaire.
Rappelons que la valeur du pKa est égale au pH correspondant au point d'inflexion du titrage d'un groupe ionisable , c'est à dire au point auquel la concentration de l'acide faible est égale à celle de sa base conjuguée . Il en résulte que la charge nette des molécules d'Alanine avoisinne + 0,5 à pH 2,4et -0,5 à pH 9,9. A mi-distance des pH 2,4 et 9,9 , soit à pH 6,15 la charge nette moyenne des molécules d'Alanine dissoute est nulle. . Ce pH de 6,15 est le point isoélectrique ( pI) de l'Alanine. A un pH inférieur, l'Alanine porte une charge nette positive ( la forme cationique domine ) . A un pH supérieur à son pI, l'Alanine porterait une charge nette . A son point isoélectrique l'Alanine reste immobile entre les deux électrodes de l'appareil à électrophorèse. Le point isoélectrique d'un acide aminé portant, comme l'Alanine, deux groupes ionisables ( les groupes alpha - aminé et alpha - carboxyle ) est la moyenne arithmétique des valeurs de ses pKa, mais pour un acide à trois groupes ionisables comme l'histidine on doit vérifier la charge nette à chacun des trois pKa pour déterminer correctement le point isoélectrique . L'Histidine porte une charge moyenne de +1,5 à pH 1,8, de + 0,5 à pH 6 et de - 1,5 à pH 9,3. Le point isoélectrique de l'Histidine est donc à mis distance de 6,0 et 9,3 soit 7,65.
Une fois que les acides aminés sont enchaînés l'un à l'autre en liaison peptidique , les pKa de leurs chaînes latérales ionisables ne sont plus identiques à ce qu'ils étaient dans les acides aminés libres. Deux facteurs modifient leurs constantes d'ionisation. D'une part comme les groupes alpha aminés alpha aminés et alpha carboxyle perdent leur charge en formant la liaison peptidique des protéines , ils n'exercent plus leur puissant effect inducteur sur leur chaîne latérale proche . D'autre part la position d'une chaîne latérale ionisable au sein de la structure spatiale d'une protéine peut influencer le pKa de cette chaîne . Ainsi chacune des 4 Histidines de la ribonucléase A , un enzyme , a un pKa légèrement différent de celui des autres, à cause du microenvironnement propre à chacune des Histidines.
3.3 Quelques réactions caractéristiques
Ce sont les propriétés chimiques liées aux fonctions COOH et NH2 qui conditionnent cers réactions
- COOH + NH3 -------> CONHOH, réaction avec Fe3+ ou acide hydroxalique
- COOH + Li BH4 ( réduction du Borohydroxyde de Lithium )----------> alcool correspondant
- COOH + NH2-NH2 ---------->CONH-NH2 ---------> CHN2, azide actif
Des enzymes appelés décarboxylase participent à la même réaction
On a également des réactions de substitution :
Réaction avec le fluorodinitrobenzene
.
3.4 Les 20 acides aminés de base
Il est temps maintenant de voir quelle est la nature de la chaîne latérale des acodes aminés. Après une hydrolyse complète des protéines, on retrouve, quelque soit la protéine de départ : 20 ACIDES AMINES AU MAXIMUM à quelques exceptions près.
La cellule utilise d'autres acides aminés, on en connaît environ 200, mais ils ne se retrouvent pas dans les protéines .
voiçi un tableau reprenant les 20 a.a à pH 7 avec leur noms et leur abréviation à une et à trois lettres, on les a groupé selon la polarité de leur chaîne latérale et on a ensuite classé les chaines polaires en neutre, acide et basique.




Dans la figure précédente on a représenté les 20 acides aminés couramment isolés des protéines, par leur projection de Fischer, Ici, les liaisons horizontales fixées au centre chiral sont dirigées vers l'observateur , les liaisons verticales dans la directioin opposée.Le tableau relève une différence considérable dans les chaines latérales des acides aminés . Certaines sont polaires ou ionisées à pH neutre , donc hydrophiles, d'autres non polaires , donc hydrophobes . Vu qu'ils sont des ions amphotères , les acides aminés libres sont solubles dans l'eau . Cependant on doit bien retenir qu'une fois les acides aminés polymérisés en peptides ou protéines , la charge ionique des groupes amonés alpha et carboxyle alpha entrant en liaison est perdue. Aussi, le caractère ionique , polaire ou non polaire des chaînes latérales est-il prééminent dans la fixation de la structure tridimensionnelle, ou conformation d'une protéine . Les protéines globulaires hydrosolubles , par exemple comportent classiquement des centaines de résidus d'acides aminés serrés en composition compacte. La plupart des chaînes hydrophiles de ce type de de protéines résident à la surface de la protéine et sont en contact avec le milieu extérieur , alors que nombre de chaînes la térales hydrophobes sont enfouies au sein de la protéine et sont inacessibles aux solvant aqueux.
On ne peut saisir le rôle propre de chaque acide aminé dans les protéines sans étudier la structure de chacun d'eux et y associer le code à trois ou à une lettre qui désigne ; Quatre acides aminés, l'alanine (Ala, A), la valine(Val,V), la leucine(Leu, L), et son isomère l'isoleucine(Ile, I) portent une chaîne latérale aliphatique, ici , un hydrocarbure saturé. celle de l'Alanine est un simple groupe méthyle, tandis que celle de la valine, de la Leucine et de l'Isoleucine sont des chaînes aliphatiques ramifiées. Comme les carbones alpha et béta de l'isoleucine sont tous deux asymétriques, cet acide aminé possède deux centres chiraux, donc 4 isomères potentiels : L isoleucine, D isoleucine, L alloisoleucine et D alloisoleucine. Dans les protéines, on ne trouce que l'un des 4 isomères potentiels, la L isoleucine. Bien que dépourvues de groupe fonctionnels , alanine, valine, leucine et isoleucine jouent un rôle important en favorisant et en maintenant fixe la structure tridimensionnelle des protéines , car ces résidus d'acide aminés ont tendance à se regrouper en dehors de la phase aqueuse.
La proline ( Pro, P) diffère nettement des 19 autres acides aminés, car sa chaîne latérale cyclique, un hydrocarbure saturé est liée à la fois à l'azote du groupe aminé α et au carbone α.La proline est donc en fait un acide α iminé puisqu'elle comprend un groupe aminé secondaire te non primaire. Les résidus prolyle des protéines sont cependant tous de configuration L et la chiralité autour de leur carbone α est identique à celle des autres acides aminés . L'hétérocycle pyrrolidine de la proline limite la disposition géométrique des chaînes polypeptidiques , notamment en imposant des changements de direction à la chaine.
La phénylalanine (Phe,F), la tyrosine (Tyr,Y) et le tryptophane (Trp,W) portent des chaînes latérales aromatiques qui absorbent la lumière ultraviolette. A pH neutre , la tyrosine et le tryptophane absorbent tous deux la lumière de 280 nm, mais la phénylalanine n'absorbe pas à 280, mais plutôt à 260nm.Comme la plupart des protéines contiennent de la tyrosine et/ou du tryptophane, on peut estimer leur concentration en mesurant l'absorbance de la solution à 280nm. Il faut noter que la structure de la tyrosine ressemble fort à celle de la phénylalanine. L'hydrogene en para de la phénylalanine a fait grâce à un hydroxyle ( -OH ) dans la tyrosine,devenu ainsi un phénol ( acide très faible , pKa de la chaîne latérale : 10,5 ). En milieu alcalin , la perte du proton phénolique modifie le spectre d'absorption de la tyrosine, faisant passer son maximum de 280 à 296nm. La structure bicyclique de la chaîne latérale est un noyau indole ; on peut donc considérér le tryptophane comme une indole-alanine.
La méthionine (Méth,M),et la cystéine ( Cys,C) coniennent toutes deux du Soufre. La chaîne latérale de la méthionine est constituée d'un groupe méthylthioéther non polaire. Dans la cystéine, un atome de soufre a remplacé l'oxygène de l'hydroxyle de la sérine ; on peut donc considérer la cystéine comme de la thiosérine.D'ailleurs comme les résidus sulfhydrylés( -SH) sont appelés mercaptans , la cystéine est aussi une mercaptoalanine.comme l'atome de soufre de ce groupe sulfhydryle est polarisable.il est réactionnel et peut former des liaisons hydrogènes faibles avec l'oxygène et l'azote.En outre, le groupe sulfhydryle est un acide faible (pKa =8,4) ; il peut donc former un groupe de thiolate, de charge négative. Quand on hydrolyse certaines potéines, on hydrolyse aussi de la cystine dérivé oxydé de deux molécules de cystéine, réunies par un pont disulfure . Ces ponts disulfure jouent un rôle primordial :ils stabilisent la structure dans l'espace de certaines protéines carils réunissent par un pont covalent des résidus cystéine placés ci et là dans la chaîne peptidique.
La glycine (ou glycocolle) est l'acide aminé le plus simple car -R n'est autre qu'un atome d'hydrogène ; le carbone α de l'a.a n'est donc pas chiral et il n'existe pas de glycine L. La glycine joue un rôle particulier dans la conformation de nombreuses protéines, car sa chaîne latérale est si menue qu'elle s'accommode d'espaces d'où sont exclus tous les autres résidus d'acides aminés.
L’aspartate est un acide aminé acide.Le radical de l’acide aspartique est une chaîne de 2 carbones portant une fonction acide carboxylique. Le pK étant de 4,0 cette fonction est presque entièrement ionisée au pH physiologique. L’aspartate joue un rôle important dans certaines protéines comme la pepsine agissant en milieu acide.La charge négative fait de l’aspartate un radical très polaire et hydrophile. Elle crée des liaisons électrovalentes avec des charges électriques positives d’autres acides aminés (Arg, Lys,...), contribuant à la structure tertiaire et quaternaire de la protéine. L’aspartate entre aussi dans la structure de nombreux sites de liaison où il contribue à fixer le ligand par des liaisons électrovalentes.L’aspartate représente environ 6 % des acides aminés des protéines de notre organisme.Certains aliments sont riches en aspartate : pommes de terre, cacahuètes ; d’autres en sont pauvres : soja, pain.
Le glutamate est un acide aminé acide.Le radical de l’acide glutamique est une chaîne de 3 carbones portant une fonction acide carboxylique. Le pK étant de 4,3 cette fonction est presque entièrement ionisée au pH physiologique.La charge négative fait du glutamate un radical très polaire et hydrophile. Elle crée des liaisons électrovalentes avec des charges électriques positives d’autres acides aminés (Arg, Lys,...), contribuant à la structure tertiaire et quaternaire de la protéine. Le glutamate entre aussi dans la structure de nombreux sites de liaison où il contribue à fixer le ligand par des liaisons électrovalentes.Le glutamate représente environ 9 % des acides aminés des protéines de notre organisme. C’est le plus fréquent des 20 acides aminés dans la séquence primaire de nos protéines.
L’asparagine est un acide aminé amidé.Le radical de l’asparagine est constitué d’une chaîne de 2 carbones qui se termine par une fonction acide carboxylique, amidifiée par une molécule d’ammoniaque. Cette amidification cache les propriétés de la fonction acide.A cause des liaisons hydrogène autour de la liaison amide, l’asparagine est un radical faiblement polaire, mais hydrophobe et chimiquement neutre.L’asparagine représente environ 3 % des acides aminés des protéines de notre organisme. Les chaînes latérales bien que non chargées sont très polaires et placées à la surface des protéines, où elles peuvent entrer en contact avec des molécules d'eau, comme la glutamine d'ailleurs
La glutamine . Le radical de la glutamine est constitué d’une chaîne de 3 carbones qui se termine par une fonction acide carboxylique, amidifiée par une molécule d’ammoniaque. Cette amidification cache les propriétés de la fonction acide. A cause des liaisons hydrogène autour de la liaison amide, la glutamine est un radical faiblement polaire, mais hydrophobe et chimiquement neutre.La glutamine représente environ 9 % des acides aminés des protéines de notre organisme.La glutamine est aussi le plus abondant des acides aminés libres en circulation dans le sang.Les groupes amides polaires de la glutamine comme l'asparagine peuvent former des liaisons hydrogène avec les atomes des chaînes latérales d'autres acides aminés.
La sérine et la thréonine . La sérine est un acide aminé alcool.Le radical de la sérine comprend un seul carbone porteur d’une fonction alcool primaire.Cette fonction alcool rend la sérine faiblement hydrophile, mais surtout permet des estérifications avec l’acide phosphorique, importantes dans la régulation de l’activité des protéines.La sérine représente environ 4 % des acides aminés des protéines de notre organisme.La thréonine est un acide aminé alcool.Le radical de la thréonine comprend 2 carbones dont le premier est porteur d’une fonction alcool secondaire. Ce radical est donc asymétrique. Cette fonction alcool permet des estérifications.La thréonine représente environ 4 % des acides aminés des protéines de notre organisme.Certains aliments sont riches en thréonine : œufs ; d’autres en sont pauvres : pain, haricots verts, oléagineux.Bien que le pKa du groupe hydroxyméthyl de la sérine ( CH2OH) ne soit pas mesurable en solution aqueuse , cet alcool est réactionnel lorsqu'il se trouve au site actif de nombreux enzymes , comme s'il était ionisé.
Lysine, arginine, histidine
La lysine est un acide aminé basique.Le radical comporte une chaîne de 4 carbones suivie d’un fonction amine, dont un électron ionisé crée une charge positive.Le radical de la lysine est très basique (pK = 10,8) ce qui lui confère une charge positive stable. De ce fait, le radical de la lysine est très polaire et très hydrophile. Cette charge positive crée des liaisons électrovalentes avec des charges électriques négatives d’autres acides aminés (Asp, Glu,...), contribuant à la structure tertiaire et quaternaire de la protéine. L’arginine entre aussi dans la structure de nombreux sites de liaison où elle contribue à fixer le ligand par des liaisons électrovalentes.La lysine représente environ 8 % des acides aminés des protéines de notre organisme.Certains aliments sont riches en lysine : viande, abats ; d’autres en sont pauvres : pain, oléagineux.
L’arginine est un acide aminé basique.Le radical comporte une chaîne de 3 carbones suivie d’un noyau guanidinium : un atome de carbone entouré de trois fonctions amine. Un électron ionisé crée une charge positive dans le noyau guanidinium, délocalisée dans les orbitales des trois liaisons C-N.Le noyau guanidinium est très basique (pK = 12,5) ce qui confère une charge positive immuable à ce radical. De ce fait, le radical de l’arginine est le plus polaire et le plus hydrophile des tous les radicaux d’acides aminés des protéines. Cette charge positive crée des liaisons électrovalentes avec des charges électriques négatives d’autres acides aminés (Asp, Glu,...), contribuant à la structure tertiaire et quaternaire de la protéine. L’arginine entre aussi dans la structure de nombreux sites de liaison où elle contribue à fixer le ligand par des liaisons électrovalentes.L’arginine représente environ 7 % des acides aminés des protéines de notre organisme.Certains aliments sont riches en arginine : noix, noisettes, riz ; d’autres en sont pauvres : betteraves, carottes, pain.
L’histidine est un acide aminé basique.Le radical de l’histidine comprend un carbone et un noyau imidazole formé de trois carbones et de deux azotes. Ce noyau est ionisable et le pK est de 6,0, ce qui est très voisin des pH habituels des compartiments cellulaires. Le noyau imidazole est polaire mais peu hydrophile.Les échanges d’hydrogène avec le noyau imidazole se faisant facilement au pH physiologique, l’histidine est un radical fréquent dans les sites catalytiques des enzymes.L’histidine représente environ 3 % des acides aminés des protéines de notre organisme. Certains aliments sont riches en histidine : viande, abats ; d’autres en sont pauvres : chou-fleur.
3.5 Dans les protéines, les acides aminés sont liés entre eux par des liaisons peptidiques
Dans une chaîne peptidique, les acides aminés sont unis par condensation du groupe alpha-carboxyle d'un acide aminé avec le groupe alpha-aminé d'un autre acide aminé , la liaison résultante est une liaison amide secondaire appelée liaison peptidique. Une molécule d'eau est formée dans la condensation de deux acides aminés.

3.5 La liaison peptidique
Les acides aminés peuvent se lier les uns aux autres par une liaison peptidique. La liaison peptidique se fait entre le groupement acide (COOH) d'un acide aminé et le groupement amine (NH2) de l'autre. Au cours de la réaction, une molécule d'eau est éliminée. Il s'agit donc d'une réaction de condensation.
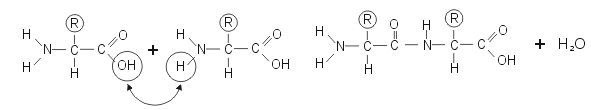
Contrairement aux groupes aminés et carboxyle des acides aminés libres en solution , ces groupes, une fois enchaînés dans la liaison peptidique, ont perdu leur charge ionique.
Les restes d'acides aminés portent le nom de résidus d'acides aminés. On les note dans la chaîne polypeptidique en remplaçant les désinences "ine" ou "ate" en "yle". Le résidu de la glycine dans un polypeptide s'appelle résidu "glycile", celui du glutamate , résidu glutamyle, pour l'asparagine , la glutamine et la cystéine , le nom des résidus s'obtient en ajoutant la désinence "yle" , soit asparagynile , glutaminyle, cystéinyle, respectivement. Cette désinence "yle" rapelle que le résidu concerné est une unité acyle ( groupe qui a perdu l'hydroxyle du groupe carboxyle)
Les groupes libres, aminé et carboxyle, aux extrémitésopposées d'une chaîne peptidique sont respectivement le groupe N-terminal (aminé terminal ) et le groupe C-terminal (carboxyle terminal. A pH neutre , chaque extrémité porte une charge . On a convenu de numéroter les acides aminésd'une chaîne peptidique en allant de l'extrémité N-terminale à l'extrémité C - terminale et de l'écrire de gauche à droite.
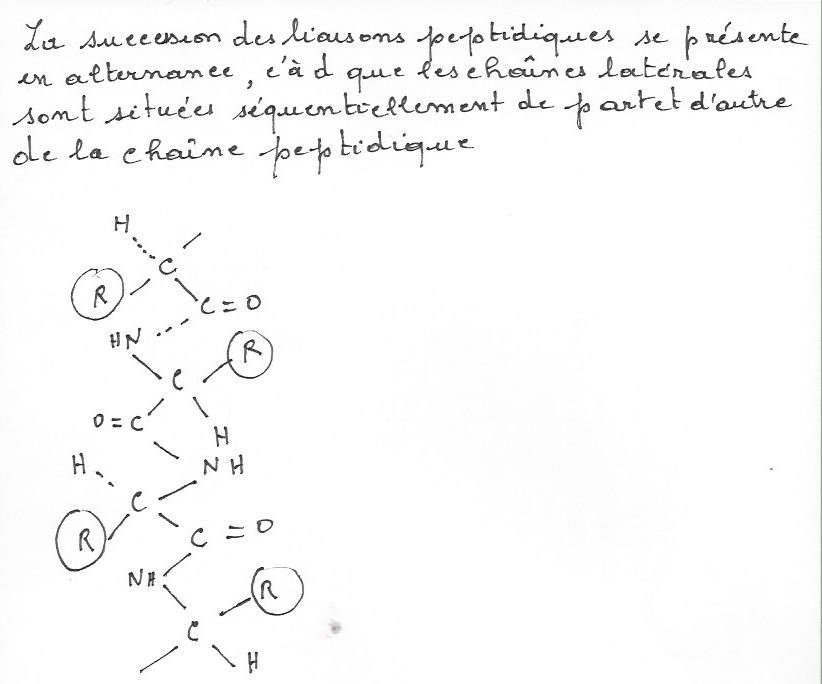
La structure primaire d'une protéine est la suite linéaire des résidus d'acide aminéliés par des liaisons peptidiques . Il est utile de retenir les abréviations à trois lettres et à une lettre du nom des acides aminés , car elles sont employées couramment pour désigner une structure primaire ( par exemple ( Gly-Arg-Phé-Ala-Lys ou GRFAK). Les termes dipeptides, tripeptide, oligopeptide et polypeptide se rapportent à des chaînes de, respectivement,deux,trois,plusieurs ( environ 20 ) ou un grand nombre ( plus de 20 ) de résidus d'acide aminé.Il faut noter qu'un dipeptide contient une, un tripeptide deuxet un pentapeptide quatre liaisons peptidiques et ainsi de suite.En général, toute chaine peptidique contient , quelque soit sa longueur , un ngroupe alpha-aminé et un groupe alpha-carboxyle libres ( font exeptions les résidus terminaux modifiés par covalence et les peptides cycliques ). Presque toutes les charges ioniques portées par une molécule protéique proviennent des chaines latérales de ses acides aminés.Il en résulte que les propriétés ioniques d'une protéine , ainsi que sa solubilité , dépendent de sa composition en acides aminés . Nous verrons encore, comment les interractions entre chaînes latérales contribuent à stabiliser la structure dans l'espace d'une molécule de protéine.
Un des domaines actifs de la recherche sur les protéines concerne la biochimie des neuropeptides, notamment des endorphines, des analgésiques naturels. On emploie de très petits peptides comme adjuvants alimentaires ; les boissons diététiques contiennent souvent une substance sucrée, l'aspartame qui est l'ester méthylique de l'aspartylphénilalanine . On a utilisé d'autres dipeptides dans le but d'en découvrir un qui pourrait remplacer le sel chez les patients contraints à une restriction du Chlorure sodique.
4 Méthodes pour purifier les protéines
L'étude d'une protéine donnée exige qu'on la sépare des autres constituants cellulaires,, parmi lesquels se trouvent d'autres protéines qui ont des propriétés assez proches . Lers étapes de purification varient d'une protéine à l'autre, mais font appel à des techniques biochimiques similaires qui se basent sur des petites différences de solubilité , de charge nette, de taille et de spécifité de liaison. Passons en revue quelques méthodes courantes de purification des protéines, menées à basse température, entre 0 et 4°C, de façon à réduire au minimum la dégradation des protéines par les protéinases ( enzymes qui coupent les liaisons peptidiques. et la dénaturation des protéines ( beaucoup sont thermosensibles ).
Pour purifier une protéine, on commence par la mettre en solution. On part en général de cellules isolées ou de tissus entiers dans lesquels la protéine désirée représente parfois moins de 0,1 du pods sec total . Quand il s'agit d'une protéine intracellulaire , on doit suspendre et homogénéiser les cellules séparées ou le tissus dans un tampon , ou les désagréger en fragments cellulaires , soit mécaniquement, soit chimiquement, soit encore à l'aide d'enzymes. On élimine ensuite les gros débris cellulaires , souvent en les retenant sur une étamine , puis on sépare les fragments subcellulaires par centrifugation , une technique qui met à profit leur différence de masse ou de densité . Pour obtenir des protéines appartenant aux organites on isole ceux-ci puis on les désagrège , d'habitude dans une solution de détergent tamponnée. La majeure partie des protéines d'une fraction cellulaire homogénéisée se dissolvent dans le tampon d'homogénéisation . Supposons que la protéine désirée soit l'un des nombreux types protéiques dissous dans cet extrait tamponné
L'étape suivante de la purification consiste souvent à fractionner grossièrement le mélange en profitant de la différence de solubilité des protéines selon la concentration saline . Pour ce fractionnement par les sels , on choisit très souvent le sulfate d'ammonium , qui stabilise la structure protéique . A la solution de protéine , on ajoute d'abord una quantité adéquate de sulfate ammonique pour précipiter les impuretés , les moins solubles , qu'on élimine ensuite par centrifugation . Au surnageant qui , qui conserve la protéine à purifier, on ajoute la quantité de sulfate ammonique suffisante pour précipiter cette protéine . On centrifuge ce mélange , on élimine le surnageant et on redissous le précipité dans le plus petit volume possible de tampon.Ce fractionnement au sulfate ammonique. Ce fractionnement au sulfate ammonique aboutit en pratique à une purification d'un facteur 2 ou 3 ( Autrement dit on s'est débarassé de la moitié ou des deux tiers des contaminants ). Malgré la modicité de cette purification , la méthode permet de concentrer la protéine désirée et de réduire le volume destiné à la chromatographie sur colonne, on change de solvant par dialyse , pour éliminer le sulfate ammonique et introduire un solvant dont la composition convient à la chromatographie . Pour dialyser la solution de protéine, , on l'introduit dans un sac à dialyse fermé , constitué d'une membrane semi-perméable qu'on suspend et agite dans un grans volume de solution tampon. Le sac est constitué d'un tube de cellophane noué aux deux bouts . A cause de leur poids moléculaire élevé, les protéines restent à l'intérieur du sac et leur solvant original s'échange progressivement contre celui dans lequel on a suspendu le sac à dialyse.On fractionne ensuite le mélange de protéine par chromatographie sur colonne . On remplit un tube cylindrique d'une matrice insoluble , souvent constituée de fibres de cellulose ou de billes de résine synthétique. On dépose un certain volume du mélange de protéines à la surface de la colonne et on imprègne la colonne par addition du solvant approprié . Pendant que le solvant parcourt la colonne, on récupère l'effluent du bas de la colonne ( l'éluat ) dans une série de tubes ( contenant les fractions , dont un exemplaire est schématisé dans la figure qui suit. La vitesse de déplacement de la protéine dans la matrice dépend d'interactions entre cette dernière et la protéine . Dans une colonne donnée les protéines seront éluées à une vitesse différente selon leur nature. On détermine la concentration en protéine de chaque fraction en mesurant en mesurant l'absorbance spectrophotométrique à 280 nm. C'est la Tyrosine et le Tryptophane qui absorbe la lumière de 280nm. Pour retrouver la protéine désirée , on cherche ensuite une série d'activités biologiques dans les fractions riches en protéine . . .
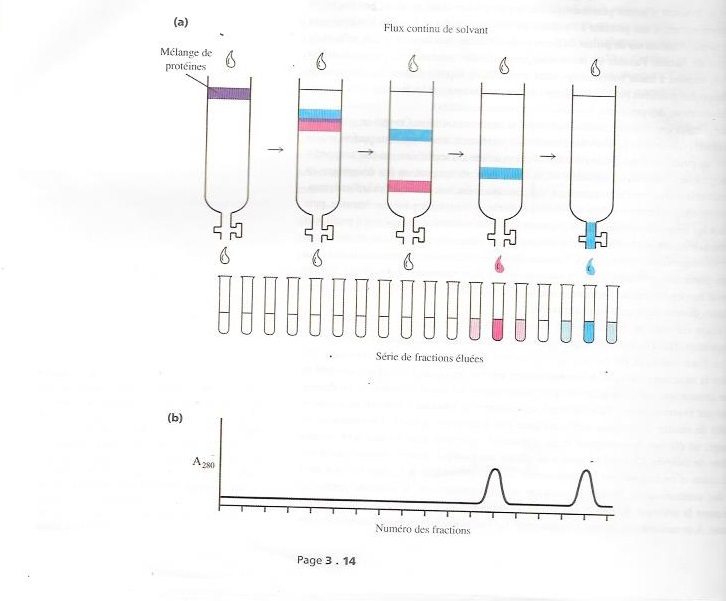
 On classe les colonnes de chromatographie selon le type de matrice qu'elles contiennent.
On classe les colonnes de chromatographie selon le type de matrice qu'elles contiennent.
Dans la chromatographie par échange d'ions , la matrice est constituée de billes ou de fibres couvertes de charges positives ( résine échangeuse d'anions ) ou négatives ( résine échangeuse de cations).. Les échangeurs d'anions fixent les protéines chargées négativement et les retiennent dans la colonne jusqu'à leur éluation subséquente ; les échangeurs de cations capturent les protéines contenant des charges positives. On peut ensuite éluer une à une les protéines retenues en augmentant la concentration en sels du solvant , car les ions de même signe que les protéines retenues entrent en compétition avec ces dernières pour se fixer à la matrice.
La chromatographie de filtration à travers un gel de billes poreuses sépare les protéines selon leur poids moléculaire . Les protéines moins volumineuses que le diamètre moyen des pores du gel pénètrent la plus grande partie du volume des billes et sont par conséquent retardées par la matrice ; une protéine est d'autant plus retardée que sa taille est réduite . Les protéines de grande taille n'ont pas accès aux pores du gel et sont éluées les premières . Vu que les protéines se séparent ici d'après leur taille , la filtration sur gel s'appelle aussi exclusion moléculaire. On doit choisir la taille des pores du gel de filtration selon le poids moléculaire de la protéine à purifier.
La chromatographie d'affinité , le type le plus sélectif de séparation sur colonne repose sur les interactions entre une protéine et son ligand . Un ligand est une molécule, un groupe, un ion ou un atome , qui se lie d'habitude sans lien covalent , à une autre molécule ou a un autre atome . Pour effectuer une chromatographie d'affinité , on attache le ligand à la matrice par covalence . Le ligand peut être le réactif ou le produit auquel un enzyme se lie in vivo ou bien un anticorp qui fixe une protéine à purifier. Pendant que le mélange de protéines traverse la colonne , la protéine cible est la seule des espèce protéiques à se lier spécifiquement à la matrice . On rince ensuite cette dernière de façon répétée avec le tampon qui avait servi à dissoudre l'échantillon protéique de départ de manière à éliminer toutes les protéines retenues non spécifiquement dans la colonne On élue ensuite la protéine désirée en faisant passer dans la colonne un solvant très riche en ligand libre ou parfois une solution saline concentrée. A elle seule, une chromatographie d'affinité arrive parfois d'un coup à purifier une protéine de 1000 à 10000.
La mise au point de la chromatographie liquide à haute pression (HPLC) a notablement amélioré la résolution des colonnes de chromatographie . En HLPC, la matrice consiste en billes plus petites , de taille plus homogène et mieux tassées que les billes des colonnes conventionnelles . Une pompe à haute pression ( quelques centaines de kg.cm-2) , injecte dans une colonne à haute résistance , le mélange de protéines en solution . Bien que vitesse de séparation,, résolution et sensibilité soient fortement augmentées dans le HLPLC , la séparation n'en est pas moins basée sur les principes même de la chromatographie par échange d'ions , ou de la chromatographie par filtration sur gel ou de la chromatographie d'affinité.
L'électrophorèse sépare les protéines d'après leur vitesse de migration dans un champélectrique. Pour réaliser une électrophorèse en gel de polyacrylamide ( PAGE), on dépose les échantillons de protéines sur une matrice de gel très réticulé et on y applique un champ électrique. La matrice du gel baigne dans un tampon un peu alcalin, de sorte que les protéines y sont présentes sous forme d'anions et migrent vers l'anode. Généralement, on fait courir parallèlement plusieurs échantillons inconnus , encadrés d'un échantillon de calibrage . La matrice du gel ralentit les grandes molécules , pendant leur migration dans le champ électrique ; aussi, les protéines se séparent-elles iici, à la fois selon leur charge et selon leur masse.
5. Classification des protéines
Selon leur composition, les proteines sont divisées en deux grandes classes
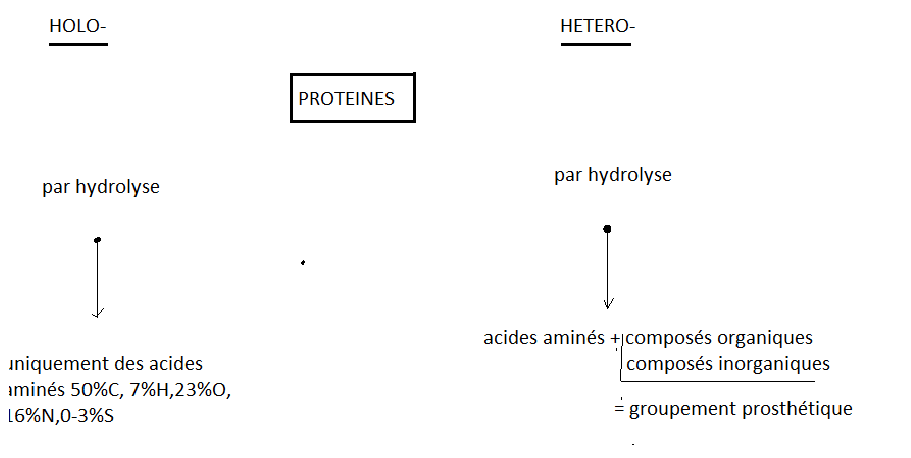 Les hétéroprotéines peuvent être classées selon la nature de leur groupement prosthétique
Les hétéroprotéines peuvent être classées selon la nature de leur groupement prosthétique
| NUCLEOPROTEINES | dans les ribosomes | RNA |
| LIPOPROTEINES | dans le plasma, transporteurs de lipides | phospolipides, cholestéraol, lipides mixtes |
| GLYCOPROTEINES | dans le plasma : gammaglobulines | Acide sialique |
| PHOSPHOPROTEINES | caséine du lait | phosphate, PO43- |
| HEMOPROTEINES | hémoglobine, cytochrome | protoporphyrine ferrique ( 4 cycles thiazole ...) |
| FLAVOPROTEINES |
succinate déshydrogénase
|
flavine - adénine - dinucléotide |
| METALLOPROTEINES | tyrosine oxydase, alcool déshydrogénase, xanthine oxydase | Fe((OH)3,Cu, Zn, Mo et Fe |
Chaque molécule protéique a sous son état natif une forme tridimensionnelle , caractéristique que l'on désigne sous le terme CONFORMATION. Les protéines peuvent être ( à nouveau ) séparées en deux grandes classes selon leur conformation :
LES PROTEINES FIBREUSES ( de structure ) : ces protéines sont physiquement assez résistantes , elles constituent un matériel insoluble dans l'eau et les solutions salines diluées.. Elles sont constituées de chaînes polypeptidiques rangées parallèlement le long d'un axe pour former de longues fibres. Les protéines fibreuses forment les structures élémentaires du tissus conjonctif des organismes supérieurs , tels le collagène des tendons, lka kératine - alpha des cheveux , de la corne, du cuir, des ongles et des plumes et l'élastine du tissus élastique (ligament), myosine. .
LES PROTEINES GLOBULAIRES ( protéines fonctionnelles ( enzymes) - thermosensibles ) : ces porotéines sont constituées de chaînes polypeptidiques étroitement repliées en des formes compactes, sphériques ou globulaires. La plupart des protéines globulaires sont solubles dans les systèmes aqueux et diffusent dans la cellule . Elles interviennent dans le métabolisme cellulaire.. Ainsi pour les 2000 enzymes connues à ce jour, presque toutes sont des protéines globulaires , comme le sont les anticorps, les hormones protéiques et les protéines de transport comme l'hémoglobine.. Un certain nombre ( pas très élevé ) de protéines se situe entre les types fibreux et globulaire. Citons la myosine, protéine importante de la cellule musculaire et le fibrinogène précurseur de la fibrine intervenant dans la formation du caillot sanguin lors de la coagulation.
La terminologie particulière utilisée pour désigner les différents niveaux de structure protéique s'établit comme suit :
- STRUCTURE PRIMAIRE : désignant la séquence des acides aminés dans la chaîne polypeptidique
- STRUCTURE SECONDAIRE : désignant la disposition de la chaîne polypeptidique dans un plan
La structure secondaire décrit le repliement local de la chaîne principale d'une protéine. L'existence de structures secondaires vient du fait que les repliements énergétiquement favorables de la chaîne peptidique sont limités et que seules certaines conformations sont possibles. Ainsi, une protéine peut être décrite par une séquence d'acides aminés mais aussi par un enchaînement d'éléments de structure secondaire.
La structure secondaire est engendrée par la rotation des atomes de la chaîne peptidique les uns par rapport aux autres au cours de la synthèse de la chaîne. Les angles possibles et les structures qu’ils engendrent le plus souvent sont représentés sur la table de Ramachandran.
La structure secondaire la plus fréquente est l’hélice α qui fait tourner la chaîne carbonée par rapport à elle-même d’un tour tous les 4 acides aminés environ. Elle est stabilisée par des liaisons hydrogènes entre le carbonyl de la liaison peptidique qui suit l’acide aminé n° 1 avec l’amine de la liaison peptidique qui précède l’acide aminé n° 5, puis de même entre les acides aminés 2 et 6, etc...
Il arrive aussi très souvent que plusieurs portions de chaînes se joignent bord à bord et en sens opposé (antiparallèles) pour former un feuillet où les carbonyles de chaque acide aminé d’une portion de chaîne se lient avec les amines de l’autre portion.
Dans les protéines fibrillaires (collagène, kératine, fibroïne,...) on trouve d’autres types d’hélices, qui sont souvent enroulées les unes autour des autres en super-hélices, etc
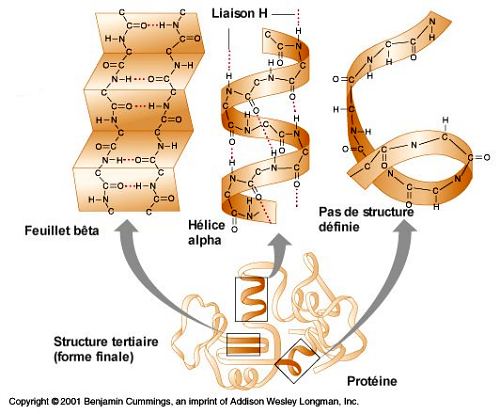
-STRUCTURE TERTIAIRE :désigne la façon dont les chaînes polypeptidiques sont enroulées ou courbées dans les trois dimensions pour former ( par ex ) des structures compactes de protéines globulaires.
La structure tertiaire est le résultat de liaisons diverses (hydrogène, hydrophobes, électrostatiques, covalentes,...) entre des acides aminés de la même chaîne peptidique mais non voisins dans la structure primaire.
Les liaisons de la structure tertiaire sont plus ou moins stables : il y a des liaisons faibles de type liaisons hydrogène ou liaisons hydrophobes.
Les liaisons électrostatiques sont dues aux charges électriques des radicaux des acides aminés. Ces charges sont dépendantes du pH. Les acides forts ou les bases fortes dissocient les liaisons électrostatiques de la structure tertiaire entraînant la dénaturation de la protéine.
Des liaisons covalentes enfin établissent des liaisons de forte énergie entre les acides aminés : pont disulfure entre deux cystéines. Dans les protéines fibrillaires on trouve aussi des liaisons covalentes entre des dérivés des radicaux de lysine : lysino-norleucine, desmosine. Les agents oxydants ou réducteurs forts peuvent aussi dénaturer les protéines en oxydant des cystéines ou en réduisant les ponts disulfures.
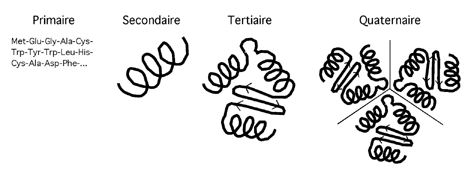
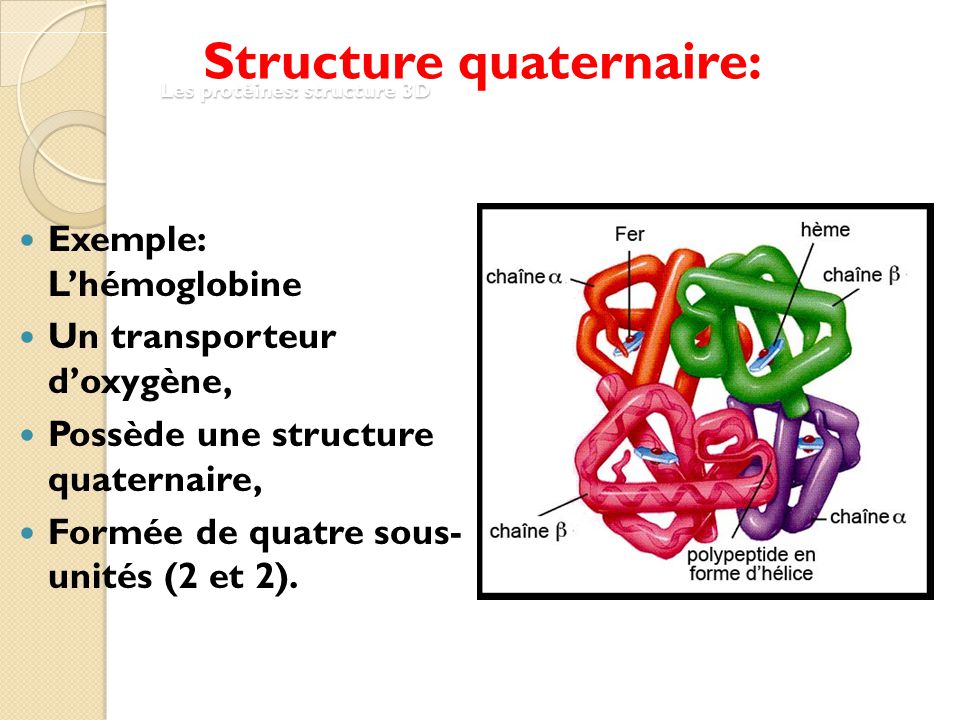
STRUCTURE QUATERNAIRE : désigne l'arrangement et le regroupement dans l'espace des chaînes polypeptidiques des protéines possédant plusieurs chaînes. La plupart des protéines de grande taille , fibreuses ou globulaires contiennent deux ou plusieurs chaînes entre lesquelles il n'existe pas obligatoirement de liaisons covalentes.
La structure quaternaire est le résultat de liaisons diverses (hydrogène, hydrophobes, électrovalentes, covalentes,...) entre des acides aminés de chaînes peptidiques différentes mais qui sont unies en une seule molécule.
Les liaisons de la structure quaternaire sont les mêmes que celles de la structure tertiaire. Les agents dénaturants les détruisent de la même façon.
Lorsqu’une protéine est constituée de plusieurs protomères, les liaisons de la structure quaternaire exercent d’un protomère à un autre un effet de contrainte qui modifie la structure et donc les propriétés fonctionnelles de l’autre protomère : c’est le fondement de nombreux phénomènes cellulaires : transduction du signal, allostérie, mouvements cellulaires,...
Le terme général de CONFORMATION est souvent utilisé pour désigner l'ensemble des structures secondaire, tertiaire et quaternaire des protéines .
Les protéines ayant deux ou plusieurs chaînes polypeptidiques sont appelées protéines OLIGOMERIQUES, leurs chaînes constitutives sont appelées SOUS-UNITES ou PROTOMERES
Exemple : l'hémoglobine - 4 chaînes polypeptidiques ( 2 alpha + 2 bêta )) étroitement liées (sans liaison covalente) pour former un assemblage compact, globulaire et stable
Parfois un ensemble de molécules protéiques fonctionnant conjopintement apparaît dans la cellule , qui peut être isolé sous forme homogène voire cristalline , il s'agit alors d'un complexe ou assemblage supramoléculalire .
Exemples :
Complexe de 7 enzymes différents nécessaires à la synthèse des acides gras ( acide gras synthétase )
Virus de la mosaïque du tabac, assemblage d'un poids moléculaire de 40.106 (2800 chaînes protéiques ).
La plupart des molécules protéiques ne conservent leur activité biologique que dans des limites de température et de pH, la plupart des protéines sont dénaturées quand elles sont chauffées au dessus de 50°C, quelques unes sont également dénaturées en dessous de 15°C. Le phénomène de dénaturation peut être réversible soit irréversible sera fréquemment une diminution de la solubilité avec retour à sa normale lorsque la condition dénaturante n'est plus présente . L'exemple typique d'une dénaturation irréversible par altération de la solubilité par chauffage est la coagulation du blanc d'oeuf ( ovalbumine )..
La possibilité de retrouver après dénaturation une protéine fonctionnelle indique que c'est la séquence en acides aminés ( structure primaire ) d'une chgaîne polypeptidique qui contient l'information nécessaire pour lui imposer sa conformation native et que cette conformation native détermine en fin de compte son activité biologique .
...
Date de dernière mise à jour : 27/12/2016
Commentaires
-

1 Raina Le 28/03/2018
Way cool! Some extremely valid points! I appreciate you writing this article and the rest of the website is extremely good.
Ajouter un commentaire