- Accueil
- E. Chimie
- VI .Biochimie
- I.Biochimie structurelle COMPLET
- I.Biochimie structurelle.1
I.Biochimie structurelle.1
BIOCHIMIE STRUCTURELLE
On trouvera dans les organismes des composés minéraux et des composés organiques
I. COMPOSES MINERAUX
Sous forme de sels insolubles et solubles
I.1 Sels insolubles
Essentiellement des sels de Calcium , constituants fondamentaux du squelette des Vertébrés :
{(Ca3(PO4)2}3.X2 Ca ( X : Halogène , OH -)
apatite
Chez les Invertébrés ( coquillages, infusoires ), un sel insoluble,la silice SiO2 .
On trouve également de la silice dans l’écorce de chêne ( 4 % du poids sec ) , dans la paille ( 2%)
I.2 Sels solubles
- CATIONS :
-
Na++, K+, Ca++, Mg++
Les quantités de sodium et de potassium sont variables selon l’origine :
- Dans le règne animal Na++ > K+
-
Dans le règne végétal Na++ < K+
Quantité de Na++ et de K+
Sang humain : 248 20
peau humaine : 222 135
Epinards : 343
Haricots : 2,4
De même, chez les animaux : Ca++ > Mg++
chez les végétaux : Mg++ > Ca++
- ANIONS :
- CO32- , HCO3- , H2PO4- , HPO42- , PO43- (Pi) , les proportions de ces anions vont dépendre du pH , ils ont un rôle tampon
- Cl- associé au Na+ et au K+
D’autres ions ont été identifiés
- NO3- , NO2-, SO32- , SO42-
- Au cours des fermentations : NH4+
- Dans la salive l’ion sulfocyanique : SCN-
I.3 L’eau
I.3.1 Aspect quantitatif
C’est le composé le plus important sur le plan quantitatif,non seulement des composés minéraux,mais aussi des constituants de la matière vivante.
Quelques cas :
Méduse : 97-98 % H2O
Homme : +/- 60% comme la plupart des vertébrés
grain( blé) , pois, fève : +/- 10% , associée aux structures : après hydratation à température ordinaire, on retrouve les manifestations de la vie croissance, différenciation,reproduction,... ). Ce seul exemple prouve que l’eau est un des constituants des plus importants pour la vie.
Variation de la teneur en eau dans les organes humains
humeur vitrée : 99 % poumon : 79 % émail dentaire : 0,2 % testicule : 86 % intestin : 77 % rein : 83 % muscle : 76 % coeur : 79 % cartilage : 55 % .........
Dans les tissus fonctionnels : 75 à 85 % eau
sang : 79 % dent : 10 %
Variation suivant l’âge
Foetus humain de 3 mois : 94%
adulte : 60 %
à la naissance : 66%
vieillard de 80 ans : 57 %
L’eau contenue dans les organismes n’est pas "stagnante", elle se renouvelle constamment, comme d’ailleurs la majorité des autres substances biologiques.
Les apports d’eau : les boissons, les aliments, la respiration.
Les départs d’eau : la respiration, la transpiration,l’excrétion.
I.3.2 Turn-over de l’eau :
Quantité d’eau qui se renouvelle par jour. Des calculs basés sur une expérimentation d’échange isotopique sur le corps humain ont permis d’apprécier le renouvellement à 35 g H2O / kg / jour . La fréquence de renouvellement en termes moléculaires est égale à 1016 molécules/gr/sec.
1.3.3 Les caractéristiques physiques et chimiques de l'eau
1.3.3.1 STRUCTURE CHIMIQUE ET POLARITE
- la structure électronique de l'atome d'O : 6 électrons périphériques ( 1s22s22p4), de l'atome d'H : 1 électron périphérique (1s1)
Liaison par remplissage de l'orbitale de l'atome d'O
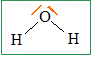
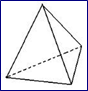
Les liaisons entre 2H et O donnent naissance à un molécule d'H2O de structure spatiale tétraédrique
En effet , entre l'hydrogène et l'oxygène dans H2O, on s'attendrait à une liaison sp entre l'orbitale 1s de l'hydrogène et une orbitale 2p de l'oxygène ;
• ainsi, l'angle formé entre les deux liaisons covalentes O-H serait de 90° ;
• or l'angle formé est de 104.5°. Il y a donc une hybridation 2s -2p dans l'oxygène pour former 4 nouvelles orbitales hybrides sp3;
• comme la couche électronique comporte 6 électrons, deux d'entre eux forment les liaisons covalentes avec les 2 atomes d'hydrogène, alors que chacune des deux autres orbitales porte un doublet d'électrons non liants.
La molécule d'eau se présente donc comme un tétraèdre dont l'atome d'oxygène occupe presque le centre (s'il occupait le centre, l'angle entre les deux liaisons O-H serait de 109.5°).
figure: structure tétraédrique
Les propriétés électroniques et géométriques de la molécule d'eau ont une conséquence importante: dans la liaison covalente O-H, l'oxygène, qui est plus électronégatif que l'hydrogène, attire davantage les électrons et il se crée ainsi une disymétrie dans la distribution des charges.
Celle-ci peut schématiquement se représenter par deux charges ponctuelles positives à l'endroit des atomes d'hydrogène et deux charges négatives correspondant aux deux orbitales non liantes,compte tenu de la géométrie particulière , ceci crée un dipôle permanent au sein de la molécule d'eau.
Il s'ensuit que l'eau, bien qu'électriquement neutre, possède un moment dipolaire important (1.8 Debye = 6.1 10-30 coulomb.m).
1.3.3.2 LIAISONS HYDROGENE
Par sa polarité permanente, la molécule d'eau exerce une attraction sur les molécules d'eau environnantes.
L'attraction entre l'un des atomes d'hydrogène, légèrement positif , d'une molécule et l'atome d'oxygène, légèrement négatif, d'une autre molécule forme une liaison hydrogène , cette liaison est de nature électrostatique.
Dans une liaison hydrogène entre deux molécules d'eau, l'atome d'hydrogène reste lié par covalence a son atome d'oxygène et une distance presque double le sépare de l'atome d'oxygène qui est içi son atome accepteur. ( liaison hydrogène 0,177 nm, liaison covalente 0,099 nm )
Une molécule d'eau peut " contracter" quatre liaisons hydrogène avec ses molécules d'eau voisines
figure 8 : liaisons hydrogène de l'eau.
L'eau a donc tendance à former des polymères, l'ammoniac et l'acide fluorhydrique forment également des polymères, mais ceux - ci ne sont pas linéaires comme dans le cas de l'eau, ce qui interdit une polymérisation quasi infinie comme dans le cas de l'eau
Les liaisons hydrogène sont beaucoup moins solides que les liaison covalentes typiques.
Ainsi, l'énergie requise pour de la liaison hydrogène est de l'ordre de 3 à 6 kcal/mol, celle nécessaire à la rupture de la liaison covalente O-H s'élève à près de 110 kcal/mol.
L'existence de ces liaisons hydrogène ont diverses conséquences sur les propriétés physiques de l'eau :
a) Chaleur spécifique
Rappelons tout d'abord que la température mesure l'énergie cinétique moyenne des molécules d'un corps et exprime la tendance de la chaleur à s'échapper de ce corps. La chaleur représente le transfert d'énergie qui s'établit quand deux corps de températures différentes sont mis en contact. Les molécules du corps froid accélèrent leur vitesse au détriment de l'énergie cinétique des molécules du corps chaud.
Ainsi, la chaleur spécifique d'un corps est la quantité de chaleur, donc l'énergie, nécessaire pour élever de 1°C la température d'1 gramme de cette substance. L'eau a une chaleur spécifique de 4.2 J.g-1.°C-1, ce qui est une valeur tout particulièrement élévée (à titre de comparaison, l'éthanol des boissons alcoolisées a une chaleur spécifique de 2.5 J.g-1.°C-1).
La conséquence de cette propriété majeure de l'eau est de stabiliser la température. Ainsi les climats varient moins lorsque l'eau absorbe ou au contraire dégage une certaine quantité de chaleur. En se réchauffant de quelques degrés seulement les océans emmagasinent une quantité colossale de chaleur, et inversement.
Ce phénomène permet non seulement d'amortir les variations de températures mais également de maintenir par là-même des conditions de température favorables au développement de la vie. Au niveau de la cellule, il en va de même et celà est d'autant plus important que la plupart des réactions biochimiques dépendent de la température.
La raison de ce phénomène est la multiplicité des liaisons hydrogènes qui doivent être préalablement rompues pour que l'énergie cinétique des molécules puisse augmenter. En d'autres termes, il y a absorption de chaleur quand les liaisons hydrogène se rompent et, inversement, il y a un dégagement de chaleur lorsqu'elles se forment.
b) Chaleur de vaporisation
La chaleur de vaporisation est la quantité de chaleur que 1 gramme de liquide doit absorber, à température constante, pour passer de l'état liquide à l'état gazeux. Là encore, l'eau a une chaleur de vaporisation trés élevée (2.26 kJ.g-1), en comparaison des autres liquides.
Comme dans le cas de la chaleur de fusion et dans celui de la chaleur spécifique, l'énergie nécessaire à rompre les liaisons hydrogène pour que les molécules d'eau se dissocient et puissent changer d'état explique les fortes valeurs observées.
Un aspect biologique important de cette propriété de l'eau est que l'un des moyens les plus efficaces dont dispose le corps humain pour abaisser sa température est la transpiration au cours de laquelle une grande quantité d'énergie est absorbée pour évaporer l'eau.
c) L'eau se dilate quand elle gèle
La densité de la plupart des substances augmente au cours de leur congélation. Le refroidissement de l'eau augmente aussi sa densité mais étonnamment jusqu'à un maximum atteint pour une température de 4°C. Ensuite, l'eau se dilate en se refroidissant davantage.
La raison en est encore une fois liée aus liaisons hydrogène: en effet, la glace se forme quand la vitesse des molécules d'eau n'est plus assez élévée pour rompre les liaisons hydrogène. Il apparaît alors un réseau cristallin où toutes les molécules d'eau sont liées à 4 molécules voisines par liaisons hydrogène. Ces liaisons maintiennent les molécules éloignées les unes des autres, diminuant ainsi la masse volumique de l'eau.
L'eau est donc l'une des rares substances qui possède une masse volumique moindre à l'état solide qu'à l'état liquide. La conséquence physique est que la glace flotte et en hiver seule la surface des étendues liquides gèlent. La couche de glace joue alors le rôle d'un isolant thermique qui empèche le fond des océans et des rivières de geler, préservant ainsi des conditions propices à la vie.
d) Pouvoir de cohésion, adhérence et tension superficielle
Les liaisons hydrogène dans l'eau n'ont qu'une durée de vie de 10-12 secondes. Mais en revanche, ils ne cesse de s'en former constamment et donc les liaisons hydrogène représente une force qui maintient ensemble les molécules d'eau et qui lui confère une particularité que n'ont que peu d'autres solvants: la cohésion.
On trouve un exemple tout à fait illustratif de cette propriété de l'eau chez les végétaux. En effet, la cohésion permet à l'eau de résister à la gravitation et ainsi de se déplacer dans les tiges des plantes. Les molécules d'eau en s'évaporant des feuilles vont être remplacées par celles situées en dessous qu'elles attirent. Cette traction se transmet jusqu'à la racine. L'attraction mutuelle entre des molécules de substances différentes s'appelle l'adhérence. Ainsi l'adhérence entre l'eau et les parois des tissus végétaux permet également de contrer la gravitation.
La tension superficielle résulte de la cohésion et restreint le nombre de molécule à la surface d'un liquide. Les gouttes ainsi formées ont un rapport surface/volume minimal qui permettent la formation d'un maximum de liaisons hydrogène. L'avantage biologique est la possibilité offerte à certaines surfaces de pouvoir retenir un plus grand volume d'eau.
Les liaisons hydrogène confèrent à l'eau également un certains nombre de propriétés physico-chimiques ou chimiques :
a) les substances ioniques et les molécules polaires sont très solubles dans l'eau
Si on met un morceau de sel dans un verre d'eau, il se dissoudra graduellement et l'on obtient une solution. L'agent dissolvant est le solvant, et la substance dissoute est le soluté. Grâce à sa polarité l'eau est attirée par les substances ioniques et les substances polaires. Cette interaction diminue les effets électrostatiques entre les ions.
Reprenons le cas du chlorure de sodium en solution. Le cristal va se disloquer et un trés grand nombre de molécules d'eau se retrouvent en compétition avec, comparativement, une trés faible quantité d'ions Na+ et Cl-. Les ions se retrouvent entourés de molécules d'eau, ce qui diminue leur interaction et les éloigne l'un de l'autre ( hydratation) .
On qualifie d'hydrophiles les substances soluble dans l'eau: par exemple, les sels, mais aussi les molécules polaires comme le glucose ou le saccharose (qui est le sucre alimentaire).
Des molécules organiques portant des groupes fonctionnels polaires comme les alcools à chaîne courte sont également trés solubles dans l'eau.
b) les substances non polaires sont insolubles dans l'eau
Les molécules dépourvues de groupes chargés ou d'atomes capables de former des liaisons hydrogène sont dénommées substances hydrophobes.
Si une molécule hydrophobe entre dans le réseau des liaisons hydrogène de l'eau, elle va le rompre localement. Ce réseau va se reconstituer en se séparant des molécules hydrophobes qui elles mêmes vont avoir tendance à fuir l'eau pour former une phase distincte: c'est l'interaction hydrophobe. Le meilleur exemple est celui de la séparation en deux phases quand on met de l'huile dans l'eau.
D'un point de vue physique, les molécules hydrophobes vont agir de la manière suivante:
• malgré la non polarité des molécules hydrophobes, les nuages d'électrons de deux molécules voisines interagissent de telle sorte qu'il apparaît des charges partielles de signe contraire
• les interactions d'attraction entre ces dipôles transitoires (constitués par les électrons d'un atome et le noyau d'un autre atome) sont appelées forces de dispersion de London et elles constituent l'essence de l'effet hydrophobe
• d'un point de vue thermodynamique, la diminution du nombre de molécules d'eau enrobant les groupes non polaires et l'agrégation de ces derniers s'accompagne d'un gain net d'entropie de l'ensemble du solvant et du soluté non polaire.
Les interactions hydrophobes sont des forces de faible énergie: 20 à 30 kJ.mol-1
Les liaisons hydrogène sont d'une importance capitale pour les processus biologiques :
• en premier lieu, bien qu'énergétiquement plus faibles que les liaisons covalentes, leur effet cumulatif renforce la forme tridimentionnelle des macromolécules et maintient leur structure ;
• inversement, ces liaisons confèrent toute la souplesse et la dynamique conformationnelle qui leur sont nécessaires ;
• cette fléxibilité des biomolécules leur confère leur capacité de reconnaissance, donc leur trés haute spécifité ;
• la facilité qu'ont ces forces à se rompre est compatible avec la chimie de la cellule où les propriétés de la vie découlent des interactions moléculaires. Les liaisons faibles permettent de brefs contacts : les biomolécules s'assemblent, réagissent l'une avec l'autre puis se dissocient. Par exemple, la réponse des organes à des stimuli hormonaux ou à des influx nerveux est un exemple de contacts brefs mais suffisants pour déclencher des réactions secondaires.
1.3.3.3 FORCES DE VAN DER WAALS
D'une manière générale, les liaisons de faible énergie sont fort importantes, elles comprennent un autre type de liaisons que nous allons examiner succintement : les liaisons de Van derWaals :
De faibles forces intermoléculaires apparaissent entre tous les atomes neutres à l'occasion d'interactions électrostatiques transitoires. Ces forces sont les forces de Van der Waals
Elles n'apparaissent que lorsque les atomes sont trés proches. Elle proviennent de dipôles infinitésimaux produits dans les atomes par le mouvement des électrons autour de leur noyau chargé positivement.
Ces forces représentent donc l'attraction électrostatique entre le noyau d'un atome et les électrons d'un autre atome.
À très longue distance, où il ne peut plus être question de liaison chimique, les forces de van der Waals entrent dans le cadre de l'électrodynamique quantique.
Dans le cas de molécules polaires, cette force s'ajoute à la force purement électrostatique (de même comportement) entre les dipôles permanents. Dans le cas de molécules à symétrie sphérique, d'atomes, etc. la force de van der Waals est la seule qui entre en jeu pour ces distances.
Les liaisons de van der Waals n'entrent pas dans le cadre des liaisons chimiques, en ce sens que les électrons restent sur leurs atomes (ou molécules) respectifs (les termes d'échanges restent négligeables). Elles sont l'origine du terme de pression négative intervenant en correctif dans l'équation du gaz parfait. Elles sont essentielles pour appréhender les forces entre atomes de gaz rare.
Pour les très courtes distances on entre alors dans le domaine de la chimie, où les diverses liaisons (liaisons hydrogène, liaisons métalliques...) deviennent compétitives, et peuvent l'emporter.
Quand les atomes soumis à des forces de Van der Waals se rapprochent trop, ils subissent une forte répulsion. Par contre, l'attraction est pratiquement nulle quand la distance interatomique dépasse la somme des distances d'empilement optimal, distance appelée rayon de Van der Waals. Quand deux atomes sont distants d'une valeur correspondant à la somme de leur rayon de Van der Waals, la force qui les attire est alors maximale
On différencie les forces de Van der Waals en quatre types :
• Les forces de Keesom ou effets d'orientation
Les forces de Keeson résultent d'une interaction intermoléculaire entre dipôles permanents. Elles représentent en général la composante la plus importante des forces de Van der Waals
Les forces de Keeson sont principalement liées à l'électronégativité. Elles apparaissent entre au moins deux molécules polaires (dipôles dits permanents), d'où leur ancien nom d'interaction « dipôle-dipôle ». Les forces de Keeson, tout comme les forces de Debye (dipôle permanent / dipôle induit) et de London (dipôle induit / dipôle induit) ne sont qu'une composante des forces de Van der Waals. En général les forces de Keeson représentent la part la plus importante de ces interactions, mais ce n'est pas toujours vrai.
Les forces de Keeson sont directionnelles. On peut rattacher les interactions de Keeson aux interactions ioniques, mais comme les forces de Keeson ne font intervenir que partiellement les charges, elles sont moins fortes.
Les forces de Keeson permettent souvent d'expliquer l'évolution de certaines propriétés physiques en fonction du moment dipolaire dans des molécules de structure proche. En effet, les forces de Keeson jouent pour une grande part dans l'agencement des molécules les unes par rapport aux autres. Pour vaincre les forces de Keeson qui existent entre molécules polaires, il est nécessaire d'apporter une énergie plus grande que dans le cas des molécules de même masse molaire mais apolaires. Ainsi les liquides à molécules polaires ont souvent des températures d'ébullition plus élevées que ceux à molécules apolaires de même masse molaire.
• Les forces de Debye ou effets d'induction.
Les forces de Debye sont les forces intermoléculaires résultants de l'interaction entre un dipôle permanent et un dipôle induit. Les forces de Debye font partie des forces de Van der Waals où elles expriment l'effet d'induction. Deux cas peuvent être envisagés selon que le dipôle induit est produit dans une molécule polaire ou apolaire.
• Les forces de London ou effets de dispersion.
Les forces de London existent du fait que la densité électronique des molécules est probabiliste : il y a une forte chance à tout moment pour que celle-ci ne soit pas équitablement répartie à travers la molécule, ce qui crée un léger moment dipolaire. Les moments dipolaires vont varier très rapidement au cours du temps. Ainsi à chaque distribution inhomogène se crée un moment dipolaire induit qui peut interagir avec les moments dipolaires induits des molécules voisines et une force s'exerce entre les molécules. Naturellement, ces dipôles induits peuvent également réagir avec un dipôle permanent (molécule polaire) mais les forces qui en résultent prennent alors le nom de forces de Debye. L'effet apparaît également dans les molécules polaires, mais c'est alors lesforces de Keesom qui prennent le dessus le plus souvent et les forces de London jouent alors un rôle souvent minime dans les interactions entre dipôles permanents.
De manière générale, pour des molécules polaires, les forces de London sont très faibles devant les autres forces intermoléculaires, par exemple les interactions ioniques ou les liaisons hydrogène ou les forces de Keesom entre dipôles permanents. Néanmoins, pour des molécules neutres (comme l'hélium), les forces de London sont la seule force attractive intermoléculaire à grande distance. Elles sont aussi prépondérantes dans les forces d'attraction entre molécules non polaires comme le diazote ou le méthane ou même les gaz rares . Sans l'effet des forces de London, il serait impossible de liquéfier ces gaz.
1.3.3.4 CONSEQUENCES DES LIAISONS FAIBLES
Citons des exemples de l'importance majeure des liaisons faibles :
• l'appariement complémentaire des bases d'un brin d'ADN à celles de l'autre brin dépend de liaisons hydrogène électives.
• le changement de conformation des protéases à sérine et donc l'apparition de leur activité protéolytique dépend de la formation d'une liaison ionique (qui en l'occurence porte le nom de pont salin ou paire d'ion) établie entre un acide aminé qui est l'aspartate et un autre acide aminé qui est la valine.
• les forces électrostatiques jouent un rôle primordial dans la reconnaissance entre les acides aminés des sites catalytiques des protéines et les groupements fonctionnels de leurs substrats.
• les forces de Van der Waals peuvent sembler dérisoire si l'on considère l'attraction d'un atome par l'autre. En revanche, si l'on considère deux très grandes molécules, cette forme d'attraction devient appréciable surtout si ces deux molécules ont des formes complémentaires et ajustent leurs atomes à des distances optimales pour les contacts de Van der Waals.
Ces forces ne joueront donc un rôle que lorsque deux structures moléculaires seront étroitement ajustées l'une à l'autre. On citera par exemple les interactions des résidus non polaires au sein des protéines, des brins d'ADN ou des membranes biologiques.
• l'effet hydrophobe est la force majeure qui contrôle le repliement des protéines et l'assemblage des membranes biologiques.
1.3.3.5 CARACTERE NUCLEOPHILE DE L'EAU
On dit qu'une molécule est nucléophile si elle est riche en électrons ou : Un réactif nucléophile est une molécule ou un ion négatif possédant, au moins, un doublet non liant ou une vraie charge négative. Ce doublet libre permettra d'établir une liaison avec un réactif pauvre en électrons. C'est le cas de l'eau . Les espèces nucléophiles sont attirées par les espèces moléculaires chargées positivement ou électrophiles, autrement dit, déficientes en électrons comme par exemple les noyaux atomiques. Les nucléophiles attaquent les centres positifs, ce qui produit des réactions d'addition ou de transfert, les plus courants de ceux-ci en chimie biologique possèdent des fonctions contenant de l'oxygène, de l'azote, du soufre.
Malgré la faiblesse de son caractère nucléophile, l'eau atteint une telle concentration dans la cellule que bon nombre de biomolécules , tels les polymères ont tendance à se dégrader par attaque nucléophilique de l'eau . On sait qu'une protéine peut être scindée par l'eau , sous l'influence d'un enzyme protéolytique ; dans cette hydrolyse, la protéine se dépolymérise en ses acides aminés constitutifs . Ce type de réaction a lieu par transfert d'un groupe acyle du polymère à la molécule d'eau. Une hydrolyse est une réaction essentiellement irréversible , autrement dit, l'équilibre de la réaction d'hydrolyse est complètement déplacé dans le sens de la disjonction des constituants.
Une question se pose alors : Comment la cellule peut-elle opérer des biosynthèses ?
La cellule dispose de moyens simples pour contrecarrer des des équilibres défavorables ou empécher des réactions indésirables :
- les liaisons formées entre les éléments monomériques sont exceptionnellement stables en solution neutre. Aussi, bien que leur hydrolyse soit favorisée, les polymères sont tout à fait stables en absence d'enzymes qui catalysent leur hydrolyse. Ces enzymes, les hydrolases sont , sont mis en réserve sous forme inactive ou bien confinés dans les orgtanites ; ce n'est donc qu'à des moments choisis qu'ils sont prêts à catalyser la décomposition des biopolymères.
- Nous verrons plus loin que le mécanisme chimique même des réactions de biosynthèse favorise cette stabilité.
1.3.3.6 STRUCTURE DE L'EAU LIQUIDE
La structure de l'eau à l'état liquide fluctue rapidement
Des mesures de diffraction aux rayons x et de neutrons par molécules d'eau ont révélé une structure complexe
A une température proche de 0°C la distance moyenne entre O........O les plus proches est de 2,82 Angströms, soit légèrement supérieure à la distance cprrespondante de 2,76 Å trouvée dans la glace et, ce, malgré la densité plus élevée de l'état liquide. Ces mesures montrent également que chaque molécule d'eau est entourée , en moyenne, de 4,4 molécules d'eau voisines les plus proches, ca qui suggère fortement que la structure de base de l'eau à l'état liquide est tétraédrique. Cette hypothèse est corroborée par les distances intermoléculaires supplémentaires de ~4,5 et ~7 Å trouvées dans l'eau à l'état liquide n qui correspondent à peu près aux distances aux distances qui sépareraient les deuxièmes et troisièmes molécules d'eau les plus proches dans une structure tétraédrique de type glace. Toutefois l'eau à l'état liquide présente également une distance intermoléculaire de 3,5 Å , laquelle ne peut s'expliquer par une structure de type glace.
De plus ces distances moyennes deviennent beaucoup moins discernables lorsque l'on approche des températures physiologiques, ce qui traduit une destruction de la structure de base de l'eau par la chaleur.
La structure de l'eau à l'état liquide n'est pas facile à décrire. En effet, chaque molécule d'eau se réoriente environ une fois toutes les 10-12 s ce qui rend la détermination de la structure instantanée de l'eau un problème difficile à résoudre, tant sur le plan expérimental que théorique ( peu de techniques expérimentales peuvent effectuer des mesures dans des temps aussi courts ).Cependant grace à de nouvelles méthodes de calcul, les théoriciens sont en passe de décrire la structure intermoléculaire de l'eau à l'état liquide.
En majorité, les molécules d'eau à l'état liquide sont chacune réunies par des liaisons hydrogène aux quatre molécules les plus proches comme dans la glace . Cependant ces molécules hydrogène sont déformées, ce qui rend les réseaux de molécules liées irréguliers et variés.Le nombre de liaisons hydrogène réalisé par chaque molécule variant de 3 à 6, et varie également rapidement au cours du temps.
I.3.3.7 REMARQUES
- Comparaison de quelques propriétés de l'eau avec d'autres molécules ayant le même nombre de protons.
| Nombre de protons | 6+4 | 7+3 | 2+8 | 1+9 | 10 | |
| Molécules | CH4 | NH3 | H20 | HF | Ne | |
| Point de fusion | -184°C | -78°C | 0°C | -98°C | -249°C | |
| Point d'ébullition | -161°C | -33°C | +100°C | +19°C | -246°C | |
|
Chaleur latente de vaporisation en Kcal/moles |
2,2 | 5,5 | 9,75 | 7,82 | 0,415 |
HF, NH3,et H2O des forces de cohésion plus grandes qu'attendues. Pourquoi ?
Du fait de la structure polaire de l'eau , les molécules d'eau vont s'orienter les unes par rapport aux autres ; la structure spatiale est stable ( similaire à un état cristallin aténué ).
L'eau a donc tendance à former des polymères ; l'ammoniac et l'acide fluorhydrique forment également des polymères , mais ceux=ci ne sont pas linéaires , ce qui exclut une polymérisation quasi infinie comme pour l'eau.
Comme nous l'avons vu plus haut, cette liaison non covalente est dénommées "liaison hydrogène", que nous rencontrons très fréquemment en biochimie. Quelle est l'énergie de liaison d'une liaison hydrogène ?
Soit la circulation latente de sublimation de la glace à 0°C ! 12,2 Kcal/mole puisque la molécule d'eau contient deux atomes d'hydrogène capables de former 2 ponts hydrogène , si le passage de l'état solide à l'état gazeux correspond à la rupture de ces liaisons, on a une valeur approchée de la liaison hydrogène 12,2/2=6,1 Kcal/mole.
une valeur plus précise peut être obtenue si l'on tient compte des forces de Van der Waals soit 5 Kcal par mole. Les mesures les plus précises donnent actuellement 4,5 Kcal par mole.
- Pour rappel , la liaison covalente est de loin plus énergétique :
H2OG ----------> 2H + O, ΔE = -220 Kcal ; une liaison covalente O-H = 110 Kcal
- Pour passer de l'état solide (glace) à l'état liquide : H2OS------->H2OL , combien de liaisons hydrogène supprime-t-on ?
Si l'on suppose que l'on a fait que supprimer des liaisons hydrogène , la chaleur latente de fusion étant de 1,44 Kcal par mole ( 80 cal/g) ; on a 1,44/(2 . 4,5) ! 16% soit une diminution de 16% du nombre de liaisons hydrogène ( 1 liaison sur 6 ). Il reste ainsi à 0° ( liquide ) 84 % des liaisons hydrogène. Des mesures indiquent que, dans les limites de température des êtrs vivants, 80 % des liaisons H, soit 4/5 sont encore présentes.
- La chaleur latente de vaporisation de l'eau est élevée, à 40°C, = 574cal/g : ceci signifie qu'un système biologique peut diminuer aisément sa température ( éliminer des calories ) en évaporant peu d'eau;
La chaleur spécifique de l'eau est élevée ( 1 cal par g ), il faut fournir beaucoup d'énergie thermique pour élever la température de 1 °C.
l'eau est donc utilisée dans les système biologique comme :
- Thermostat
- Comme agent solubilisant grâce à sa dipolarité permanente (constante diélectrique = +/- 80)
- Comme transporteur, grâce à la tension superficielle élevée ( du également aux ponts hydrogène ) : la tension superficielle élevée permet une ascension capillaire importante , ce phénomène est fondamental pour le maintien du monde biologique. La tension superficielle élevée amène l'eau à quitter la surface des systèmes biologiques, il y a concentration des solutés aux interfaces ( formations de barrières ).
Date de dernière mise à jour : 23/12/2016
Ajouter un commentaire