- Accueil
- D.Sciences biologiques
- II.Biologie moléculaire COMPLET
- Biologie moléculaire 1
Biologie moléculaire 1
COURS DE BIOLOGIE MOLECULAIRE
I. LE NOYAU EUCARYOTE
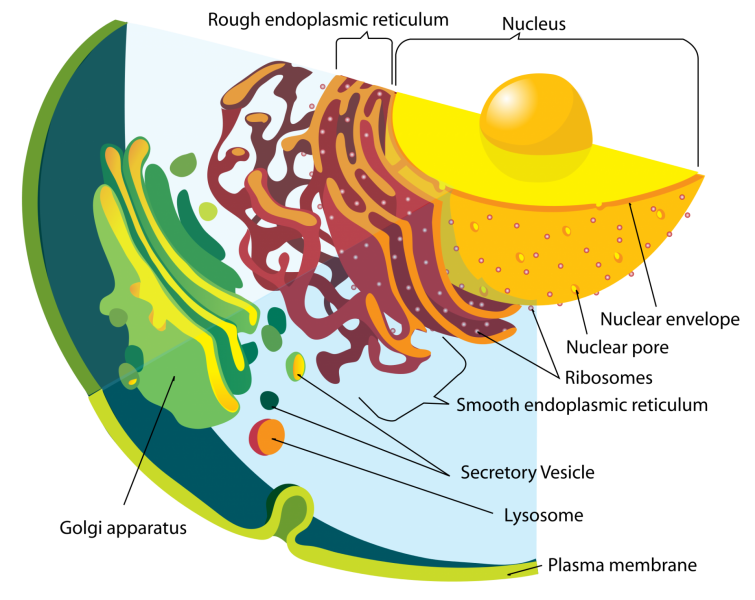
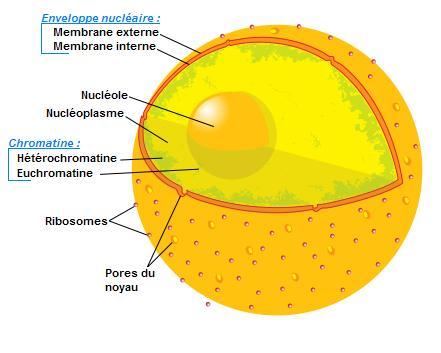
figure 1 : le noyau en relation avec le réticulum endoplasmique
I .1 Le noyau
I.1.1 la membrane nucléaire
Cette membrane est double et constitue une émanation du réticulum endoplasmique ( L/P = 30/70 ).
Cette membrane est perforée de pores nucléaires : Le pore est constitué d’un complexe protéique de 8 unités.
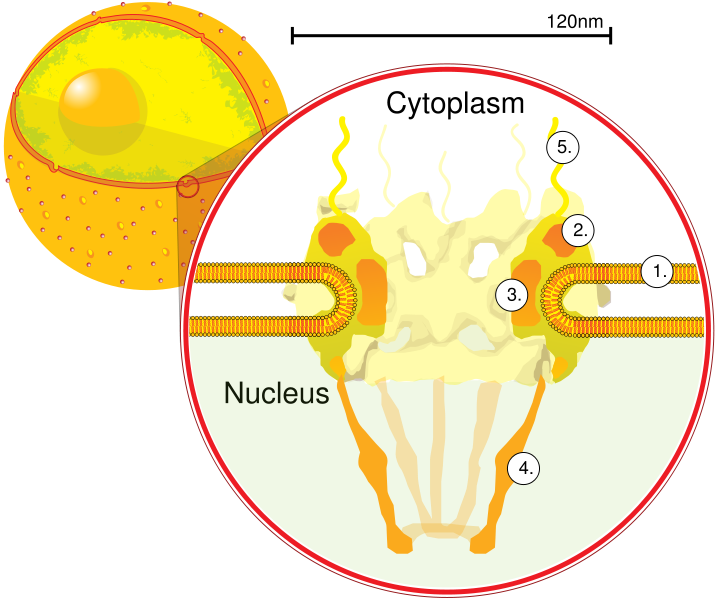
fig 2 : structure bioprotéique du pore nucléaire
La densité des pores varie et en fonction de leur mode de répartition sur le noyau. En effet, en cas de faible densité ( quelques % de la surface membranaire ), ils sont disposés au hasard, par contre en cas de forte densité ( +/- 25% de la surface ),la disposition est régulière.
Les échanges entre le nucléoplasme et le hyaloplasme se font au travers d’un canal de 10 nanomètres (1) de diamètre,ménagé au sein du pore. La lamina, partie interne de la membrane a une d’épaisseur située entre 15 et 60 nanomètres (1 nanomètre = 10-9 mètre).
I.1.2 Le nucléoplasme
C’est un milieu à rapprocher du hyaloplasme, riche en enzymes diverses : Solution colloïdale gélatineuse contenant différentes substances chimiques. C’est un réservoir de nucléotides pour la synthèse des acides nucléiques et un milieu dans lequel la chromatine se trouve en suspension de même qu’un ou plusieurs nucléoles.
I.1.3 La chromatine
Dans les cellules eucaryotes, le matériel génétique est organisé en une structure complexe constituée d’ADN et de protéines et il est localisé dans le noyau. Cette structure a été baptisée chromatine (du grec khroma: couleur et sôma: corps). Environ deux mètres d’ADN dans chaque cellule doivent être contenus dans un noyau de quelques mm de diamètre. En plus de cet énorme degré de compaction, l’ADN doit être rapidement accessible afin de permettre son interaction avec les machineries protéiques régulant les fonctions de la chromatine:
- la réplication
- la réparation et
- la recombinaison.
Ainsi l’organisation dynamique de la structure chromatinienne influence, potentiellement, toutes les fonctions du génome.
I.1.3.1 Le nucléosome
La digestion partielle de l’ADN organisé en chromatine génère des fragments de 180 à 200 pb, caractérisés par des images en "échelle" après migration électrophorétique. La régularité de cette structure a été ensuite confirmée par analyse en microscopie électronique révélant une chromatine constituée de particules régulièrement espacées, dont l’aspect rappelle celui d’un "collier de perles". La stoechiométrie ADN-histones est de 1/1 en masse.
Le nucléosome est un complexe comportant un segment d’ADN d'environ 146 nucléotides, enroulé autour d'un cœur formé de protéines (les histones). Chez les eucaryotes, le nucléosome constitue l’unité de base d'organisation de la chromatine. Il représente le premier niveau de compaction de l’ADN dans le noyau, on compare souvent sa géométrie à celle d'un fil enroulé autour d'une bobine.
Le nucléosome est l’unité fondamentale de la chromatine. Il est composé de:
- une particule cœur et
- une région de liaison (ou région internucléosomale) qui relie les particules coeurs adjacentes .
La particule cœur, dont la structure est très conservée parmi les espèces, est composée de 146 pb d’ADN enroulées selon environ 1,7 tour autour d’un octamère protéique comprenant deux exemplaires de chacune des histones H3, H4, H2A et H2B.
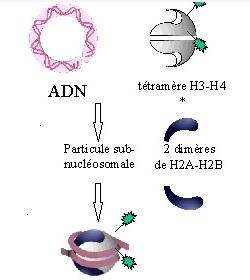
fig 1
I.1.4.2 Le nucléofilament
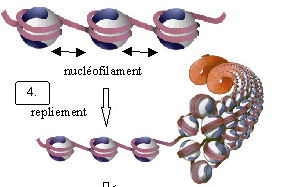
fig2
L’unité fondamentale de la chromatine est appelée le nucléosome qui est composé d’ADN et d’histones. Il constitue le premier niveau de compaction de l’ADN dans le noyau. Cette structure est ensuite régulièrement répétée pour former le nucléofilament qui peut, lui-même, adopter des niveaux d’organisation plus compacts , le niveau de condensation le plus élevé étant atteint au sein du chromosome métaphasique. Au sein du noyau interphasique, la chromatine est organisée en territoires fonctionnels.
C’est un filament qui est replié de nombreuses fois sur lui-même en formant une sorte de réseau à l’intérieur du noyau. Ce filament provient de la décondensation des chromosomes, lesquels n’apparaissent qu’au moment de la division cellulaire.
L’enchaînement des nucléosomes forme donc un nucléofilament, aussi appelé fibre de chromatine de 11 nm ou de façon imagée le « collier de perles ». Les particules de cœur y apparaissent séparés par des segments d’ADN de liaison dont la longueur varie selon les espèces et les tissus entre 25 paires de bases chez la levure bourgeonnante à 70 paires de bases dans le sperme des échinodermes.
La longueur de la région d’ADN internucléosomale varie selon l’espèce et le type cellulaire. C’est au niveau de cette région que les histones internucléosomales également variables, sont incorporées.
I.1.4.3 Euchromatine et hétérochromatine
La chromatine a été divisée en:
- euchromatine et
- hétérochromatine.
a) L’hétérochromatine a été définie comme une structure qui ne change pas d’état de condensation au cours du cycle cellulaire tandis que l’euchromatine apparaît décondensée pendant l’interphase. L’hétérochromatine est localisée principalement en périphérie du noyau et du nucléole tandis que l’euchromatine est répartie à l’intérieur du nucléoplasme.
On distingue:
- l’hétérochromatine constitutive qui contient peu de gènes, formée principalement de séquences répétées et dont les plus grandes régions sont situées à proximité des centromères et des télomères, de
- l’hétérochromatine facultative qui contient des régions codantes pouvant adopter les caractéristiques structurale et fonctionnelle de l’hétérochromatine, comme le chromosome X inactif chez la femelle des mammifères.
b) la chromatine diffuse ( euchromatine ).
L’euchromatine est de la chromatine décondensée formée de fibres de 3,5 à 6 nm de diamètre. Elle est très déspiralisée et correspond à des zones de gènes actifs, c’est-à-dire que les gènes y sont transcrits. L’euchromatine (ou plus précisément les histones de celle-ci) est hyperacétylée et hypométhylée par rapport l’hétérochromatine.L’euchromatine est la partie de chromatine active au niveau transcriptionnel. Elle constitue 15% de l’ADN nucléaire.
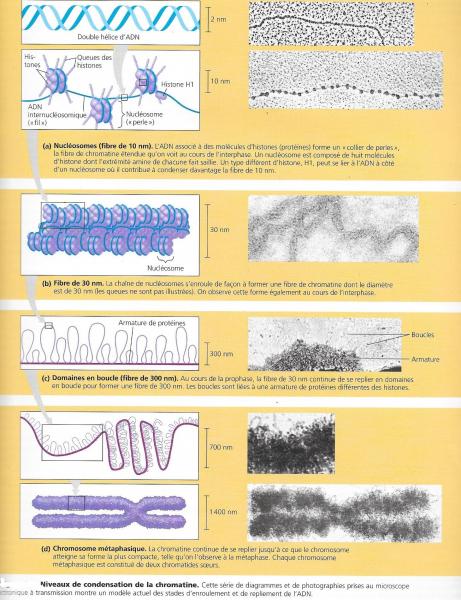
fig3
I.1.5 Les histones
I.1.5.1. Les histones de la particule coeur
se reporter à la fig 1
Les histones de la particule coeur, H3, H4, H2A et H2B sont de petites protéines basiques très conservées au cours de l’évolution . La région la plus conservée de ces histones est leur domaine central structuré composé du "motif histone fold" qui comprend trois hélices séparées par deux boucles. En revanche, les extrémités N-terminales de ces histones sont plus variables et sont dépourvues de structure secondaire. Ces extrémités sont particulièrement riches en résidus lysine et arginine et donc très basiques. Elles sont la cible de nombreuses modifications post-traductionnelles pouvant affecter leurs charges mais aussi l’accessibilité à l’ADN et les interactions protéines/protéines avec le nucléosome.
Il est important de noter que d’autres protéines impliquées dans les interactions avec l’ADN présentent ce type de "motif histone fold".
I.1.5.2. Les histones internucléosomales
Les histones internucléosomales sont les protéines qui s’associent à la région d’ADN de liaison entre deux nucléosomes. Contrairement aux histones de la particule cœur, elles sont peu conservées parmi les espèces. Chez les eucaryotes supérieurs, elles sont composées de trois domaines: un domaine globulaire central non polaire, essentiel pour les interactions avec l’ADN, et deux extrémités N- et C- terminales non structurées, hautement basiques, et soumises à des modifications post-traductionnelles. Les histones internucléosomales joueraient un rôle dans l’espacement des unités nucléosomales et dans la compaction de l’ADN au sein du nucléosome en créant une région d’interaction entre les nucléosomes adjacents.
I.1.5.3. Le code histone
Le degré de condensation de l’ADN autour des nucléosomes d’histones et des protéines non histone est variable le long des chromosomes. Il est faible dans l’euchromatine que l’on dit « ouverte » et accessible à la machinerie des ARN polymérase Il est élevé dans l’hétérochromatine, que l’on dit « fermée » et « inaccessible » à la machinerie de transcription.
Ce degré de condensation est régulé par des modification des extrémités N-terminales des histones, comme des phosphorylations, acétylations, méthylations, etc. l’ensemble de ces modifications étant catalysées par des enzymes spécifiques. Les modifications covalentes des histones agiraient soit directement en modifiant la compaction de l’enroulement d’ADN autour des nucléosomes, soit indirectement en constituant des « marques » permettant le recrutement de protéines capables de modifier la structure de la chromatine. Le modèle des modifications covalentes des histones agissant comme un code (le « code des histones ») a été proposé par Strahl et Allis en 2000 dans la revue Nature. On peut cependant noter que ce code est, semble-t-il, loin d’être universel, mais plutôt relativement spécifique selon les gènes et les cellules considérés.
Dans les spermatozoïdes, les histones sont remplacées par des protamines, protéines riches en arginine et en cystéine. La richesse en cystéine permet la formation de ponts disulfure. Cette structure protège l’ADN lors d’éventuels déplacements liés à la fécondation.
Le code des histones établit un lien direct entre la modification de certains résidus de la queue des histones qui créé des liaisons pour des effecteurs protéiques et l’état transcriptionnel de la chromatine. Une modification d’histone peut en influencer une autre de manière synergique ou antagoniste ; c’est un mécanisme qui génère et stabilise des empreintes spécifiques. L’acétylation (ajout de groupement acétyl) s’effectue sur certains résidus lysine précis par des enzymes nommées histones acétyl transférases (HAT). Elle diminue généralement l’interaction inter-nucléosomes et entre les queues des histones et le fragment d’ADN qui fait le lien entre les nucléosomes. Ceci entraîne le relachement de la chromatine, la faisant passer à l’état euchromatinien, et permet ainsi une meilleure accessibilité aux autres facteurs. L’acétylation est associée à une activation de la transcription et est facilement réversible grâce à l’action des histones désacétylases (HDAC).
La méthylation, quant à elle, peut s’effectuer soit sur des lysines soit sur des arginines. C’est une modification stable et jusqu’alors très peu d’histones déméthylases ont été découvertes. Selon les résidus méthylés elle est associée à une activation ou une répression de la transcription.
De manière générale, ces deux types de modifications sont antagonistes, et la désacétylation des lysines doit précéder leur méthylation. Cet antagonisme entraine la mise en place d’un certain équilibre dynamique entre les territoires hétérochromatiniens (généralement non exprimables et méthylés sur certains acides aminés clés) et euchromatiniens (généralement exprimables et acétylés). Par exemple, la Lysine 9 de l’histone H3 est connue pour être associé à une repression de la chromatine environnante lorsqu’elle est méthylée. Cette méthylation est reconnue par une protéines, HP1, qui se fixe donc sur H3 méthylée. A son tour, HP1 attire la protéine Suv39, une Histone MethylTransférase, qui pourra méthyler la lysine 9 de l’histone H3 du nucléosome voisin, et ainsi de suite. On voit donc, comment, de proche en proche, les histones H3 seront méthylés et la chromatines sera condensé. cependant, cette invasion hétérochromatinienne sera stoppée si la lysine 9 de H3 rencontrée est déjà Acétylée. Ainsi se met en place un équilibre compétitif entre domaine chromatiniens exprimés et réprimés.
Les modifications des queues d’histones jouent le rôle de « marques » épigénétiques qui entraînent le recrutement de différentes classes de protéines, puisque les lysines acétylées ou méthylées sont reconnues par des domaines protéiques différents. De plus, le recrutement de certains facteurs au niveau de la chromatine nécessite l’existence préalable de modifications d’histones et de protéines déjà liées. Le code des histones est donc interprété dans le contexte d’autres facteurs associés à la chromatine et c’est la combinaison d’interaction entre les histones modifiées et d’autres facteurs qui détermine si une protéine est recrutée à la chromatine.
I.1.6 Les différentes étapes dans l’assemblage de la chromatine
L’assemblage de l’ADN en chromatine comprend plusieurs étapes qui commencent par la formation de son unité fondamentale, le nucléosome, et finissent par des niveaux d’organisation supérieurs en domaines spécifiques dans le noyau. Les différentes étapes de cet assemblage sont décrites schématiquement dans la Fig .
- La première étape comprend la mise en place, sur l’ADN, d’un tétramère d’histones (H3-H4)2 nouvellement synthétisées formant la particule sub-nucléosomale, à laquelle viennent s’adjoindre deux dimères H2A-H2B.
L’ensemble constitue la particule nucléosomale coeur composée de 146 paires de base d’ADN enroulées autour du octamère d’histones.
Cette particule cœur et l’ADN de liaison forme le nucléosome.
Les histones nouvellement synthétisées sont spécifiquement modifiées (ex: acétylation de l’histone H4).
- L’étape suivante est une étape de maturation nécessitant la présence d’ATP, au cours de laquelle les nucléosomes sont régulièrement espacés et forment le nucléofilament. Pendant cette étape, les histones nouvellement incorporées sont désacétylées.
- Ensuite l’incorporation des histones internucléosomales est accompagné par le repliement du nucléofilament en fibre de 30 nm dont la structure n’est pas élucidée à ce jour. Deux modèles principaux existent : le modèle de type solénoïde et le modèle de type zig zag.
- Finalement, plusieurs repliements successifs conduisent à des niveaux d’organisation supérieurs en domaines spécifiques dans le noyau.
A chacune des étapes décrites ci-dessus, des variations dans la composition et l’activité de la chromatine peuvent être obtenues en modifiant soit ses composants élémentaires, soit l’activité de facteurs impliqués dans les processus d’assemblage et de désassemblage.
http://www.ipubli.inserm.fr/bitstream/handle/10608/1702/MS_2000_5_603.pdf
L’assemblage commence avec la mise en place d’un tétramère (H3-H4)2 d’histones nouvellement synthétisées (1), à laquelle viennent s’adjoindre deux dimères H2A-H2B (2) pour former la particule nucléosomale cœur. Les histones nouvellement synthétisées sont spécifiquement modifiées; la modification la plus conservée est l’acétylation de l’histone H4 sur les lysines 5 et 12 (H3-H4*). L’étape de maturation nécessite la présence d’ATP afin d’établir un espacement régulier des nucléosomes et les histones nouvellement incorporées sont désacétylées (3). L’incorporation des histones internucléosomales est accompagné par le repliement du nucléofilament. Ici est présenté le modèle de type solénoïde dans lequel il y a 6 nucléosomes par tour (4). Finalement, plusieurs repliements successifs conduisent à des niveaux d’organisation supérieurs en domaines spécifiques dans le noyau (5).
I.1.7 Les variations dans les composants élémentaires
Dès les premières étapes de l’assemblage de la chromatine, la particule élémentaire peut être soumise à des variations
- au niveau de l’ADN (par exemple, par méthylation), ou
- au niveau des histones qui peuvent soit présenter différentes modifications post-traductionnelles, soit exister sous des formes variantes (par exemple CENP-A, variant de l’histone H3).
Toutes ces variations sont capables d’induire des différences dans la structure et dans l’activité de la chromatine. La grande diversité des modifications post-traductionnelles des extrémitées N-terminales des histones, présentée dans la Fig 6, (comme l’acétylation, la phosphorylation, la méthylation, l’ubiquitination, la polyADP-ribosylation), et leur association à des processus biologiques spécifiques, ont conduit à proposer l’hypothèse d’un "langage" baptisé le "code histone" (il est important de noter que ce code est une hypothèse de travail). Ce code serait "lu" par d’autres protéines ou complexes protéiques, capables de reconnaître et d’interpréter des profils de modification spécifiques. L’incorporation de formes variantes des histones peut être importante pour des domaines spécifiques du génome: ainsi CENP-A, variant de l’histone H3, est associé aux régions centromériques et macro H2A au chromosome X inactif chez la femelle de mammifères. H2A-X interviendrait dans la formation de foyers contenant des facteurs de réparation dans des régions où des cassures d’ADN double brin ont eu lieu. H2A-Z pourrait jouer un rôle en modifiant la structure de la chromatine afin de réguler la transcription .
Pendant l’étape de maturation, l’incorporation d’histones internucléosomales, de protéines chromatiennes non-histones appelées HMG (High Mobility Group) ou d’autres facteurs se liant spécifiquement à l’ADN peuvent affecter l’espacement et le repliement du nucléofilament. Ainsi les premières étapes de l’assemblage peuvent avoir une grande incidence sur la nature finale de la chromatine dans des domaines spécifiques du noyau.
I.1.8 Les facteurs d’assemblage en chromatine
I.1.8.1. Les facteurs interagissant avec les histones
Des facteurs de nature acide peuvent former des complexes avec les histones et ainsi favoriser leur mise en place. Ces facteurs sont considérés comme des chaperons d’histones qui facilitent la formation de la particule nucléosomale sans faire partie intégrante de cette particule. Ces facteurs, aussi appelés facteurs d’assemblage de la chromatine, se lient préférentiellement à une sous population d’histones.
Par exemple, le facteur CAF-1 (Chromatin Assembly Factor 1) interagit avec les histones H3 et H4 acétylées nouvellement synthétisées et participe à l’assemblage de la chromatine couplé à la réplication de l’ADN. CAF-1 est aussi capable de promouvoir l’assemblage de la chromatine spécifiquement couplé à la réparation de l’ADN. L’interaction entre CAF-1 et la protéine PCNA (Proliferating Cell Nuclear Antigen) établit un lien moléculaire étroit entre l’assemblage en chromatine et les processus de réplication et de réparation de l’ADN. L’assemblage de structures spécialisées comme les régions centromériques, en déposant des variants d’histones comme CENP-A, ou télomériques, pourraient faire intervenir la spécificité et la diversité des chaperons d’histones.
I.1.8.2. Les facteurs de remodelage et les enzymes modifiant les histones
Des facteurs interviennent aussi pendant l’étape de maturation de la chromatine en organisant et en maintenant un état défini de cette chromatine. Ils peuvent affecter la chromatine en induisant des changements conformationnels au niveau du nucléosome mais aussi au niveau de larges domaines de chromatine. Ces facteurs sont de deux types: les premiers nécessitent de l’énergie sous forme d’ATP et sont généralement appelés facteurs de remodelage de la chromatine, et les seconds sont des enzymes qui modifient post-traductionnellement les histones.
- Facteurs de remodelage: ce sont des complexes multiprotéiques (familles SWI/SNF, ISWI, Mi2/NuRD) L’activité ATPase permet au complexe de modifier la structure nucléosomale, en partie grâce à l’énergie libérée par l’hydrolyse de l’ATP. L’étude des facteurs qui favorisent un espacement régulier des nucléosomes pendant l’assemblage de la chromatine a permis d’identifier plusieurs complexes multiprotéiques capables in vitro de faire "glisser" des nucléosomes sur de l’ADN. Bien que ces facteurs de remodelage ont en commun la présence de nombreuses sous-unités protéiques dont l’ATPase, ils présentent toutefois des différences dans leur quantité et dans leur activité.
- Modifications post-traductionnelle: l’hypothèse du "code histone" a été proposé pour expliquer la diversité des activités de la chromatine dans le noyau. Les extrémitées N-terminales non structurées des histones pointent à l’extérieur de la particule nucléosomale cœur et sont la cible d’enzymes qui les modifient post-traductionnellement. La modification la mieux étudiée jusqu’à maintenant est l’acétylation des résidus lysine. L’état d’acétylation résulte d’un équilibre entre deux activités antagonistes : l’activité histone-acétyltransférase (HAT) et l’activité histone-désacétylase (HDAC) (ex:HAT A, présentant une activité histone-acétyltransférase, et HDAC1, histone-désacétylase). De nombreuses protéines jouant un rôle dans la régulation de la transcription ont une activité histone-acétyltransférase intrinsèque. De même, des histone-désacétylases ont été décrites comme faisant partie de complexes multiprotéiques associés avec la nature répressive de la chromatine. Parmi ces complexes, se retrouvent les facteurs de remodelage de la famille Mi2, suggérant un lien entre le remodelage des nucléosomes et le désacétylation des histones pendant la fonction répressive de la chromatine.
La méthylation des histones, joue un rôle fonctionnel important. Une méthyltransférase méthyle spécifiquement H3 sur son résidu lysine 9 et cette méthylation modifie l’interaction de H3 avec des protéines associées à l’hétérochromatine.
Les deux modifications possibles (acétylation et méthylation) sur le même résidu (lysine 9) de l’extrémité N-terminale de H3 illustre parfaitement l’hypothèse du "code histone" en action. En effet, les lysines acétylées des extrémitées N-terminales de H3 et H4 sont reconnues par un domaine spécifique, appelé le chromodomaine, présent dans de nombreuses protéines présentant une activité histone-acétyltransférase. En revanche, H3 méthylé sur son résidu lysine 9 est reconnu par le chromodomaine d’une protéine spécifique de l’hétérochomatine (HP1, Heterochromatin Protein 1).
Ainsi, en plus des altérations produites dans la charge totale des extrémités des histones proposées être à l’origine de la déstabilisation physique du nucléosome, ces modifications semblent donner une spécificité aux interactions protéines:protéines avec les histones. Elles sont associées à différentes régions du génome et ont été corrélées avec des fonctions nucléaires précises.
I.1.9 Organisation du génome dans le noyau
Au delà des nucléosomes, la chromatine présente des niveaux d’organisation supérieurs encore peu caractérisés. Le nucléofilament se compacte pour former la fibre de 30 nm qui s’organise en boucles de 150 à 200 kpb (250 nm pendant l’interphase) pour atteindre un niveau de compaction maximum dans le chromosome métaphasique (850 nm).
En interphase, l’organisation du génome est relié à la structure des chromosomes dont les différentes régions organisées en bandes peuvent être visualisées par l’utilisation de colorant comme le Giemsa.
Les principales bandes sont les bandes G et C qui sont répliquées tardivement en phase S et correspondent à l’hétérochromatine, et
- les bandes R qui sont répliquées précocement en phase S et correspondent à l’euchromatine.
Les bandes R sont enrichies en histones acétylées qui sont conservées entre l’interphase et la mitose suggérant un rôle de marqueur fonctionnel de cette modification pouvant servir de mémoire de l’organisation de ces domaines au cours du cycle cellulaire.
La localisation des chromosomes dans le noyau interphasique révèle que chaque chromosome occupe un espace défini. Chez les mammifères, l’organisation des chromosomes dans le noyau varie en fonction du type cellulaire. Pendant l’interphase, les bandes des chromosomes métaphasiques sont localisées dans le noyau en fonction de leur réplication:
- les bandes G répliquées tardivement occupent la périphérie du noyau tandis que
- les bandes R contenant la majorité des gènes résident dans la partie interne du nucléoplasme.
Ainsi, bien que chaque chromosome occupe un territoire différent, des parties appartenant à des chromosomes distincts peuvent se réunir pour former des domaines fonctionnels. La localisation de régions codantes ou non codantes suggère que les gènes tendent à être localisés à la surface des territoires chromatiniens.
D’après un modèle reposant sur la localisation de quelques gènes, les transcrits seraient alors libérés dans des canaux interchromosomiques, transférés au niveau des sites d’épissage, puis exportés dans le cytoplasme après maturation.
Toutes ces études ont permis de proposer que le noyau est organisé en domaines. La localisation de l’ADN dans ces domaines peut être, en partie, une conséquence des activités de la chromatine. Le ciblage de protéines pourrait aider à apporter des protéines spécifiques dans des domaines particuliers du noyau. Dans un modèle hypothétique, les protéines associées à l’hétérochromatine (par exemple HP1, Polycomb, Sir3/pSir4p, ATRX), les facteurs de transcription (comme Ikaros) et les facteurs d’assemblage de la chromatine (comme CAF-1) sont des candidats pour l’établissement et le maintien des domaines nucléaires.
I.1.10 Organisation d’un chromosome métaphasique :
Le chromosome métaphasique est constitué de deux chromatides associés par leurs régions centromériques formant le centromère. A côté de cette constriction primaire qu’est le centromère, il existe des constrictions secondaires, par exemple la constriction secondaire de l’organisateur nucléolaire.
Structuration intime d’un chromatide :
Un chromatide est classiquement une molécule d’ADN (le nucléofilament) associée à des protéines histones et des protéines non histones). Une chromatide a la forme d’un bâtonnet qui peut avoir différents degrés de condensation suivant les moments du cycle cellulaire ou l’activité de transcription des gènes.
Cette unité structurale n’apparaît en tant que chromosome que durant les divisions cellulaires. Le reste du temps, l’ensemble des chromatides forme la chromatine.
Chaque chromosome d’une cellule peut être constitué d’un ou de deux chromatides selon son état :
- juste après une mitose, ou après la deuxième division méïotique, chaque chromosome n’est constitué que d’une chromatide,
- le reste du temps, après duplication de l’ADN, chaque chromosome est constitué de deux chromatides complètement identiques, reliées par le centromère, donnant ainsi aux deux bâtonnets la forme d’un X.
Au centre du chromatide métaphasique un réseau de protéines non histoniques.
Sur ce réseau se reploie la fibre épaisse d’ADN et de protéines histoniques ( voir la super hélice d’ADN) formant des structures massives appelées microconvules.

Fig 9 : structuration intime du chromosome
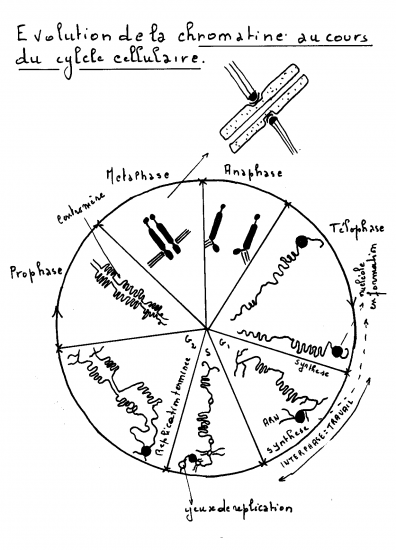
Rappel : Mitose
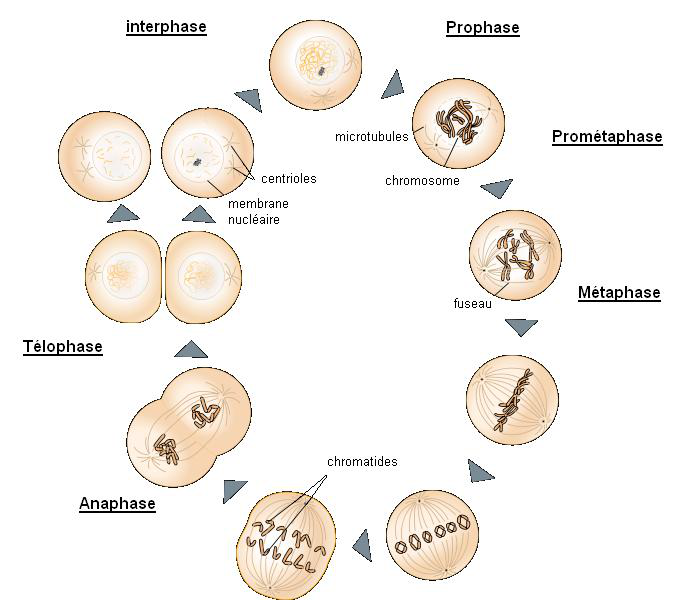
1. Interphase
Pendant longtemps on a cru qu’il ne se passait rien dans la cellule durant cette période mais, les cellules qui se divisent souvent, on a constaté, par analyse chimique de l’acidité nucléaire, que la quantité d’ADN doublait rapidement peu avant les phases visibles. On découvrit que la duplication de l’ADN était semi-conservative. Sous l’action d’une enzyme, l’ADN-polymérase, la double hélice s’ouvre et chaque demi-brin parental - ou originel - reconstitue le brin qui lui est complémentaire en respectant la complémentarité adénine-thymine et cytosine-guanine ; deux nouvelles structures d’ADN prennent ainsi naissance, constituée pour moitié d’un brin originel et, pour l’autre moitié, d’un nouveau brin. À la fin de l´interphase, le noyau contenant un ou plusieurs nucléoles est bien défini et entouré de l´enveloppe nucléaire.
Le centrosome, unique, s’est répliqué et les microtubules rayonnent des centrosomes en une formation étoilée appelée aster. Chaque chaîne d’ADN, s’étant répliquée - ou dupliquée - a donc fabriqué son homologue
2. Prophase
C’est une phase d’organisation. La membrane cytoplasmique de la cellule modifie sa perméabilité ; les échanges diminuent.
Le noyau et le cytoplasme subissent tous deux des changements pendant la prophase. Dans le noyau, les nucléoles se déplacent à la périphérie du noyau et disparaissent. Les fibres de chromatine se condensent en spirale - il existe 3 niveaux de condensation - pour former des chromosomes visibles au microscope photonique. Chaque chromosome dupliqué prend la forme de deux chromatides soeurs identiques réunies par le centromère.
Dans le cytoplasme, le fuseau de division se forme ; il se compose de microtubules et de protéines s´étirant entre les deux centrosomes. Pendant la prophase les deux centrosomes s´éloignent l´un de l´autre et les microtubules forment un fuseau qui entoure le noyau à partir d’une position polaire.
L´enveloppe nucléaire se fragmente. Les microtubules du fuseau peuvent alors se fixer aux chromosomes par le centromère.
3. Métaphase
L’enveloppe nucléaire est entièrement détruite, l’ergastoplasme est désorganisé et les centrosomes se trouvent aux pôles de la cellule. Les chromosomes s´alignent sur la plaque équatoriale - imaginaire - qui, comme son nom l´indique, est à égale distance des deux pôles du fuseau. Tous les centrosomes y sont alignés.
Étant donné sa forme, l´ensemble formé par les microtubules polaires et par les microtubules reliés aux chromosomes s´appelle fuseau achromatique - car dépourvu de couleur en microscopie optique.
4. Anaphase
L´anaphase commence quand le centromère dédoublé de chaque chromosome se sépare en deux, libérant ainsi les chromatides soeurs. Chaque chromatide devient dès cet instant un chromosome à part entière, conduit par le fuseau vers les pôles de la cellule. Les chromosomes sont alors attirés, via leur centromère, par contraction des microtubules vers les pôles.
Les mitochondries se concentrent au niveau de la plaque équatoriale. En même temps, les pôles s´éloignent l´un de l´autre. À la fin de l´anaphase, les deux pôles possèdent des jeux équivalents et complets de chromosomes ; la télophase commence.
5 télophase- cytocinèse
séparation de la figure anaphasique en deux nouveaux noyaux n et isolement dans deux cellules filles
Durant cette phase :
les chromosomes dépourvus de microtubules kinétochoriens se décondensent;
les microtubules polaires arrêtent leur élongation;
l'enveloppe nucléaire se reforme autour des chromosomes individuels;
le sillon de division sépare la cellule en deux, sous l'action d'un anneau contractile intracellulaire formé d'actine et de myosine qui est attaché à des protéines de la membrane cytoplasmique
Dans les cellules animales, la cytocinèse débute pendant la télophase, avec l´apparition du sillon de division, une invagination de la surface cellulaire à l´endroit occupé précédemment par la plaque équatoriale ; la cellule semble subir un étranglement centripète duquel naîtront deux nouvelles cellules complètes et séparées.
Dans les cellules végétales, dotées d'une paroi cellulosique, la cytocinèse apparaît comme un mécanisme centrifuge. Une double structure appelée plaque cellulaire se constitue pendant la télophase à l´équateur de la cellule mère, à partir du centre et rejoint la paroi de la cellule-mère originelle avec laquelle elle fusionne ; les deux nouvelles cellules végétales sont nées.
Cet article doit être recyclé en raison de la structuration du cycle cellulaire maintenant structuré en phases G1, G2, G0 et de l'intervention de cyclines régulatrices.
I.1.11 La nucléole
En microscopie électronique on remarque le nucléole dans le noyau par sa forte densité aux électrons (il forme un point sombre dans le noyau). Ceci étant dû à la présence de nombreux ARN et au fait que le nucléole soit associé à de l’hétérochromatine (ADN fortement condensé). Il contient 200 unités de transcriptions pour les ARNr. Il peut en exister un ou deux par cellule. Le nucléole est parfois différencié en deux zones : la zone fibrillaire, centrale, et la zone granulaire, périphérique.
- Au centre la zone fibrillaire contenant l’organisateur nucléolaire
- En périphérie, la zone granulaire contenant les préribosomes . Les préribosomes donneront naissance aux petites et grosses sous unités ribosomiques . Les nucléoles disparaîtront lorsque la cellule arrête ses travaux de synthèse.
- Un chercheur du nom de Miller a isolé par centrifugation le nucléole du noyau de plusieurs cellules, puis décompacté les composants fibrillaires denses qu’il contient.
En les observant au microscope électronique à transmission, on a ainsi pu découvrir des structures que Miller a poétiquement appelé des "arbres de Noël" à cause de leur forme. Le tronc de ces arbres est une molécule d’ADN (ce que l’on peut mettre en évidence avec un test à la DNase), les branches sont des ARN ribosomiques, les boules des protéines diverses et les grains raccordant les branches au tronc sont des ARN polymérases.
Dans un noyau, le nucléole est d’autant plus grand que la biosynthèse des ribosomes est importante dans la cellule qui le contient.
Le nucléole est donc un domaine du noyau. C’est le lieu où se produit la transcription des ARN ribosomiques, qui vont former, avec des protéines, les deux sous-unités des ribosomes. La formation des ribosomes dans le nucléole s’effectue en plusieurs étapes qui se déroulent dans les zones fibrillaires et granulaires.
-Étape 1: L’ADN codant les ARNr (ARN ribosomiques) est transcrit en un preARNr, cette étape se passe dans la zone fibrillaire du nucléole.
-Étape 2: Le preARNr est ensuite découpé en trois ARNr
-Étape 3: Simultanément dans le nucléoplasme de l’ADN codant les protéines constitutives des ribosomes est transcrit en ARN messager.
-Étape 4: L’ARN messager est traduit en protéines dans le cytoplasme
-Étape 5: Les protéines traduites rentrent dans le noyau et dans le nucléole, elles s’associent avec les ARN ribosomiques pour former des ribosomes.
-Étape 6: Les ribosomes néoformés sortent du noyau et migrent dans le cytoplasme jouer leur rôle.
Le nucléole évolue pendant le cycle cellulaire. En effet lors de la mitose le nucléole disparaît.
De plus, le nucléole étant le centre de synthèse des ribosomes, qui sont des éléments indispensables à la synthèse des protéines, son activité et donc sa taille vont varier en fonction de l’intensité de la synthèse des protéines dans la cellule. Le nucléole est dépourvu de membrane, et on peut en trouver plusieurs dans un même noyau.
Sous-pages :
Date de dernière mise à jour : 17/06/2020
Ajouter un commentaire