- Accueil
- D.Sciences biologiques
- I. Biologie cellulaire COMPLET
- Biologie cellulaire 9
Biologie cellulaire 9
II.8.3.1.3 La chaîne respiratoire
La chaîne respiratoire correspond à une association de complexes protéiques présents au sein de la membrane interne de la mitochondrie et responsable, avec l’ATP synthétase, de la phosphorylation oxydative. Ce processus associe l’oxydation du NADH et du FADH2, tous deux produits lors des différentes voies cataboliques de l’organisme (glycolyse, cycle de Krebs, hélice de Lynen…), à la production d’ATP et ceci grâce à la formation d’un gradient de protons.
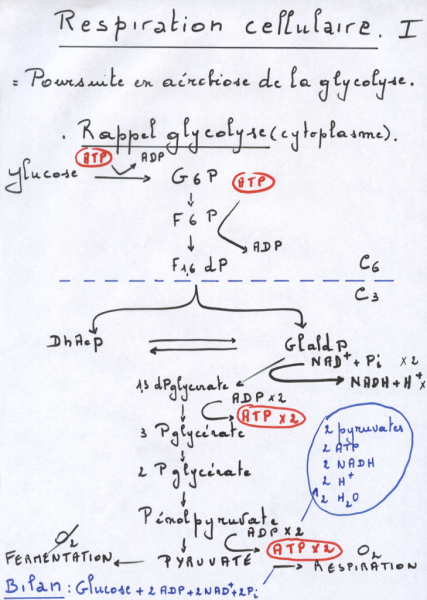
II.8.3.1.3.1 Les intervenants et leurs fonctions
a) Les transporteurs d’électrons
Tout au long de la chaîne respiratoire les électrons provenant du NADH et du FADH2, vont perdre de l’énergie qui sera utilisée pour former le gradient électrochimique de proton entre l’espace inter-membranaire et la matrice mitochondriale. Les électrons riches en énergie ainsi récupérés seront transportés successivement via les différents complexes :
- Le complexe I a une action NADH coenzyme Q réductase, récupérant les électrons du NADH et permet le transport de 4 protons de la matrice mitochondriale à l’espace inter-membranaire.
- Le complexe II a une action Succinate coenzyme Q réductase, récupérant les électrons du FADH2 et permet le transport d’aucun proton.
- Le complexe III a une action Coenzyme Q cytochrome C réductase, et permet le transport de 4 protons de la matrice mitochondriale à l’espace inter-membranaire.
- Le complexe IV a une action Cytochrome C oxydase, et permet le transport de 2 protons de la matrice mitochondriale à l’espace inter-membranaire.
- Le coenzyme Q (ou ubiquinone) permet la transition entre le complexe I ou II et le complexe III. Il est intéressant de préciser ici que le coenzyme Q accepte également les électrons provenant du cytosol.
- Le cytochrome C permet la transition entre le complexe III et le complexe IV.
Les électrons de basses énergies libérés à la fin de la chaîne respiratoire réagiront ainsi avec les molécules d’oxygène et les protons présents dans la matrice mitochondriale afin de former des molécules d’eau. Le fonctionnement progressif de la chaîne respiratoire est nécessaire car les électrons libérés par le NADH et le FADH2 sont riches en énergie et de cette manière ne peuvent pas réagir d’emblée avec les molécules d’oxygène.
Le NADH permettra donc le transport de 10 protons de la matrice mitochondriale à l’espace inter-membranaire, tandis que le FADH2 de seulement 6.
Le cyanure bloque le transfert d’électrons au niveau du complexe IV par combinaison avec le fer ferrique Fe3+. La roténone est un inhibiteur du complexe I.
II.8.3.1.3.2 : ATP Synthase
L’ATP synthétase est une pompe ionique inversée, qui au lieu de transporter les protons dans le sens inverse du gradient de concentration, entraîne la synthèse d’ATP grâce au passage des protons dans le sens du gradient.
Elle est constituée d’une sous-unité F0 intra-membranaire qui joue de rôle de canal protonique, d’une sous-unité F1 baignant dans la matrice mitochondriale et qui possède une activité ATP-synthétase, et d’une partie statique stabilisant la structure.
De cette manière le gradient de proton formé de part et d’autre la membrane interne de la mitochondrie permet la synthèse d’ATP qui sera libéré dans la matrice mitochondriale. Les 10 protons du NADH permettront une synthèse théorique de 3 ATP et les 6 protons du FADH2 de 2 ATP.
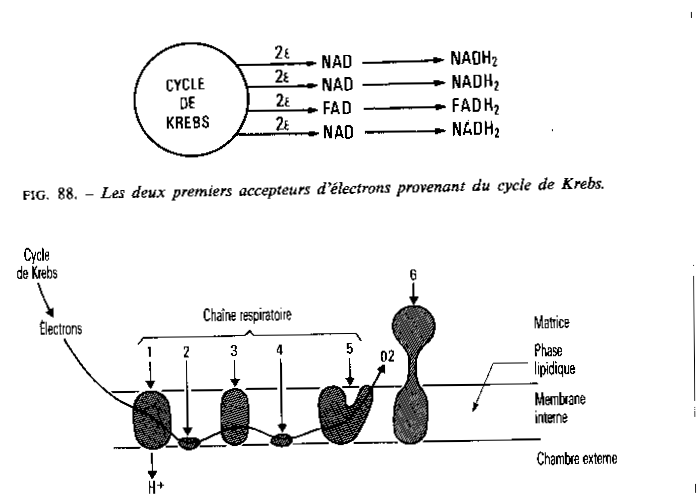
La phosphorylation, c’est à dire la régénération des molécules d’ATP dépend du retour des protons de l’extérieur vers l’intérieur de la mitochondries.
Ce retour est catalysé par l’ATP synthase ( complexe F1-F0) . La partie F1 possède l’activité catalytique, la tige F0 est un canal de protons permettant le passage de ceux-ci vers la membrane interne.
Le retour des protons est couplé avec la phosphorylation de l’ADP.
Le mécanisme du couplage est depuis peu assez précisément élucidé ( 1997), il ferait intervenir un mouvement de rotation relative de F0 par rapport à F1, nous n’approfondissons pas.
(Voir plus de détails en biochimie)
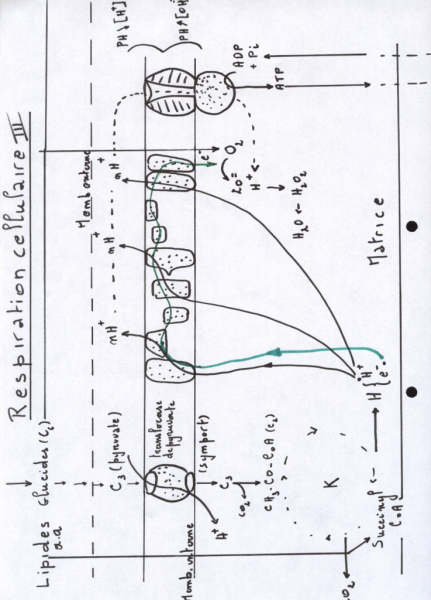
La glycolyse est menée dans le cytoplasme avec production de pyruvate( 2 x C3) et de deux ATP par C6, des équivalents réducteurs (2 X ) sous forme de NADH sont également rendus disponibles
le pyruvate pénètre la mitochondrie et est transformé en AcétylCoA ( Coenzyme ASH + Acétyl issu de la décarcarboxylation de l'acétate) tout en libérant 2xCO2
L'Acétate entre dans le cycle de Krebs avec production de 6 NADH + H+ et FADH2
Chaque équivalent réducteur libère un proton et 2 e- , c'est derniers dévalant la pente d'oxydo-réduction et être accepté par l'O2 , oxydant terminal, de l'eau est formée. avec des H+ (H+ + O2=). Dans le même temps, les chaînes respiratoires possèdent des sites qui permettent la création d'un gradient de H+ ( ptotons en excès dans l'espace inter-membranaire de la mitochondrie ) Ce gradiant est une force "protonmotrice" permettant le fonctionnement de l'ATP synthase et la production d'ATP. Nous verrons en biochimie qu'une môle de Glucose peut produire de 36 à 38 ATP pour l'ensemble du processus de respiration, soit un rendement proche de 40%.

II.8.3.2 Production de précurseurs pour diverses biosynthèses
Lors du déroulement du cycle de Krebs, apparaissent des molécules qui pourront être utilisées pour de nombreuses biosynthèses.
Les biosynthèses se déroulent pour l’essentiel dans le hyaloplasme ; donc, pourront être qualifiée de précurseurs les molécules qui peuvent sortir de la matrice, c’-à-d celles qui possèdent des récepteurs spécifiques sur la membrane interne très imperméable.
- Les principaux précurseurs :
Les précurseurs de la néoglucogénèse
La production de glucose à partir de précurseurs qui ne sont pas des hydrates de carbone ou néoglucogénèse se fait à partir de l’acide oxaloacétique qui passera la membrane transformé en acide malique ou aspartique.
L’acide pyruvique ou l’acide lactique sont à l’origine de l’oxaloacétate, l’acide pyruvique pénètre dans la mitochondrie grâce à un transporteur spécifique ( translocase de pyruvate).
Schéma général ( wikipedia)
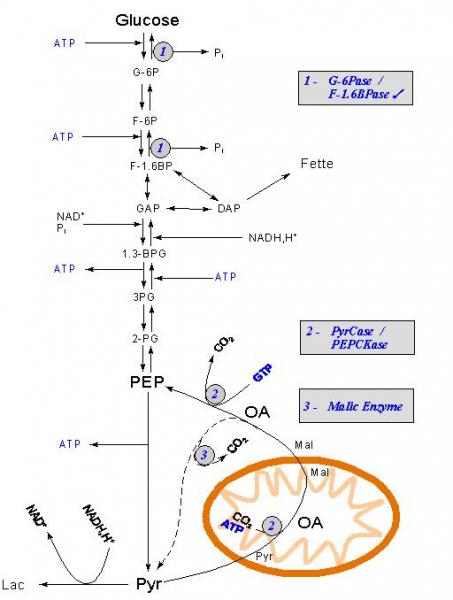

La néoglucogenèse est la formation de glucose à partir de précurseurs non glucidiques tels que le pyruvate, le lactate, le glycérol et la plupart des acides aminés. Chez les animaux supérieurs, elle se produit essentiellement dans le foie et, à un moindre degré dans le cortex rénal. Ses réactions sont les mêmes chez les animaux, les végétaux, les champignons et les micro-organismes.
La conversion du pyruvate en glucose est la voie centrale de la néoglucogenèse, sur ses dix réactions enzymatiques, sept sont des réactions réverses de la glycolyse. Cependant, les trois réactions irréversibles de la glycolyse doivent être remplacées dans la néoglucogenèse afin que la synthèse du glucose soit thermodynamiquement favorable.Les étapes 1, 8 et 10 de la néoglucogenèse sont donc catalysées par des enzymes différentes de celles de la glycolyse : la transformation 1 nécessite plusieurs étapes catalysées par des enzymes mitochondriales et cytosoliques, les réactions 8 et 10 sont des hydrolyses.
Le bilan de la transformation 1 est :
pyruvate + ATP + GTP + HCO3- ---------> phosphoénolpyruvate + ADP + GDP + Pi + H+ + CO2
La néoglucogenèse est énergétiquement coûteuse. Le bilan des réactions de biosynthèse conduisant du pyruvate au glucose est :
2 pyruvate + 4 ATP + 2 GTP + 2 NADH + 4 H2O ---------> Glucose + 4 ADP + 2 GDP + 6 Pi + 2 NAD+ + 2 H+
Ce coût énergétique est nécessaire pour assurer l'irréversibilité de la néoglucogenèse.
Ces réactions se déroulent surtout au niveau du foie.
Précurseurs de la biosynthèse des acides gras
C’est généralement l’acide citrique qui une fois dans le hyaloplasme sera convertit en acétyl-CoA et en oxaloacétate ( voir biochimie)
Précurseurs de l’uréogénèse
Chez les animaux uréotéliques,
Date de dernière mise à jour : 16/06/2020
Ajouter un commentaire

