- Accueil
- D.Sciences biologiques
- I. Biologie cellulaire COMPLET
- Biologie cellulaire 8
Biologie cellulaire 8
II.8 LES MITOCHONDRIES
Comme pour beaucoup de chapitres de ces notes, il est indispensable d’aborder ce sujet conjointement avec l’étude du métabolisme, dans le cas présent, l’étude de la respiration cellulaire.
II.8.1 La structure
Organite du cytoplasme de toutes les cellules des organismes eucaryotes aérobies.
II.8.1.1 Forme
Cette forme est très changeante : déformations , fusions, divisions , augmentation , diminution de volume.
II.8.1.2 Nombre
Dépend de la taille et du type de cellule
II.8.1.3 Morphologie
II.8.1.3.1 Membrane externe : 6 nanomètres d’épaisseur.
II.8.1.3.2 Espace intermembranaire
II.8.1.3.3 Membrane interne : épaisseur, 6 nanomètres : elle forme de nombreux replis orientés vers l’intérieur et qui portent le nom de « crêtes ».
II.8.1.3.3.1 Le nombre de crêtes est variable en fonction du type de cellule : peu dans la cellule végétale, beaucoup dans la fibre musculaire.
II.8.1.3.3.2 La signification métabolique de ceci est que plus la surface membranaire est élevée, plus le métabolisme cellulaire doit être intense.

Miicrophotographie électronique de mitochondriie
II.8.1.3.4 La matrice mitochondriale : Compartiment interne
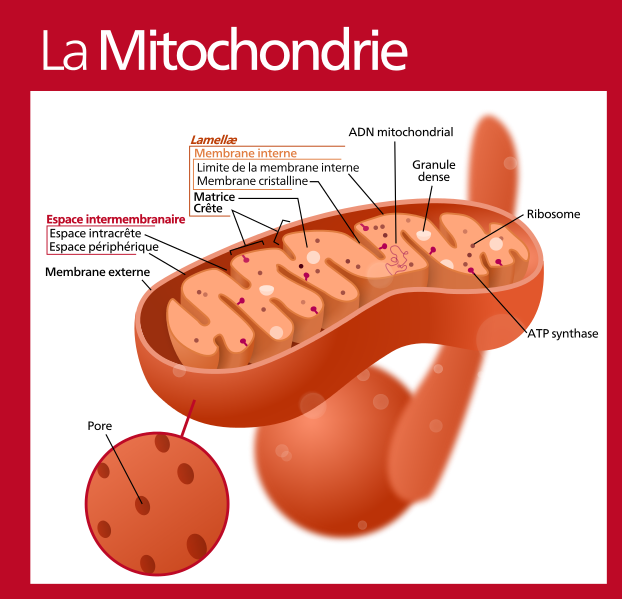
Micro-anatomie de la mitochondrie
II.8.2 La composition chimique
II.8.2.1 La membrane interne
Rapport L/P = 20/80
II.8.2.1.1 La composition en lipides
La composition originale : pas de cholestérol et 20% des phospholipides sont des cardiolipides ou diphosphatidylglycérol à quatre chaînes d’acides gras.
II.8.2.1.2 La composition en protéines
Il existe au moins 60 protéines différentes , les plus abondantes sont des protéines hydrophobes ( 65% des protéines membranaires). Elles peuvent se classer en trois groupes selon leurs rôles physiologiques :
- Les constituants de la chaîne respiratoire et enzymes associées
- Les ATPases
- Les transporteurs spécifiques.
II.8.2.1.2.1 Les constituants de la chaîne respiratoire
Ce sont des transporteurs d’électrons qui catalysent des réactions d’oxydoréduction.
On les divise en deux groupes :
- Les uns transportent simultanément électrons et protons, ce sont des transporteurs d’hydrogène au groupe duquel appartiennent les déshydrogénases flavoprotéiques et l’hydroquinone. La principale : NADH déshydrogénase dont le coenzyme est la flavine mononucléotide ( FMN)
- Les autres ne transportent que des électrons et ce sont des métalloprotéines , cytochromes, protéines fer-soufre en particulier , les cytochromes sont des protéines dont le groupement prosthétique est l’hème ( porphyrine fer ) ( comme l’hémoglobine et la myoglobine). Cinq cytochromes sont intégrés dans la chaîne respiratoire . Les protéines Fe-S interviendraient dans le processus de translocation des protons.
II. 8.2.1.2.2 Les ATPases
L’ATPase mitochondriale responsable de la phosphorylation couplée au transport des électrons devrait plutôt s’appeler ATP synthétase (voir biochimie) .
Il s’agit d’un composant macromoléculaire complexe comportant un peu plus de 20 chaînes polypeptidiques.
Ce complexe se compose de trois parties :
- Une sphère de 9 nanomètres de diamètre qui est la partie catalytique ( matrice).
- Un pédoncule reliant la sphère F1 à la membrane ( matrice )
- Une base F0 hydrophobe fixée dans la membrane
II.8.2.1.2.3 Transporteurs spécifiques
La membrane interne est très imperméable, tous les transports actifs ou passifs sont contrôlés par des canaux ou des transporteurs spécifiques de nature protéique ou glycoprotéique.
Exemples :
le transporteur ADP.ATP, protéine hydrophobe qui couple les mouvements de ces deux nucléotides.
Le transporteur de phosphates ( H2PO4- échangé avec OH-)
Remarques
- Toutes les protéines de membrane ont une position bien déterminée leur fonction en dépend
- Les réactions d’oxydation sont soit des réactions de fixation d’oxygène, soit des départs d’hydrogène, soit des départs d’électrons.
Ces deux derniers cas sont les plus fréquents dans le monde du vivant : des enzymes qui enlèvent à leur substrat des atomes d’hydrogène ou des électrons sont appelés déshydrogénases. Les déshydrogénases ont presque toujours un coenzyme spécifique.
II.8.2.2 La membrane externe
Rapport L/P : 40/60
II.8.2.2.1 Composition lipidique
Peu de cholestérol et beaucoup de phospholipides à chaîne d’acides gras très insaturés ( phosphatidylcholine, phophatidyléthanolamine).
II.8.2.2.2 Composition en protéines
Les enzymes interviennent dans :
- Le métabolisme des lipides
- Une chaîne de transport d’électrons
- Déshydrogénation : la NADH déshydrogénase.
II.8.2.3 L’espace intermembranaire
Cet espace renferme quelque enzymes dont la plus intéressante est l’adénylkinase qui convertit les molécules d’AMP en molécules d’ADP selon la réaction :
AMP + ATP--- 2 ADP
II.8.2.4 La matrice
La matrice contient :
- de nombreux ions et molécules ( en particulier les ions Ca et phosphates )
- des nucléotides ATP et ADP.
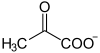
- du Coenzyme A, activateur d’acide gras .
- des métabolites.
- De nombreuses enzymes, lesquelles peuvent être classées en deux groupes : 1) Celles qui participent à l’oxydation de nombreuses molécules. Par exemple : celles qui transforment en acétyl CoA l’acide pyruvique, les acides gras et certains acides aminés, celles qui interviennent dans le cycle des acides tricarboxyliques ou cycle de Krebs . 2) Celles qui interviennent dans la réplication, la transcription et la traduction de l’information mitochondriale . Par exemple : ARN polymérase, ADN polymérase
- L’ADN mitochondrial : Cet ADN et l’ADN nucléaire extrait de mêmes cellules sont différents par leur composition en bases, , leur densité, et ils ne s’hybrident pas.L’ADN mitochondrial porte une information génétique limitée codant pour quelques protéines et ADN mitochondriaux. La particulatité est qu’il existe de nombreuses copies de cette information, il y a donc une amplification du génome mitochondrial. Une mitochondrie possède en général plusieurs molécules d’ADNmt dans sa matrice.
- Les ribosomes mitochondriaux ou mitoribosomes : formés de deux sous unités comme tous les ribosomes mais différents par leur composition. Quand ils synthétisent des chaînes polypeptidiques, les mitoribosomes sont attachés à la face matricielle de la membrane interne.
II.8.3 Les rôles physiologiques
II.8.3.1 Les oxydations respiratoires
Les oxydations respiratoires qui se déroulent dans les mitochondries se déroulent en trois étapes successives :
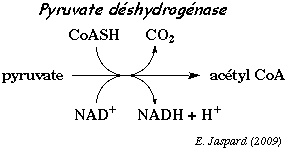
II.8.3.1.1 Oxydation en acétate actif ou acétyl coA de l’acide pyruvique dans la mitochandries et des acides gras provennant successivement de la glycolyse et de l’hydrolyse des lipides , réactions qui se déroulent dans le hyaloplasme.
La pyruvate déshydrogénase est l'enzyme qui catalyse cette réaction de mobilisation de l'AcétylCoA à partir de l'acide pyruvique et du NAD+
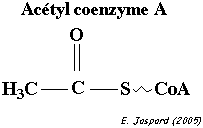
Détails :
- La pyruvate déhydrogénase est un complexe multienzymatique d’un poids moléculaire de 10 millions, accroché à la face interne de la membrane interne de la mitochondrie.
- Sa structure comprend 96 sous-unités, qui catalysent trois activités enzymatiques successives : une décarboxylase, une transacétylase et une déshydrogénase. Elle comprend aussi trois espèces de coenzymes liés : des thiamine pyrophosphates, des lipoamides et des flavines adénine dinucléotides. Son activité fera intervenir des coenzymes libres : NAD et coenzyme A.
- Le substrat initial est le pyruvate qui vient de franchir la membrane interne de la mitochondrie. La décarboxylase liée au TPP, commence par décarboxyler le pyruvate en acétaldéhyde. Il intervient une molécule d’eau pour libérer l’ion bicarbonate. L’acétaldéhyde est aussitôt fixé sur le noyau thiazole du TPP.
- La décarboxylase va transférer cet acétaldéhyde sur le coenzyme lié à la transacétylase (lipoamide). Ce faisant, elle sépare le radical acétyl d’une part et un hydrogène d’autre part qui vont se fixer respectivement sur les deux atomes de soufre. Imaginons que nous hydrolysions la liaison entre le soufre du dernier carbone et le radical : cela donnerait d’une part l’acide acétique et d’autre part le dihydrolipoamide. Ce transfert est donc une oxydoréduction au cours de laquelle l’acétaldéhyde a été oxydé en acide acétique et le lipoamide réduit en dihydrolipoamide. Le potentiel d’oxydoréduction du couple acétaldéhyde/acide acétique (-580 mv) étant très inférieur à celui du couple lipoamide/dihydrolipoamide (-290 mv) une partie de l’énergie produite par cette réaction couplée est conservée dans la liaison acyl-thiol qui unit l’acide acétique au dihydrolipoamide : c’est une liaison riche en énergie.
II.8.3.1.2 Dégradation complète des radicaux acétyls en CO2 et atomes d’hydrogène grâce aux décarboxylations et aux déshydrogénations du cycle de Krebs, le bilan de ce cycle est le suivant :
- 2 atomes de carbone entrés avec le groupement acétyl actif et deux à la sortie sous forme de CO2
- Les 4 réactions d’oxydation par déshydrogénation ont eu pour résultat de transférer trois paires d’ électrons à NAD+ et une paire à FAD.


Cycle de Krebs ou cycle des acides tricarboxyliques
Date de dernière mise à jour : 16/06/2020
Ajouter un commentaire