- Accueil
- D.Sciences biologiques
- I. Biologie cellulaire COMPLET
- biologie cellulaire 7
biologie cellulaire 7
L'énergie est donc obtenue sous deux formes : de l'ATP et du NADH. Ces deux produits interviennent dans différents types de réactions cellulaire, l'ATP apportant l'énergie des réactions endothermiques et le NADH, molécule transporteur d'electrons, pour les réactions d'oxydo-réduction.Le sous produit final, l'acide pyruvique comporte encore beaucoup d'énergie.Toutefois la cellule ne sait pas l'extraire directement, les plus simples choisiront alors de s'en débarrasser dans les réactions de fermentation anaérobies, le rendement n'est alors que de 2% de la totalité de l'énergie du glucose. Une certain nombre de cellules ont cependant développé des moyens de récupérer la totalité de cette énergie disponible en la catabolisant dans le cycle de Krebs puis la chaîne respiratoire, voies complexes n'existant que dans quelques cellules évoluées utilisant l'oxygène; le rendement monte alors à presque 40%, soit près de 20 fois plus que précédemment.Malgré la simplicité de la formule brute, la voie est plus complexe, la cellule ne procède pas en une étape, mais en une dizaine dont seules les dernières produisent de l'énergie (4 ATP), les premières en consomment au contraire (2 ATP). Comme plus d'énergie est produite que consommée, le bilan est positif.
Les Réactions de la voie
Chez toutes les cellules vivantes, cette voie s'effectue en totalité dans le cytoplasme.La première étape de cette voie est,juste après l'entrée du glucose dans la cellule, la phosphorylation de la molécule en Glucose-6-Phosphate par l'hexokinase. Le principal but de cette opération est d'empêcher le glucose de ressortir. En effet, le G6P ne peut parsortir de la cellule, le transporteur membranaire du glucose pourra donc continuer à en faire entrer et celui s'accumulera dans le cytoplasme. Par ailleurs le G6P est le point de départ de la glycolyse mais aussi de la synthèse de l'amidon, du glycogène, de la cellulose et de la chitine. Il est donc au coeur de multiples voies métaboliques. Ensuite, par l'intermédiaire d'une phosphofructoisomérase et d'une phosphofructokinase, le G6P va être converti en fructose-6-P et en fructose-1,6 biphosphate. Sous l'action d'une aldolase, le fructose-1,6-P va être clivé en deux trioses, l'aldéhyde-3-phosphoglycérique (3PG) et la dihydroxyacétone phosphate (DHAP). Seul le 3PG intervient dans la suite des réactions, le DHAP est donc tout d'abord isomérisé en 3PG par une triosephosphate isomérase. A partir de là, il ne faut pas oublier que pour chaque molécule de glucose de départ, les réactions suivantes se produisent en double.
Jusque là, la voie a consommé de l'énergie, à partir de maintenant, elle va en produire. Tout d'abord une oxydation du 3PG en présence de NAD+ et de phosphate va donner sous l'action de la glycéraldéhyde-phosphate deshydrogénase, du 1,3-biphosphoglycérate. Cette réaction très exergonique va produire un NADH et le triose est maintenant bi-phosphaté, le second phosphate est étant réactif. Une première desphosphorylation par la phosphoglycérate kinase va donner du 3-phosphoglycérate (PGA) et convertir une molécule d'ADP en ATP. Une isomérisation par une phosphoglycérate mutase et une deshydratation par une énolase va donner successivement du 2-phosphoglycérate (2-PGA) et du phosphoenol pyruvate (PEP), ce qui amène le phosphate restant dans un état très réactif. Une deuxième déphosphorylation par la pyruvate kinase va permettre de récuperer l'énergie du phosphate sous forme d'ATP et donner le produit final de la voie, le pyruvate.
Les réactions terminales
A partir du pyruvate, plusieurs types de réactions vont pouvoir se produire. Les première sont les fermentations, qui aboutissent à l'alcool ou à l'acide lactique, ne produisent pas d'avantage d'énergie, mais de plus elles consomment le NADH produit, réduisant le bilan global de la réaction. Les principaux inconvenients des fermentations, outre leur faible rendement, est la toxicité des produit finaux. L'acide lactique entraine une acidification du cytoplasme qui devra être compensée et l'alcool est toxique par lui même.La fermentation alcoolique est plutot le fait des microorganisme alors que la lactique se produit chez les animaux. L'acide lactique produit par cette fermentation est responsable de la fatigue musculaire quand son alimentation en oxygène devient insuffisante pour l'effort fourni et qu'il ne peux plus utiliser la voie aérobie. Chez les végétaux, c'est également la fermentation alcoolique qui se produit, toutefois, en cas d'hypoxie, ils commencent par la voie de l'acide lactique qui acidifie le cytoplasme. Cette acidification est responsable d'une part de l'inhibition de la voie lactique et de l'activation de la voie alcoolique.
Le bilan de la dégradation du glucose 6 P en pyruvate est le suivant :
Glucose + 2 ADP + 2 Pi + 2 NAD+ -----> 2 pyruvate + 2 ATP + 2 H2O + 2 NADH
Le bilan de la fermentation alcoolique est :
CH3CO COOH --> CH3CHO + CO2
CH3CHO + NADH + H+ --> CH3CH2OH
Celui de la fermentation lactique est le suivant :
CH3CO COOH + NADH + H+ --> CH3CHOH COOH + NAD+
En résumé :
Les réactions anaérobies de la glycolyse se font en deux étapes successives :
- Dégradation du glucose en deux molécules C3 ( glycéraldéhyde 3 phosphate)
Le glucose 6 P sera d’abord isomérisé en fructose 1-6 P . Ce fructose 1-6 diphosphate se clive ensuite en glycéraldéhyde 3 P.
- Oxydation des glycéraldéhydes 3 P en présence de NAD+ :
Cette réaction couplée à une phosphorylation donnera l’acide diphosphoglycérique qui conduit à l’acide pyruvique.
Bilan énergétique : pour une molécule de glucose dégradée en pyruvate deux molécules d’ATP ont été formées ainsi que deux NADH2
La glycolyse pour pouvoir être entretenue a besoin de NAD+, or sa quantité présente dans le cytoplasme est faible, il faudra donc de manière rapide oxyder le NADH2 .La manière dont les molécules de NAD+ seront régénérées dépendra des conditions dans lesquelles se trouve la cellule .
En présence d’oxygène : l’oxydation est réalisée au niveau des mitochondries, on parle de respiration.
En absence d’ oxygène : la régénération se réalisera par un processus de fermentation.
- Les deux types de fermentation possibles sont la fermentation lactique et la fermentation alcoolique.
Ces réactions sont capables toutes les deux de régénérer 2 NAD+ par molécule de glucose.L’une aboutit à la formation d’acide lactique, l’autre à la formation d’alcool éthylique
II.4.3.2.2 la voie des pentoses
La voie des pentoses phosphates (ou voie du phosphogluconate) génère du NADPH, indispensable aux réactions réductrices de biosynthèse (en particulier, lors de la synthèse des acides gras et des stéroïdes). Cette voie est présente essentiellement dans le cytosol des cellules des glandes mammaires, du tissu adipeux, du foie et du cortex surrénal. outre le NADPH, la voie des pentoses phosphates produit du ribose 5-phosphate précurseur de la synthèse des nucléotides, des acides nucléiques et de coenzymes.
Le glucose 6-phosphate est à la fois le substrat de la voie des pentoses phosphates et celui de la glycolyse ; le choix relatif entre ces deux voies dépend des exigences cellulaires ponctuelles en énergie métabolique (ATP) et en précurseurs biosynthétiques.
La voie des pentoses phosphates se divise en deux parties :
- un segment oxydatif irréversible,
- un segment non oxydatif réversible.
Intérêt de cette voie
Possibilité de réaliser de nombreuses synthèses, particulièrement celle des acides gras Le ribose 5P sera utilisé pour les synthèses de nucléosides.Possibilité d’obtention de sucre en C4 qui interviendra dans la synthése des noyaux benzéniques ou indols.
Nous n'avons pas pour objet, dans ces notes de développer ces métabolismes, mais nous les étudierons en détail dans la rubrique métabolisme du sujet relatif à la biochimie.
II.4.3.2.3 le stockage sous forme de glycogène
Le glucose 6P est d’abord isomérisé en glucose 1P (enz. phosphoglucomutase)
Ce dernier réagit alors avec UTP pour donner UDPG :
Glucose 1P + UTP -------->UDPG + P-P ( UDPG pyrophosphorylase )
L’UDPG, transporteur de glucose va perdre son glucose en se fixant sur une chaîne d’amylose
UDPG + glycogène ---------> UDP + glucose 1,4 - glycogène ( glycogène synthase)
II.4.3.2.4 Signification fonctionnelle de ces voies métaboliques
Les trois voies métaboliques existent simultanément dans le hyaloplasme de toutes les cellules, mais leur importance relative est variable.
Dans la cellule musculaire, prédominance de la glycolyse
Dans les cellules de la glande mammaire, prédominance de la voie des pentoses
Dans la cellule hépatique : le stockage sous forme de glycogène passera en tête.
II.V . LE CYTOSQUELETTE
II.V.1 Préliminaires
II.V 1.1 Cytosquelette : réseau de câbles, de filaments
II.V.1.2 Rôles :
- forme de la cellule.
- contribution au déplacement de la cellule.
- Mouvements internes : contractions et cycloses.
II.V.1.3 Il s’agit d’une structure en équilibre dynamique.
II.V.1.4 Classification. : sur base de l’épaisseur des filaments.
-1) Réseau microtrabéculaire : Très fins filaments déployés comme une toile d’araignée.
-2) Microfilaments : diamètre de l’ordre de 4 à 7 nanomètres.
-3) Filaments intermédiaires : diamètre +/- 10 nanomètres.
-4) Microtubules : diamètre > 25 nanomètres.
II.V.2 Microtubules
II.V.2.1 Structure
II.V.2.1.1 Composition
- Les microtubules sont composées de protéines globulaires appelées :
- Tubulines α
- Tubulines β
II.V.2.1.2 Structuration
- 1) Polymérisation des tubulines en dimères α/β.
- 2) Association des dimères en protofilaments.
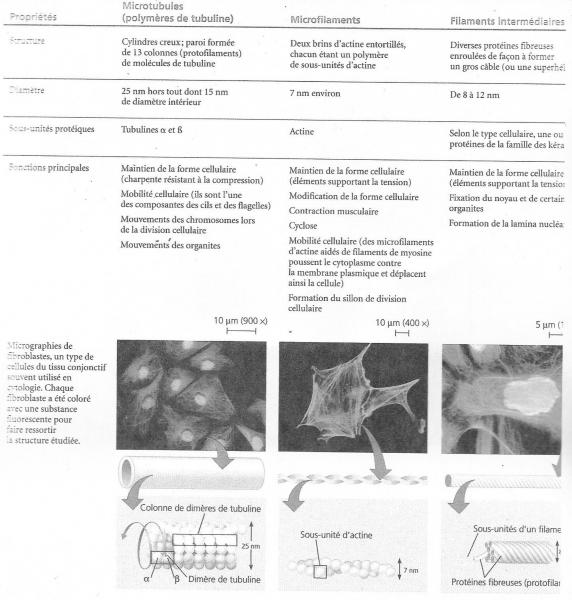
- 3) Groupement par 13 des protofilaments ------> microtubules.
- 4) Association de microtubules par association de 3 protofilaments.
L’association des dimères nécessite un apport énergétique sous forme de GTP.Un microtubule doit donc être considéré comme une concentration en microtubules.Ces dimères sont constamment en équilibre avec la concentration en dimères existant dans le hyaloplasme.C’est de ce rapport que dépendra la stabilité du microtubule.
II.V.2.2 Rôles
- Solidité de la cellule.
- Maintien des organites cellulaires à distance correcte les uns des autres.
- Guide pour le déplacement des vacuoles et des organites.
II.V.2.2.1.1 Protagonistes
Energie chimique = ATP.
Enzyme = protéine fibrillaire en forme de bras qui a une propriété ATPasique.
II.V.2.3 Lieu de formation des microtubules
Il existe dans le cytoplasme des régions riches en dimères et en morceaux de microtubules, ce sont les centres organisateurs des microtubules.
Exemples :
- autour de centrioles.
- autour des centromères des centrioles.
La disposition des microtubules varie en fonction des différentes phases du cycle cellulaire.
II.V.2.4 Les édifices formés à partir des microtubules.
II.V.2.4.1 Les centrioles
II.V.2.4.2 Axonème des cils et flagelles
II.V.2.4.2.1 Structure
Ces prolongements cellulaires ont la même structure de base ; la seule différence porte sur leur longueur :
Cils : 5 à 10 μ de long. Flagelles : plus de 10 μ
Les flagelles et les cils sont des expansions membranaires extracellulaires qui possèdent la propriété de battre. La différence entre les deux structures est la taille qui conditionne le mode de fonctionnement : le flagelle est plus long que la longueur d'onde du battement, il ondule; le cil est plus court, il bat. La forme du flagelle est assurés par une charpente de microtubules, l'axonème au coeur de l'expansion membranaire. Le centre est occupé par un doublet de microtubules enveloppé d'un manchon protéique. Ce doublet est entouré d'un cylindre de 9 doublets de microtubules partiellement fusionnés. Ces doublets sont reliés entre eux par des bras de dynéine et avec le doublet central par les bras rayonnants. À la base du flagelle, dans le cytoplasme, se trouve le corps basal. Il est constitué de 9 triplets de microtubules disposés en cylindre. De microtubules de chaque triplet sont en continuité avec ceux des doublets periphériques de l'axonème, le doublet central s'arrête à la limite du cytoplasme et n'arrive pas au corps basal. Les flagelles battent par glissement des doublets de microtubules entre eux. C'est la dynéine, qui en hydrolysant l'ATP, assure ce glissement. L'axonème étant cylindrique et le glissement se produisant dans le même sens relatif pour tous les doublets, la structure devrait se vriller. Ce sont les autres proétines qui transforment ce vrillage en battement.

Structure 9 +2 des Flagelles
En résumé
L’axonème comporte 9 paires de microtubules situés en périphérie non loin de la membrane plasmique et régulièrement espacés . Ce sont en définitive les prolongements de deux des microtubules de chaque triplet d’une centriole située à la base et appelé corpuscule basal ou cinétosome
En plus on trouve une paire de microtubules issus de la plaque basale, centre organisateur.
Tout cet édifice est consolidé par des fibres et des lames rayonnantes de nature protéique.
II.V.2.4.2.2 Rôles
Par leurs battements de type pendulaire pour les cils et de type ondulant pour les flagelles, ces prolongements provoquent :
- Un déplacement du liquide extracellulaire par rapport à la cellule : la cellule nage si elle est libre et suffisamment petite.
- Un déplacement du liquide extracellulaire si la cellule est fixe ( épithéliums cilifères).
II.V.3 Les microfilaments
Ce type de filaments se trouve dans toutes les cellules mais en grande quantité dans les cellules et fibres musculaires.
II.V.3.1 : La fibre musculaire striée sera prise en exemple
Voir schéma de la fibre et d’une coupe cavalière donnant l’organisation générale
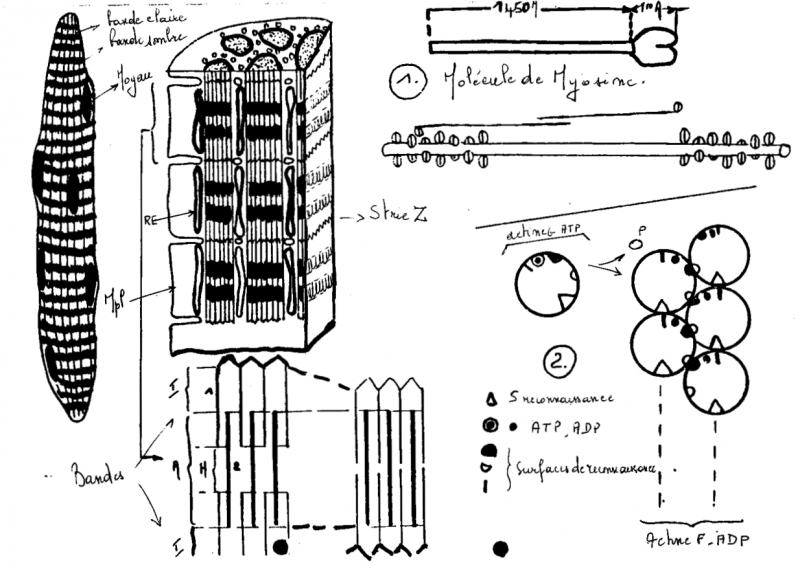
II.V.3.1.1 Structure
Les myofibrilles représentent les parties contractiles de la fibre.
Structure des myofibrilles : Les myofibrilles sont constituées de deux types de filaments appelés myofilaments.
II.V.3.1.1.1 Les myofilaments fins
- 5 nanomètres de diamètre
- Ce sont des filaments d’actine.
L’ actine est une protéine globulaire liée à une molécule d’ATP.
En solution aqueuse et en absence de sel, les molécules d’actine sont isolée, on parlera d’actine G .
En ajoutant des sels à cette solution, il se formera un polymère fibreux d’actine F , dans ce polymère, les molécules d’actine se disposent comme les perles d’un collier, constituant de la sorte deux brins torsadés en une hélice dont le pas est de 70 nanomètres.

Les nucléotides associés à l’actine doivent être considéré comme des régulateurs allostériques.
Pour former le myofilament fin, l’actine sera associée à deux autres protéines, la troponine et la tropomyosine . Ces détails seront vus en physiologie musculaire.

Myofilament fin ( actine, troponine, tropomyosine. )
II.V.3.1.1.2 Les myofilaments épais
Structure des filaments épais :
Ce sont des empilements de 300 à 400 molécules de myosine.
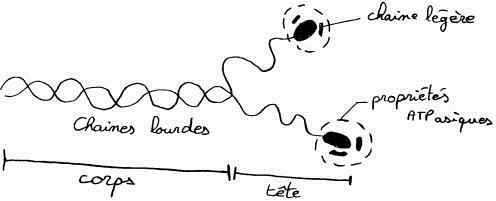
Il y a deux chaînes lourdes et 4 chaînes légères. Les molécules sont empilées tête-bêche.
Chaque molécule de myosine étant constituée de 6 polypeptides, 2 chaînes lourdes et 4 chaînes légères. Les chaînes légères étant responsables de l'activité ATPasique .
Les filaments minces sont attachés aux disques Z de part et d'autre du sarcomère, ils s'étendent vers l'intérieur de celui-ci et chevauchent les filaments épais au milieu du sarcomère.
Chaque molécule de myosine est formée de 2 chaînes lourdes identiques et de 2 paires de chaînes légères. Les deux chaînes lourdes de la myosine sont accolées l'une à l'autre : leur longue queue forme un axe torsadé, et leur pôle globulaire émerge du filament épais sous la forme d'une tête double. L'émergence des têtes de myosine se fait selon une disposition générale ayant l'apparence d'un pas de vis. La partie distale des têtes de myosine possède deux sites de fixation, l'un pour l'ATP et l'autre pour l'actine. La tête de myosine possède une activité ATPasique activée au contact de l'actine.
II.V.3.2 Contraction musculaire
Voir schéma
Voir physiologie animale pour ce qui est du mécanisme
II.V.4 Les filaments intermédiaires.
V.4.1 Classification.
Le diamètre est de plus ou moins 10 nanomètres
Suivant les types de cellules , on les classe en quatre groupes.
1) Les filaments de kératine : abondant au niveau des cellules de l’épiderme des vertébrés. Auusi au niveau des desmosomes.
2) Les neurofilaments : dans les cellules nerveuses, ils sont soit séparés les uns des autres, soit rassemblés en faisceaux ou neurofibrilles.
3) Les filaments gliaux : dans les cellules gliales.
4) Les filaments à trois types de protéines : beaucoup plus ubiquistes, d’une façon générale, tous ces filaments formés de protéines ont des propriétés communes :
Ce sont toutes des protéines fibreuses
Les conditions de polymérisation sont très voisines
Elles possèdent toutes des sites de phosphorylation pour protéines kinases AMPc dépendantes.
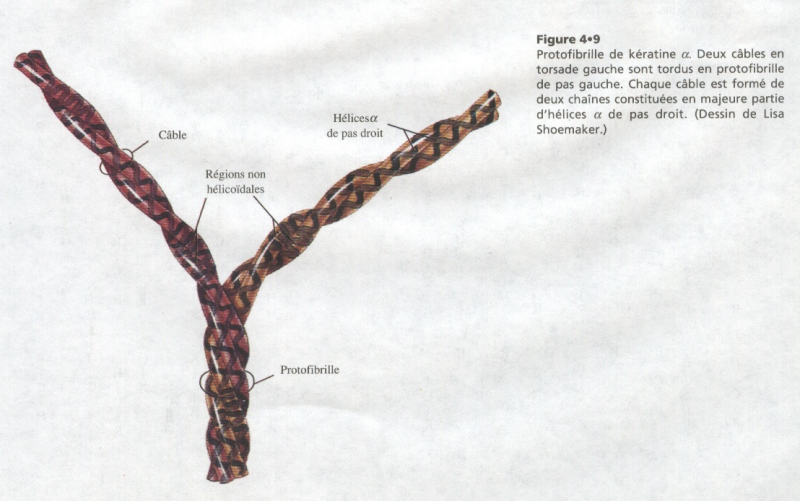
II.V.4.2 Exemple : le filament de kératine ou tonofilament
Structure :
Deux types de kératines qui sont des protéines fibreuses dont la région centrale a une structure en hélice α et les extrémités déroulées… Ces kératines sont pauvres en Soufre.
Elles sont associées par deux en sous unités , les régions α étant spiralées l’une autour de l’autre.
II.V.4.3 Exemple : Le desmosome
Le desmosome est une jonction permettant, comme nous l’avons vu, à deux cellules d’adhérer l’une à l’autre.
L’espace intercellulaire présente une largeur de plus ou moins 20 nanomètres et on y distingue un matériel opaque.
Les membranes plasmiques voisines sont rectiligne et parallèles et sont recouvertes sur leur face intracellulaire d’un matériel dense ou plaque vers laquelle convergent les faisceaux de tonofilaments.
Dans le cas des cellules intestinales , les desmosomes ont une forme de disque et forment une bande continue autour des cellules ( zonula occludens).
II.V.5 Le réseau microtrabéculaire
Il est à l’image d’un os spongieux, il est tridimensionnel et est en contact avec le réticulum, les organites à l’exception des mitochondries
Rôle :
Il s’agirait d’une infrastructure spatiale favorisant les rencontres entre les enzymes, ribosomes et leur substrat en des endroits privilégiés.
Ils seraient doués d’une mémoire des formes.
- Réseau microtrabéculaire
Il existerait dans la cellule un tout autre type de réseau que celui constitué par les microtubules, microfilaments, et les filaments intermédiaires. Ce micro réseau de nature particulière serait à l'origine de la consistance gélatineuse de la cellule et permettrait la fixation des ribosomes fixés à lui et accompagnés par les enzymes solubles du cytosol. Composé par un réseau complexe de bâtonnets qui traversent de part en part le cytosol, le squelette de la cellule, cytosquelette, permet de soutenir celle-ci et de participer à ces mouvements. Il s'agit en quelque sorte de sa musculature composée de trois types de bâtonnets qui sont les microtubules les microfilaments et les filaments intermédiaires.
II.VI LES LYSOSOMES
II.6.1 Structure.
Les lysosomes sont des structures qui contiennent un mélange d’une cinquantaine d’hydrolases acides ( activité optimale pour pH compris entre 3 et 6 ).
Exemples d’hydrolases présentes au niveau du lysosome :
Phosphatase acide.
Protéinases, une dizaine dont la cathepsine
Lipases
Osidases
Nucléases, ribonucléases.
II.6.2 La membrane
Similaire à la membrane golgienne, avec un renforcement en protéines non attaquées par les hydrolases.
Présente également des pompes à H+ ( ATPases ).
II.6.3 Nombre , taille, contenu
Grand polymorphisme, variation en fonction type de cellule et de l’état physiologique de la cellule.
II.6.4 Catégories
Deux catégories :
- Lysosomes d’un diamètre compris entre 25nm et 0,1 μ : ce sont des lysosomes primaires (I),organismes néoformés qui ne sont pas encore intervenus dan des phénomènes de dégration.
- les lysosomes de diamètre supérieur à 0,1 μ : ce sont des lysosomes secondaires (II) ou vacuoles digestives. Présence des hydrolases plus un substrat. Ils parviennent des vacuoles phagogytaires , ou de partie du cytoplasme limité par une membrane, dans lesquelles se déversent les enzymes de lysosome primaire.
Ainsi, en fonction de leur origine, on distingue :
Les vacuoles digestives résultat de la fusion de la fusion de membrane d‘ un hétérophagosome et d’un lysosome primaire.
Les cytolysomes ( vacuole autophagiques) résultant de cette région du cytoplasme isolée par une memrane ( autophagosome et d’un lysosome primaire.
II.6.5 Les rôles physiologiques
Les deux rôles physiologiques sont :
- Digestion des substrats
- Stockage des substrat ( plantes seulement).
II.6.5.1 La digestion
Plusieurs cas doivent être envisagés :
- La digestion intracellulaire, par autophagie ou par hétérophagie.
- La digestion extracellulaire.
II.6.5.1.1 La digestion intracellulaire : hétérophagie
L’acidité intérieure du lysosome constitue un facteur de dénaturation des protéines , elles sont ainsi, préparées à l’action des protéinases non dénaturées en milieu acide.
Une remontée du pH pourra donc provoquer une diminution de l’activité lysosomiale. Ce cas peut se présenter lorsqu’il y a de trop nombreuses désaminations dans la cellule ( Libération de beaucoup de NH4+ ).
Au fur et à mesure que le processus de digestion se poursuit , sortent du lysosome ( transport actifs) des acides aminés, des acides gras, des sucres en C3
Par contre, l’eau rentrera dans le lysosome ( forces osmotiques ).
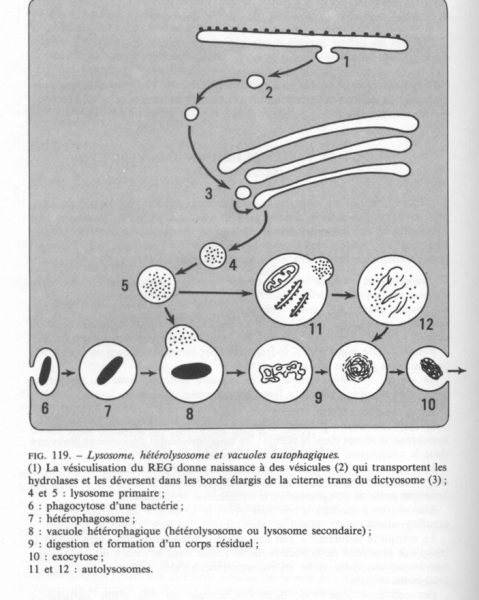
Les principales phases de l’hétérophagie :voir schéma ci-dessus
Les fonctions assurées par l’hétérophagie
1) la défense contre les microbes : Ce type de défense est en partie assumée par les granulocytes qui phagocytent les bactéries.
2) La nutrition : la nutrition de divers organismes se fait pat hétérophagie, c’est le cas de nombreux protozoaires. C’est également le cas chez certains vertébrés comme les poissons chez qui les entérocytes terminent la digestion des protéines.
3) La réabsorption de protéines et leur destruction par hétérophagie.
- Dans le rein, les molécules protéiques qui ont filtré dans l’espace urinaire, au niveau du glomérule ( PM < 40.000) sont reprises par les cellules du tube contourné proximal.
- Dans le foie : des protéines retirées du plasma sanguin et dégradées par un processus hétérophagique classique.
- Dans la thyroïde , production d’hormones par les cellules des follicules thyroïdiens (voir physiologie).
II.6.5.1.2 Digestion intra cellulaire en autophagie
Il s’agit cette fois de digestion de substrat d’origine endogène.
Le schéma ci-desus repren les deux cas : hétérophagie et autophagie
Dans ces cas les lysosomes porterons le nom de vacuoles autophagiques.
La formation des vacuoles autophagiques peut se faire selon des processus différents :
- Premier cas, lame ou plusieurs lames du REL qui se referment sur elles mêmes pour isoler une partie du cytoplasme contenant divers organites ou particules ( ribosomes, mitochondries, particules de glycogène.).Les hydrolases lysosomiales seront alors déversées dans le compartiment séquèstré qui devient une vacuole autophagique.
- Second cas La vacuole autophagique se formera par invagination de la surface d’un lysosome.
Par ces deux modes d’autophagie, les cellules détruisent ceux de leurs constituants qui ne sont plus nécessaires à la réalisation de certains travaux.Cest le cas notamment des tissus et des organes qui involuent lors de la métamorphose des insectes et des amphibiens ( phénomènes d’hystolyse)
Remarque, il existe aussi le phénomène de crinophagie qui n’est qu’un cas particulier d’autophagie permettant de réguler certaines sécrétions ( sécrétion de prolactine par l’adéno hypophyse).
La digestion extracellulaire
La digestion extracellulaire par des enzymes lysosomiaux intervient par exemple dans le remodelage des os et du cartilage des vertébrés .
Chez les vertébrés, c’est la matrice extracellulaire des tissus qui est digérée par les hydrolases émises par les chondrocytes et les ostéoclastes.
II.6.5.2 Les stockages temporaires de réserves
Une partie des matériaux stockés dans les graines des plantes s’accumulent à l’intérieur des vacuoles qui se transforment engrains de réserve appelés grains d’aleurone.
II.6.6 Lysosomes et pathologie
Processus pathologiques : deux cas :
1) Cas des cellules soumises à de mauvaises conditions de vie
Anoxie, anorexie, substances toxiques, irradiations aux rayons X
2) Cas d’un mouvais fonctionnement du lysosome.
2.1 Altération de la membrane du lysosome
2.2 Equipement enzymatique défectueux
Altération de la membrane du lysosome
La membrane devient perméable aux grosses molécules, ce qui entraîne la mort de la cellule mais aussi des substrats situés à son voisinage car la membrane lysée laisse s’échapper dans le voisinage extracellulaire les hydrolases .
Maladies engendrées, la goutte, la silicose
La goutte est un trouble du métabolisme des purines caractérisée par une production excessive d’acide urique.
La concentration d’acide urique dans le plasma est telle que des cristaux d’urate de soude précipitent dans le liquide synovial des articulations.Ces cristaux seront phagocytés et un processus de digestion par les granulocytes pourra être initié.
La silicose est une maladie reconnue comme professionnelle des mineurs et des carriers, elle est provoquée par l’inhalation de particules de silice maintenues en suspension dans l’air qui sont de la sorte entraînées dans les poumons.Là elles sont phagocytées par des macrophages qui assurent une défense bactérienne mais aussi le nettoyage des alvéoles.
Equipement enzymatique défectueux
L’inactivation ou l’absence d’une hydrolase ( mutations) aura pour conséquence la non dégradation d’un substrat et son accumulation dans un corps résiduel.
Au cours du temps les lysosomes secondaires s’hypertrophient et les cellules s’encombrent d’inclusions nombreuses et de grande taille, avec perturbations graves de leur fonctionnement.
Ces phénomènes caractérisent une vingtaine de maladies humaines congénitales appelées maladies de surcharge.
II.6.7 biogénèse des lysosomes
II.6.7.1 Biogénèse des lysosomes primaires , ils prennent naissance soit à partir de l’appareil de Golgi, soit à partir du réticulum endoplasmique lisse.
II.6.7.1.1 Origine golgienne :
Les lysosomes primaires sont des vésicules ou des grains de sécrétion.Ce type de formation s’observe entre autres dans les granulocytes, les macrophages et diverses cellules glandulaires.
II.6.7.1.2 Origine réticulum endoplasmique
Les lysosomes primaires se forment par bourgeonnement de vésicules plus ou moins volumineuses qui se détachent ensuite des lames du réticulum.
Ces régions du réticulum qui émettent ces vésicules sont situés entre la façe de maturation des dictyosomes et les lysosomes primaires nouvellement formés.
Ces régions s’appellent GERL.
Ce type de formation s’observe dans les péricaryons de neurones de mammifères.
II.6.7.2 Biogénèse des lysosomes secondaires
Les lysosomes secondaires se forment par fusion de la membrane des lysosomes primaires avec la membrane limitant un compartiment rempli de substrats.
Pour que cette fusion puisse bien se réaliser, il faut que le cytosquelette de la cellule ( microfilaments, microtubules) soient en parfait état ; danger des poisons métaboliques par exemple.
II.7 LES PEROXYSOMES
Les p&roxysomes sont des organites cytoplasmiques caractérisées par la présence d’enzymes catalysant la production puis la décomposition du péroxyde d’hydrogène .
II.7.1 La structure
Organites de forme sphérique ou ovoïde de 0,2 à 1,7 μ, selon le type de cellule et son état fonctionnel, pourvus d’une matrice homogène ou finement granulaire et d’une membrane tripartite classique.
Le centre des péroxysomes est souvent occupé par un nucléoïde ( cristalloïde) absent chez les primates
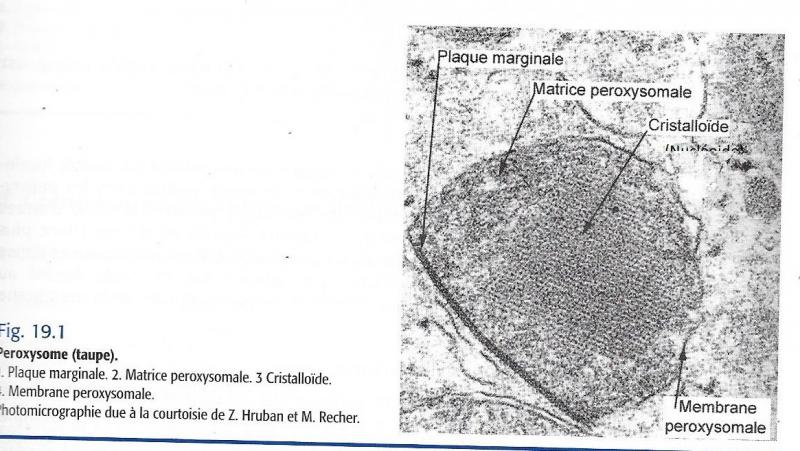
II.7.1.1 La membrane
Epaisseur de 6 nanomètres. Rapport L/P =30/70
Perméable à l’eau et aux petites molécules mais imperméable aux molécules pyrimidiques.
II.7.1.2 La matrice
Renferme des enzymes caractéristiques :
- Oxydases flaviniques
- Péroxydase ou catalase.
Les oxydases flaviniques catalysent l’oxydation des substrats à partir de l’oxygène moléculaire avec production d’eau oxygénée.
La catalase décompose l’eau oxygénée produite par les oxydase flaviniques car cette molécule est toxique pour la cellule.
Les péroxysomes sont dispersé dans le hyaloplasme et parfois associés à d’autres organites ou inclusions cytoplasmiques ( mitochondries, glicolipides…).Ces relations anatomiques traduisent des relations fonctionnelles .
II.7.2 Les rôles physiologiques
En plus de leurs spécificités dues à la présence d’enzymes caractéristiques, les péroxysomes interviennent aussi dans certaines voies métaboliques qui ne sont pas les mêmes selon les types cellulaires et les types d’organismes et qui mettent parfois d’autres organites en jeu.
II.7.2.1 Le catabolisme des purines
Hydrolyse des acides nucléiques par les nucléases , libère les bases puriques et pyrimidiques
Ces bases seront réutilisées pour de nouvelles synthèses soit dégradées à leur tour.
II.7.2.2 Le métabolisme des lipides
Ils participent comme les mitochondries à la dégradation des acides gras par oxydation, mais de plus chez certains organismes , ils renferment des enzymes qui catalysent la production d’acides dicarboxyliques qui seront transférés dans les mitochondries ; ces diacides rechargent le cycle de krebs, précurseur de la néoglucogénèse ( important chez les végétaux ).
II.7.3 Biogénèse.
Les péroxysomes se forment par bourgeonnement à partir des lames du réticulum endoplasmique lisse.
Les protéines de la matrice sont synthétisées par des polysomes (groupe de ribosomes) libres . Après leur traduction les chaînes polypeptidiques sont transférées à l’intérieur des bourgeons . les transporteurs spécifiques quant à eux sont synthétisés dans le REG et transférés dans le bourgeon.
La durée de vie d’un péroxysome est de quelque jours, il sera ensuite détruit par autophagie.
Date de dernière mise à jour : 16/06/2020
Ajouter un commentaire



