- Accueil
- D.Sciences biologiques
- I. Biologie cellulaire COMPLET
- Biologie cellulaire 10
Biologie cellulaire 10
Précurseurs de la biosynthèse des acides gras
C’est généralement l’acide citrique qui une fois dans le hyaloplasme sera convertit en acétyl-CoA et en oxaloacétate ( voir biochimie)
Précurseurs de l’uréogénèse
Chez les animaux uréotéliques, NH3 provenant de la dégradation des acides aminés est transformé en urée dans les hépatocytes. Le cycle de l’urée, le cycle de Krebs et la phosphorylation oxydative sont étroitement liés.
a) Présentation générale de l'ammoniogénèse et du transport de l'ammoniac.
Acide aminé------------------> NH3 ( ammoniac ) ----------------------------->transport ammoniac
a.1 La formation de l'ammoniac à partir des acides aminés s'effectue selon deux voies :
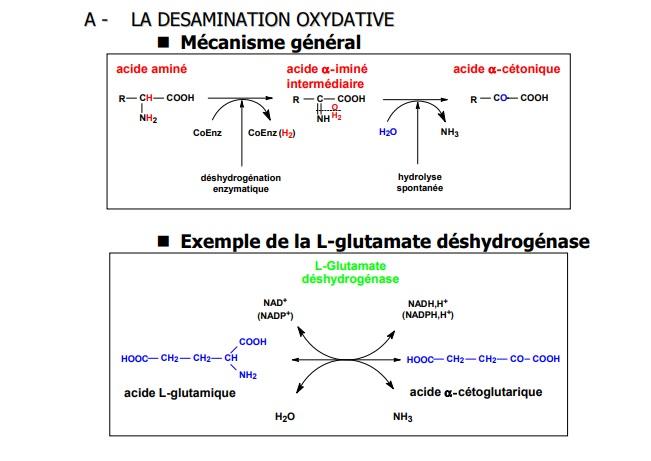
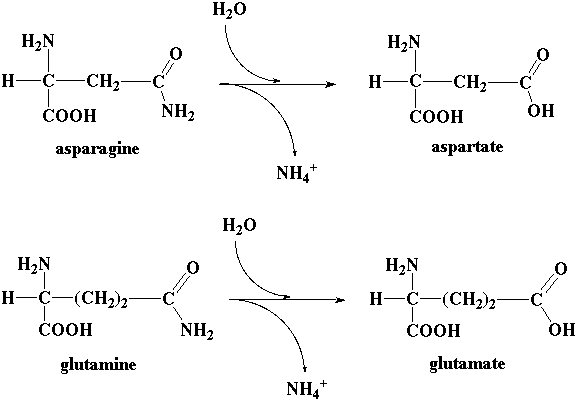
- De manière prédominante, par désamiNation directe qui libère un acide alpha-cétonique et de l'ammoniac. Dans le cas de l'Asn et de la Gln, il existe une réaction supplémentaire de désamiDation ;
 désamination directe oxydative
désamination directe oxydative
Il existe 2 cas particuliers : il s'agit des 2 acides aminés à fonction alcool (Ser et Thr), pour lesquels la perte du groupement aminé se fait par désamiNation non oxydative, catalysée par la sérine déshydratase et la thréonine déshydratase.
- l'autre voie est une transamination réverse qui aboutit au glutamate. Puis la glutamate déshydrogénase catalyse la réaction de formation de NH3 et d'alpha-cétoglutarate en présence de NAD (phosphorylé ou pas selon les organismes).
La désamination non oxydative ou désamidation
L'asparagine et la glutamine contiennent une fonction amide portée par leur chaîne latérale. Il existe 2 enzymes très répandues, l'asparaginase et la glutaminase qui catalysent la réaction de désamidation respectivement de l'asparagine et de la glutamine.
le carboxylate du glutamate est phosphorylé par l'ATP en alpha-glutamyl phosphate, qui est beaucoup plus réactif que le glutamate ;
l'attaque du groupement phosphate par un puissant nucléophile comme l'atome d'azote porté par l'ammoniac aboutit à la formation de la glutamine.
Chez les Mammifères
La glutamine, l' acide aminé le plus concentré dans le sang (450 à 600 µM), sert de "transporteur" de l'ammoniac jusqu'au foie ou jusqu'aux reins. Dans chacun de ces organes, la glutaminase libére l'ammoniac de la glutamine par désamiDation.
Au niveau des reins, l'ammoniac est éliminé dans l'urine sous forme d'ions ammonium. Cette élimination est d'autant plus importante qu'elle permet non seulement d'éliminer l'ammoniac mais aussi une grande quantité d'ions H+ formés au cours de diverses réactions métaboliques.
Dans le foie l'ammoniac va être transformé en urée : c'est ce que l'on appelle l'uréogenèse ou cycle de l'urée. L'urée est ensuite véhiculée par la circulation jusqu'aux reins d'où elle est éliminée par l'urine.
a.2. Uréogénèse
Cycle de l’urée
Le cycle de l'urée prend en charge l'ammoniac issu de la dégradation des groupements azotés des acides aminés.
Il fût élucidé par Hans KREBS et Kurt HENSELEIT en 1932 peu de temps avant la description du cycle du citrate (cycle des acides tricarboxylique ou de krebs).par Hans Krebs
4. Le cycle de l'urée. Présentation générale :
Chez les Mammifères ce cycle se déroule uniquement dans le foie.
Deux des cinq réactions ont lieu dans la mitochondrie, les trois autres se déroulent dans le cytosol.
Ainsi le fonctionnement du cycle de l'urée requiert la présence de deux transporteurs entre la matrice mitochondriale et le cytosol :
le transporteur citrulline - ornithine ;
la translocase glutamate - aspartate
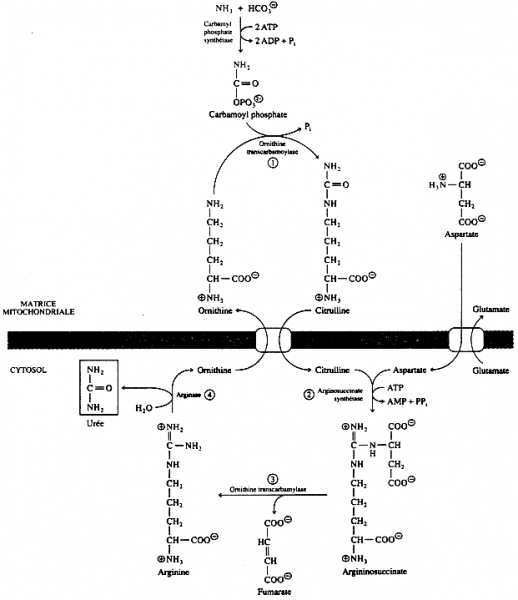
le cycle de l'urée prend en charge l'ammoniac issu de la dégradation des groupements azotés des acides aminés ; chez les Mammifères ce cycle se déroule uniquement dans le foie ;deux des cinq réactions ont lieu dans la mitochondrie, les trois autres se déroulent dans le cytosol ;ainsi le fonctionnement du cycle de l'urée requiert la présence de deux transporteurs entre la matrice mitochondriale et le cytosol : le transporteur citrulline - ornithine et la translocase glutamate - aspartate.
formation de carbamylphosphatea)
le groupe phosphate d'une 1ère molécule d'ATP réagit avec le bicarbonate pour former du carbonyl phosphate ;
l'attaque nucléophile de l'azote de l'ammoniac déplace le phosphate pour former un intermédiaire tétrahédrique ;
cet intermédiaire est déphosphorylé pour former du carbamate ;
enfin, le groupe phosphate d'une seconde molécule d'ATP est transféré pour former le carbamylphosphate ;
l'enzyme qui catalyse cette réaction est la carbamyl phosphate synthétase. Cette enzyme est l'une des enzymes prépondérantes des cellules hépatiques.
Krebs et Henseleit avaient remarqué que la synthèse d'urée augmentait trés sensiblement en présence d'ornithine : en effet, le groupe carbonyle du carbamyl phosphate subit une attaque nucléophile par l'azote du groupe aminé de l'ornithine ;
par réarrangement interne de l'intermédiaire formé, il y a libération de phosphate inorganique et de citrulline ;
cette réaction est catalysée par l'ornithine transcarbamylase.
c) synthèse de l'arginosuccinate
le carbonyle du groupement amide de la citrulline se condense avec la partie AMP d'une molécule d'ATP pour former la cytrullyl-AMP ;
cet AMP est chassé par l'attaque nucléophile de l'azote du groupement aminé de l'aspartate. Il en résulte la formation d'arginosuccinate ;
l'aspartate provient essentiellement de l'alanine formée dans le muscle par transamination du pyruvate ;
cette réaction est catalysée par l'arginosuccinate synthétase.
cette réaction correspond à la scission de l'arginosuccinate en arginine et fumarate ;
le fumarate est converti en glucose et CO2 ;
la réaction est catalysée par l'arginosuccinate lyase.
la dernière réaction correspond à l'hydrolyse du groupement guanidinium de l'arginine qui forme l'urée ;
l'ornithine libérée entre dans un nouveau cycle pour réagir avec le carbamyl phosphate ;
la réaction est catalysée par l'arginase.
5. Bilan de la synthèse de l'urée et conclusion.
CO2 + NH4+ + 3 ATP + Asp + 2 H2O -------> URÉE + 2 ADP + 2 Pi + AMP + PPi + fumarate
un atome d'azote de l'urée provient de l'ammoniac, l'autre de l'aspartate ;
presque tous les acides aminés servent de donneurs de groupe aminé en formant du glutamate par transamination ;
chez l'homme, il est extrèmement important qu'il y ait un apport d'arginine par l'alimentation. En effet, la quantité qu'il est capable de synthétiser est insuffisante pour entrer dans la composition des protéines et servir à la production d'urée ;
enfin, si l'on revient au cycle général du devenir de l'azote, celui-ci est rejeté dans la biosphère après dénitrification par des bactéries.
Le catabolisme de l'ensemble des squelettes carbonés des 20 acides aminés est canalisé en :
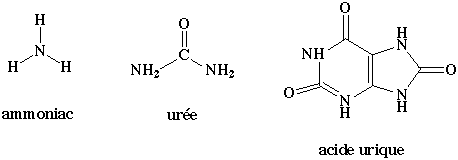
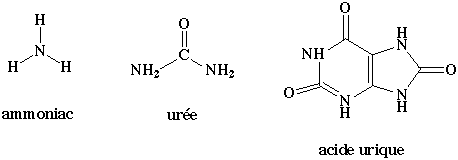
a) Du fait de la petite taille et de la grande solubilité de l'ammoniac, les poissons et beaucoup d'animaux aquatiques éliminent l'azote aminé sous cette forme.
b) L'homme et les mammifères éliminent l'azote sous forme d'urée, dont la toxicité est environ 100.000 fois plus faible que celle de l'ammoniac.
c) Les oiseaux et les reptiles terrestres éliminent l'azote sous forme d'acide urique.
II.8.3.2.4 Précurseurs de la biosynthèse d’acides aminés
Le précurseur est l’acide α-cétoglutarique ,qui peut générer par exemple l’ ac. Glutamique, glutamine, proline, alanine et acide aspartique. ces acides aminés sont qualifiés de non essentiels. Les acides aminés sont au nombre de 20 et l'on pourrait s'attendre à un nombre extrèmement grand de voies de biosynthèse de ces composés :
en fait, la cellule a adopté une stratégie qui repose sur des mécanismes communs à plusieurs acides aminés : ainsi, l'on a des branchements à partir d'un intermédiaire commun ;
par ailleurs, les acides aminés ont pour précurseurs des métabolites issus des grandes voies métaboliques comme la glycolyse, le cycle des acides tricarboxyliques, ou la voie des pentoses phosphates ;
enfin, une autre caractéristique de la synthèse des acides aminés est la rétroinhibition par les produits finaux des enzymes intermédiaires et le plus souvent de l'enzyme qui catalyse la première étape commune à un groupe d'acides aminés.
La plupart des chimiotrophes, et les mammifères en particulier, ne peuvent synthétiser que 10 des 20 acides aminés : ces acides aminés sont dits non-essentiels (ne).
Pour les 10 autres acides aminés, soit ils ne possèdent pas les enzymes qui les catalysent, soit ceux-ci sont synthétisés en quantité trop minime pour le bon fonctionnement de l'organisme. Ces 10 acides aminés sont dits essentiels (e) et doivent être apportés par l'alimentation.
A l'inverse, les plantes et un bon nombre de microorganismes sont eux capables de synthétiser les 20 acides aminés en utilisant, comme on l'a vu, les oxydes d'azote ou l'ammoniac comme source d'azote.
Enfin, contrairement aux sucres et aux acides gras dont la finalité est essentiellement de servir de combustible à la cellule pour fournir de l'énergie, le but premier des acides aminés est la synthèse de protéines. On peut même à l'inverse souligner que la synthèse des acides aminés nécessite beaucoup d'ATP,
1ère incorporation d'ammoniac : formation du glutamate par la glutamate DH
La première étape de la synthèse des acides aminés est l'assimilation de NH4+.L'une des principales portes d'entrée utilisée par la cellule pour introduire l'ammoniac au coeur du métabolisme des acides aminés est l'amination réductrice de l'a-cétoglutarate en glutamate catalysée par la glutamate déshydrogénase :
la réaction correspond à la condensation d'ammoniac avec le groupe carbonyle de l'?-cétoglutarate pour former un intermédiaire ?-iminium glutarate qui est fixé temporairement à l'enzyme pour être ensuite réduit en glutamate ;
l'a-cétoglutarate provient de l'isocitrate dans le cycle de Krebs ;
le pKa de l'ammoniac est de 9,2 et il existe donc sous forme d'ion ammonium NH4+ au pH physiologique ;
cependant c'est la forme déprotonnée NH3 (qui est fortement nucléophile du fait du doublet porté par l'atome d'azote) qui est l'espèce réactionnelle.
Selon les organismes, cette réaction est catalysée principalement dans un sens ou dans l'autre et utilise un coenzyme particulièr :
chez les plantes et les microorganismes, il y a essentiellement synthèse du glutamate avec utilisation du NADPH,H+;
chez les animaux, il y a essentiellement synthèse de l'a-cétoglutarate avec utilisation du NADH,H+.
Le glutamate joue un rôle prépondérant dans les réactions de transamination.
Nous avons commencé par la synthèse du glutamate car :
c'est l'une des réactions qui permet d'introduire un groupement aminé au sein du métabolisme des acides aminés ;
ce composé va servir de donneur de groupement aminé à un grand nombre d'autres acides aminés, par des réactions de transamination.
En effet, le groupe aminé du glutamate peut être transféré à divers acides ?-cétoniques en formant les acides aminés correspondants. Le tableau suivant résume les acides aminés que l'on obtient :
à partir du glutamate comme acide aminé 1 et d'un acide a-cétonique 1 ;
avec formation d'un acide aminé 2 et d'alpha-cétoglutarate comme acide alpha-cétonique 2.
Le coenzyme de toutes les transaminases est le phosphate de pyridoxal qui forme une base de Schiff avec une lysine du site actif.
Ces réactions de transamination permettent donc de fabriquer un grand nombre d'acide aminés courants. Cependant, dans le cas :
de la lysine, l'acide a-cétonique est instable et la lysine est synthétisée par une autre voie ;
de la thréonine, le rendement de la réaction est trés faible car l'acide a-cétonique correspondant est un trés mauvais substrat de la thréonine transaminase.
On verra que lors de la dégradation des acides aminés, un petit nombre de réactions de transamination produisent du glutamate et de l'aspartate dont le groupe aminé parvient aux voies capable d'éliminer l'azote comme le cycle de l'urée.
: formation de la glutamine à partir du glutamate par la glutamine synthétase. 2ème incorporation d'ammoniac
Une seconde réaction clé dans l'assimilation d'ammoniac correspond à la formation de glutamine à partir de glutamate et d'ammoniac, réaction catalysée par la glutamine synthétase :
Nous avons déjà vu cette réaction pour illustrer le couplage de l'hydrolyse de l'ATP à la biosynthèse d'une molécule :
dans le cas de la glutamine, le carboxylate du glutamate est phosphorylé en ?-glutamyl phosphate, qui est beaucoup plus réactif que le glutamate ;
l'attaque du groupement phosphate par un puissant nucléophile comme l'atome d'azote porté par l'ammoniac aboutit à la formation de la glutamine.
La glutamine synthétase de E. Coli est un excellent exemple pour souligner la régulation à laquelle sont soumises la plupart des enzymes qui interviennent dans la synthèse des acides aminés.En effet cette enzyme est un oligomère de 12 sous-unités identiques qui porte chacune non seulement un site actif mais également des sites de fixation d'inhibiteurs allostériques :
parmi ces inhibiteurs, six possèdent un atome d'azote qui provient du groupement aminé de la glutamine ;
par ailleurs, l'effet inhibiteur est additif, le degré d'inhibition étant d'autant plus élevé que le nombre d'inhibiteur fixé est grand: il s'agit là de rétro-inhibition cumulative.
On comprend plus aisément l'extrème sophistication de la glutamine synthètase en regard des divers rôles de la glutamine au sein de la cellule :
d'une part la formation de la glutamine permet l'assimilation d'un nouvel atome d'azote ;
en second lieu cet atome d'azote du groupement amide porté par la chaîne latérale est le précurseur direct de plusieurs atomes d'azote contenus dans les noyaux des bases puriques et pyrimidiques;
enfin, chez les mammifères, la glutamine qui est l'acide aminé le plus concentré dans le sang (450 à 600 µM) est le principal transporteur d'ion ammonium dans le système circulatoire. La glutamine permet donc de baisser le taux de ce composé extrèmement toxique.
à partir du glutamate.La proline est synthétisée
La synthèse de la proline est une voie qui tout en n'étant pas la plus complexe souligne le nombre important d'étapes que peut nécessiter la synthèse de certains acides aminés, à fortiori si ceux-ci sont cycliques :
la première réaction est catalysée par la a-glutamate kinase qui phosphoryle le glutamate en ?-glutamylphosphate, ce qui correspond à la première réaction de synthèse de la glutamine ;
la seconde réaction fait intervenir le NADH,H+ et déphosphoryle le ?-glutamylphosphate en glutamate ?-semialdéhyde, qui est un intermédiaire dont nous reparlerons lors du cycle de l'urée ;
la troisième réaction est spontanée, ne faisant intervenir aucune enzyme : c'est la cyclisation du glutamate ?-semialdéhyde en base de Schiff interne ;
enfin, une réductase forme la proline qui, selon les organismes, utilise le NADH,H+ ou le NADPH,H+.
: cofacteur issu du glutamateLe glutathion.
a. Le glutathion est un tripeptide formé de glycine, de cystéine et de glutamate. Cependant, il a une particularité : c'est le groupement carboxylique en position ? de la chaîne latérale du glutamate qui établit la liaison peptidique avec la cystéine. C'est donc le ?-glutamyl-cystéinyl-glycine.
b. Le glutathion existe sous forme réduite ou oxydée. La forme oxydée correspond à l'association de 2 molécules de glutathion reliées par un pont disulfure (G-S-S-G). L'enzyme qui catalyse cette réaction est la glutathion réductase :
G-S-S-G + NADPH + H+ <===> 2 G-SH + NADP+
c. L'une de ses fonctions biologiques est l'élimination de produits dérivés de l'oxygène qui sont hautement réactionnels et donc toxiques pour la cellule :
l'anion superoxyde O2°- est transformé en oxygène et peroxyde d'hydrogène par la superoxyde dismutase ;
puis le peroxyde d'hydrogène (H2O2)est éliminé par la catalase ou la glutathion peroxydase selon la réaction :
2 glutathion-SH + H-O-OH -----> glutathion-S-S-glutathion + 2 H2O
: rôle du tétrahydrofolateSynthèse de la glycine à partir de la sérine.
La sérine est synthétisée à partir du 3-phosphoglycérate, lui-même issu de la voie de la glycolyse. Le groupe hydroxyle est transformé en cétone pour donner le 3-phosphohydroxypyruvate qui à son tour subit une transamination avec le glutamate pour former la 3-phosphosérine. Enfin la sérine est formée par la 3-phosphosérine phosphatase.
La sérine est le précurseur direct de la glycine : celle-ci est formée via une réaction réversible catalysée par la sérine hydroxyméthyltransférase. Cette enzyme ne fonctionne qu'en présence de deux cofacteurs : un groupe prosthétique déjà mentionné, le phosphate de pyridoxal et un co-substrat, le tétrahydrofolate.
On peut noter que la glycine est à l'origine de la chlorophylle et de l'hème.
Synthèse de la cystéine à partir de la sérine ou à partir de la méthionine : rôle de la S-adénosylméthionine.
La sérine est le précurseur de la cystéine :
Chez les plantes et les bactéries, la cystéine est formée en deux étapes :
dans un premier temps, le groupe acétyle d'une molécule d'acétyl CoA est transféré au groupement hydroxyle de la sérine pour former la O-acétylsérine ;
ensuite, un groupe sulfure inorganique (S2-) déplace le substituant acétyle pour former la cystéine.
Chez les autres organismes, la cystéine est synthétisée à partie d'un dérivé de la méthionine extrèmement important : la S-adénosylméthionine. La réaction est la suivante :
un groupement adénosyle (adénosine + ribose) de l'ATP est transféré à l'atome de soufre de la méthionine : cette synthèse est particulière car le groupe triphosphate de l'ATP est hydrolysé en phosphate inorganique et en orthophosphate ;
toutes les liaisons phosphore - oxygène de l'ATP étant hydrolysées, la réactivité du groupe méthyle de l'intermédiaire obtenu, la S-adénosylméthionine, est très grande : la S-adénosylméthionine est donc le principal donneur de groupe méthyle dans la cellule ;
ce groupe méthyle est ensuite transféré à un accepteur de groupe méthyle (X) tel que la phosphatidyl éthanolamine pour former la S-adénosylhomocystéine ;
celle-ci est hydrolysée pour former l'homocystéine avec relarguage de l'adénosine ;
enfin, la cystéine est formée (conjointement à l'?-cétobutyrate) par condensation de la sérine avec l'homocystéine.
Aperçu de la synthèse des acides aminés aromatiques.
La synthèse des autres acides aminés, notamment celle des acides aminés aromatiques, est extrèmement complexe, entre autre du fait qu'à partir d'un squelette carboné linéaire, il y a cyclisation ou bien ramification. La première étape de la synthèse de ces acides aminés fait intervenir :
un précurseur issu de la glycolyse : le phosphoénolpyruvate ;
un précurseur issu de la voie des pentoses phosphate : l'érythrose-4-phosphate.
Il s'ensuit une voie commune qui aboutit à la formation du shikimate puis du chorismate. C'est à partir de ce dernier intermédiaire commun que les voies se séparent pour former :
d'une part la phénylalanine et la tyrosine ;
d'autre part le tryptophane. La synthèse de ce dernier est sans doute la plus complexe de tous les acides aminés. Elle fait intervenir une molécule impliquée dans la synthèse de nombreuses autres molécules dont l'histidine : le 5-phosphoribosyl 1-pyrophosphate (PRPP).
On remarquera que la glutamine et/ou le glutamate interviennent dans la synthèse des 3 acides aminés aromatiques.
II.8.3.2.5 La synthèse des protéines
Les mitoribosomes synthétisent 5 à 10 % des protéines mitochondriales, ce qui est quantitativement faible, mais qualitativement essentiel car il s’agit principalement de protéines entrant dans la constitution des chaînes respiratoires.
Il s’agit donc de chaînes polypeptidiques très hydrophobes qui seront enchâssées dans la membrane interne.
II.8.4 Echanges entre la mitochondrie et le hyaloplasme
Tous les échanges qui sont essentiels au métabolisme des cellules aérobies et à sa régulation , sont contrôlés par la membrane interne des mitochondries portant les transporteurs spécifiques. L’énergie libérée par le transport d’électrons et qui est converti en gradient de protons permet en plus de la phosphorylation de l’ADP les transports d’ions et de métabolites à travers la membrane interne contre les gradients de concentration . A remarquer que ces transports sont différents des transports actifs habituels puisque l’énergie nécessaire ne provient pas de l’hydrolyse de l’ATP.
Exemple : transport du Calcium.
II.8.5 Biogénèse
II.8.5.1 Continuité mitochondriale
Les mitochondries se multiplient par le processus de croissance et scission , elles augmentent de taille puis se divisent.
Il y aurait également formation « de novo » et formation à partir de membrane plasmique.
II.8.5.2 Participation respective du génome mitochondrial et du génome nucléaire
Les informations qui permettent la synthèse des constituants mitochondriaux sont codés à la fois par les deux génomes.
II.8.5.3 Synthèse et assemblage des constituants
Les lipides sont synthétisés au niveau du RE lisse du hyaloplasme.
Les protéines proviennent des synthèses réalisées à la fois par les ribosomes et las mitoribosomes.
Ces lipides et protéines sont continuellement renouvellés : demi vie comprise entre trois et dix jours.
II.9 LES PARTICULARITES DE LA CELLULE VEGETALE

II.9.1 Particularités
La cellule végétale présente 5 grandes différences par rapport à la cellule animale.
II.9.1.1 Présence d’une membrane (paroi) cellulosique.
Cette membrane , véritable squelette est surimposée sur la membrane plasmique et sert notamment à protéger la cellule contre les variation de pression osmotique externe
II.9.1.2 Présence de chloroplastes
Les chloroplastes sont des organites présents dans le cytoplasme des cellules eucaryotes photosynthétiques (plantes, algues). Ils sont sensibles aux expositions des différentes ondes du spectre lumineux. Ils jouent un rôle essentiel dans le fonctionnement d'une cellule végétale étant donné qu'ils permettent de capter la lumière à l'origine de la photosynthèse ( que nous étudierons en biochimie et en physiologie végétale). Par l'intermédiaire de la chlorophylle qu'ils possèdent et de leurs ultrastructures, ces organites sont capables de transférer l'énergie véhiculée par les photons à des molécules d'eau. Les chloroplastes jouent un rôle important dans le cycle du carbone, par la transformation du carbone atmosphérique en carbone organique. Les chloroplastes appartiennent à une famille d'organites appelés les plastes ; ceux-ci sont le fruit de l'endosymbiose d'une cyanobactérie, il y a environ 1,5 milliard d'années.

On distingue deux types de thylakoïdes :
- Les thylakoïdes des granums , empilements de cavités closes.
- Les thylakoïdes du stroma, cavités beaucoup plus polymorphes qui s’étandent à tout le stroma.

(1) membrane externe ;
(2) espace intermembranaire ;
(3) membrane interne ;
(4) stroma ;
(5) lumen du thylakoïde ;
(6) membrane du thylakoïde ;
(7) granum (empilement de thylakoïdes) ;
(8) thylakoïde ;
(9) amidon ;
(10) ribosome ;
(11) ADN chloroplastique ;
(12) plastoglobule (gouttelette lipidique).
Dans un chloroplaste, on compte 40 à 60 granums comportant chacun une dizaine de thylakoïdes étroitement accolés.
II.9.1.2.2 Les rôles physiologiques
La photosynthèse ( voir biochimie et physiologie végétale) : La phase lumineuse de la photosynthèse se fait au niveau de la membrane des thylakoïdes, la phase obscure quant à elle se déroule au niveau du stroma.
La synthèse de protéines : Puisqu’il y a de l’ADN et des plastoribosomes, il est normal d’avoir de synthèses de protéines. Ces plastoribosomes synthétisent à la fois des constituants membranaires et des constituants du stroma.
II.9.1.2.3 La biogénèse
Les nombreux chloroplastes soit par division de chloroplastes fonctionnels préexistants , soit par différentiation d’organites précurseurs de petite taille qui se multiplient eux-mêmes par division, les proplastes . Cette différentiation est provoquée par la lumière.
II.9.1.3 Nombreuses vacuoles de la cellule végétale
Elles proviendraient du RE. Nombreuse chez la cellule jeune, elles ont tendance à fusionner en une seule vacuole volumineuse et occupant une position centrale chez la cellule mature.
Fonctions
1. Poussent le cytoplasme vers la périphérie de la cellule
2. Contiennent le liquide cellulaire, principalement constitué d'eau avec des substances dissoutes, qui est hypertonique comparé au milieu externe (le cytoplasme). Par conséquent, l'eau pénètre la vacuole par un processus nommé l'osmose (mouvement d'eau à travers un membrance semi-perméable).
3. Entrepose des substances importantes
4. Site d'entreposage de produits toxiques (par exemple les toxines qui tuent les insectes qui mangent les plantes).
II.9.1.4 Absence fréquente de centrosome.
II.9.1.5 Inclusions inertes spécifiques dans le cytoplasme
Amidon, tanins, cristaux divers (Oxalate, Si...).
II.10. LA BACTERIE – PROCARYOTE (voir microbiologie)
10.1 Les particularités structurales.
II.10.1.1 La paroi cellulaire
Squelette surimposé sur la membrane plasmique et formant une capsule protectrice poreuse. Son rôle étant de protéger la bactérie, qui possède une pression osmotique interne élevée.
II.10.1.1.1 Les constituants chimiques.(voir microbiologie)
Le peptidoglycane
Le peptidoglycane est un polymère complexe formé de 3 éléments différents :
1) une épine dorsale faite d'une alternance de molécules de N-acétylglucosamine et d'acide N-acétylmuramique ;
2) un ensemble de chaînes latérales peptidiques identiques, composées de 4 acides aminés et attachées à l'acide N-acétylmuramique ;
3) un ensemble de « ponts interpeptidiques » identiques ( 5 glycines).
L'épine dorsale est la même pour toutes les espèces bactériennes tandis que les chaînes latérales de tétrapeptides et les ponts interpeptidiques varient d'une espèce à l'autre.
La plupart des chaînes latérales comportent la L-alanine en position 1 (attachée à l'acide N-acétylmuramique), le D-glutamate en position 2, l'acide diamino-pimélique, la lysine ou un autre acide aminé en position 3, et la D-alanine en position 4.
La figure 1 donne une représentation schématique du peptidoglycane chez Staphylococcus aureus. Il faut noter que les ponts interpeptidiques, qui assurent la fermeture de ce véritable « filet » qu'est le peptidoglycane, sont constitués chez Staphylococcus aureus d'une chaîne de 5 molécules de glycine entre la D-alanine terminale et la L-lysine en position 3.
Différences entre bactéries à Gram positif et à Gram négatif
Chez les bactéries à Gram positif,
il y a de nombreuses couches de peptidoglycane qui représentent jusqu'à 90 % des constituants de la paroi bactérienne. Celle-ci contient aussi un feutrage (10 à 50 % du poids sec de la paroi) d'acides teichoïques (polymères du glycérol ou du ribitol phosphate) associés étroitement au peptidoglycane et faisant parfois saillie à la surface de la bactérie. Certains, les acides lipoteichoïques, sont placés transversalement. et s'enfoncent jusqu'à la membrane cytoplasmique. En général il n'y a pas ou peu de protéines dans la paroi des bactéries à Gram positif. Parmi les exceptions, notons la protéine A de Staphylococcus aureus
Chez les bactéries à Gram négatif,
il n'y a qu'une seule ou au plus deux couches de peptidoglycane qui ne représente que 5 à 20 % des constituants de la paroi bactérienne. Mais 3 polymères situés en dehors du peptidoglycane viennent compléter la paroi : des lipoprotéines, une « membrane externe » qui contient du lipopolysaccharide.
Les lipoprotéines sont le lien entre le peptidoglycane et la « membrane externe » : le composant protéine est un polymère de 15 acides aminés qui forme une liaison peptidique avec le tétrapeptide des chaînes latérales du peptidoglycane ; le composant lipide est relié à la « membrane externe ».
La « membrane externe » est constituée d'une double couche de phospholipides dans laquelle tout ou partie des phospholipides de la couche la plus externe sont remplacés par des molécules de lipopolysaccharide. Au sein de cette « membrane externe », qui est une mosaïque fluide, se trouvent associés au moins deux types de protéines spécifiques : certaines sont dites protéines de structure car elles consolident la membrane externe (exemple : OMP-A) ; d'autres, appelées « porines » permettent le passage des petites molécules hydrophiles et en particulier, sur le plan médical, des antibiotiques (ß-lactamines, tétracyclines, quinolones...).
Sur le plan immunologique, le lipopolysaccharide constitue l'antigène O des bactéries à Gram négatif. Le LPS est un lipide complexe auquel est attaché un polysaccharide qui est responsable de la spécificité antigénique de l'antigène O. Sur le plan physiopathologique, le LPS, extrêmement toxique, représente l'endotoxine des bactéries à Gram négatif.
II. 10.1.1.2 Les lipides
- Peu chez les gram+
- Beaucoup chez les gram-
II.10.1.2 L’ADN
L’ équivalent de un chromosome : Chromosome unique circulaire ( environ 1 mm) les bactéries sont donc haploïdes.
Les plasmides : petits éléments circulaires constituant le matériel génétique extra chromosomique , faits d'ADN et portant de l'information génétique. Ils sont autonomes et capables de se répliquer indépendamment du chromosome . Ils codent pour la synthése de différentes protéines enzymatique , conférant ainsi à la bactérie qui les posséde des caractéres particuliers tels que la possibilité d'utiliser tel ou tel substrat ou de résister à certains antibiotiques.
II.10.1.3 Pas de RE, pas d’appareil de Golgi, pas de lysosomes.
Il n’y aura donc pas de glycoprotéines.
II.10.1.4 Absence de mitochondries
L’équivalent des chaînes respiratoires se trouve sur la membrane plasmique, la bactérie est donc sa propre mitochondrie ( argument pour la théorie endosymbiotique).
Date de dernière mise à jour : 16/06/2020
Ajouter un commentaire