- Accueil
- D.Sciences biologiques
- IV.Biologie animale ou zoologie
- 3.embryologie descriptive COMPLET
- EMBRYO DESCRIPTIVE 4
EMBRYO DESCRIPTIVE 4
Conclusion : aspect de l’oeuf après ces premiers mouvements
- les macromères vitellins sont peu à peu recouvert par les macromères du pôle animal sauf au niveau du bouchon vitellin où ils restent visibles.
- Le bouchon vitellin devient de plus en plus petit pour finalement ne donner qu’une fente.
4° Les cellules invaginées vont maintenant subir :
- un mouvement de convergence pour certaines d’entre elles : cordoblaste et mésoblaste des somites se regroupent axialement.
- un mouvement de divergence pour d’autres: le mésoblaste des lames latérales qui vont doubles l’entoblaste
Mouvements morphogénétiques à la gastrulation. A : Vue dorso-végétative d’une gastrula avec indication des mouvements de convergence, élongation, enroulement autour des lèvres blastoporales, et divergence en profondeur. B : Coupe de gastrula âgée lors de l’exten¬sion du mésoblaste et de l’endoblaste. C et D : Mouvements d’extension du mésoblaste, de l’endoblaste (flèches), l’ectoblaste étant supposé enlevé. C vue de l’avant. D: vue de l’arrière.
1. Le territoire cordal étalé sur la surface du germe pénètre dans le blastopore en se compactant pour former la corde longitudinale : CONVERGENCE
2. Le territoire somitique converge également vers le blastopore mais s’étale à l’intérieur et s’insinue entre ectoblaste et entoblaste pour former les lames latérales du mésoblaste.
Fin de gastrulation : eau à +/- 18°C : F + 48 h
Le croissant gris résulte de la réorganisation du cytoplasme de l’oeuf suite à l’entrée du spermatozoïde. La portion de cytoplasme à 180o de l’entrée du spermatozoïde décrit la forme d’un croissant, gris parce que pigmenté. Ce point marque aussi la future face dorsale de l’embryon. Le point d’entrée du spermatozoïde marque donc la future face ventrale. L’axe dorso-ventral est ainsi établi, ainsi que l’axe de symétrie bilatérale, qui coupe ces deux faces. Tout au cours de la segmentation le croissant gris s’estompe.
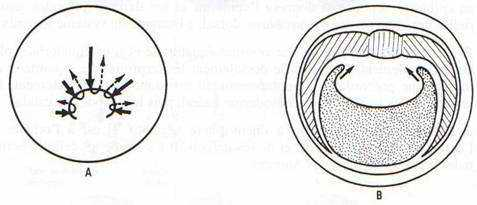
Donc au point du croissant gris, le feuillet de blastomères s’invagine légèrement, invagination prenant la forme d’un sillon horizontal à la surface de l’oeuf: c’est la lèvre dorsale du blastopore (LDB). Au fur et à mesure des mouvements suivants, des lèvres latérales (2) et ventrale (1) se dessineront; il en résultera la formation d’une ouverture ronde, le blastopore.
Alors que s’invagine légèrement le feuillet de blastomères du croissant gris, le feuillet de l’hémisphère animal entreprend un mouvement d’épibolie qui converge vers le blastopore. Quand ces blastomères atteignent la LDB, ils poursuivent leur migration à l’intérieur du blastocoele en glissant sous l’hémisphère animal. Ce faisant, ils repoussent de plus en plus vers l’intérieur les cellules qui formaient initialement la LDB. Ainsi, la LDB est composée de cellules continuellement en changement, car successivement repoussées vers l’intérieur.
Ainsi, les blastomères du plancher du blastocoele qui, à cause de leur taille, étaient incapables de s’invaginer activement, sont maintenant tirés dans le blastocoele par le mouvement d’épibolie des blastomères animaux. Ils sont donc passivement amenés à l’intérieur du blastocoele.
Le front cellulaire d’épibolie progresse sur toute la surface interne du blastocoele et délimite l’archentéron, structure tubulaire à l’intérieur du blastocoele. Comme de plus en plus de cellules pénètrent à l’intérieur du blastocoele, augmentant la taille de l’archentéron, le blastocoele devient graduellement réduit et repoussé à l’antipode du blastopore. L’archentéron se trouve ainsi délimité, dorsalement, par la portion du feuillet animal qui a été internalisée (activement) et, ventralement, par les blastomères végétatifs qui ont été internalisés (passivement).
Le mouvement d’épibolie se poursuit au point que l’archentéron devient oblitéré par le front de cellules, qui forme le bouchon vitellin bouchant le blastopore. Un mouvement d’épibolie des cellules externes les fait recouvrir le bouchon vitellin. Le blastopore n’a plus que l’aspect d’une fente verticale, le futur anus, oblitéré pour le moment. Toutes les cellules qui restent en position externe constituent l’ectoderme.
Les toutes premières cellules à former la LDB, constituant le front de migration, sont des blastomères végétatifs (initialement situés juste sous l’équateur); amenées à l’intérieur de l’embryon, elles formeront une portion de l’épithélium du tube digestif, donc de l’endoderme. Les blastomères suivants, provenant de l’hémisphère animal juste sus l’équateur, sont dits mésoblastiques, précurseurs du mésoderme de la tête. Les prochains blastomères à s’internaliser par la LDB, dits chordomésodermiques, sont à l’origine de la notochorde, structure non retrouvée chez les invertébrés. Les blastomères suivants formeront le reste du mésoderme. Les gros blastomères du plancher de l’archentéron complètent l’épithélium de l’archentéron. Donc pendant un certain temps, le toit de l’archentéron est formé d’un feuillet mésodermique.
Un espace intercellulaire sépare le feuillet ectodermique du feuillet mésodermique dans l’hémisphère animal et du feuillet endo-mésodermique dans l’hémisphère végétatif. Les cellules mésodermiques se détachent et migrent, plus ou moins individuellement, latéralement et ventralement dans cet espace. Ce faisant, l’endoderme referme le toit de l’archentéron. Celui-ci devient donc délimité complètement par l’endoderme. À la fin de la gastrulation, l’embryon comprend les 3 feuillets fondamentaux emboîtés.
La gastrulation amphibienne est donc marquée principalement par des mouvements d’invagination, d’épibolie et de migration. À 18°C elle se produit en 24 heures environ.
Contrairement à l’oursin, chez qui la gastrulation commence au pôle végétatif, la gastrulation amphibienne commence près de l’équateur de la blastula, où les cellules contiennent moins de vitellus que celles du pôle végétatif, quoiqu’elles en contiennent suffisamment pour ne pouvoir s’invaginer significativement.
La LDB marque véritablement le point de départ de la gastrulation. En effet, si la LDB est transplantée dans une autre région de la blastula, la gastrulation pourrait s’amorcer à cet endroit.
Puisque la LDB occupe dans la blastula l’endroit correspondant au croissant gris de l’oeuf fécondé, on a longtemps soupçonné que cette région contenait des facteurs cytoplasmiques capables d’initier la gastrulation. La localisation du blastopore est déterminée par un ou des facteurs dans le cytoplasme interne, plutôt que cortical, de l’oeuf. Les réarrangements du cytoplasme occasionnés par l’entrée du spermatozoïde sont responsables de la distribution asymétrique de facteurs cellulaires. Le facteur initiateur de la gastrulation ne se trouve pas dans les cellules pigmentées du croissant gris mais dans des cellules végétatives profondes. Le facteur en question n’est exprimé qu’à partir d’un certain stade de la segmentation. Les cellules végétatives profondes le contenant induisent les cellules superficielles du croissant gris à initier la gastrulation et à former la face dorsale du corps. Un candidat au titre de facteur initiateur de la gastrulation est l’activine: un facteur de croissance peptidique.
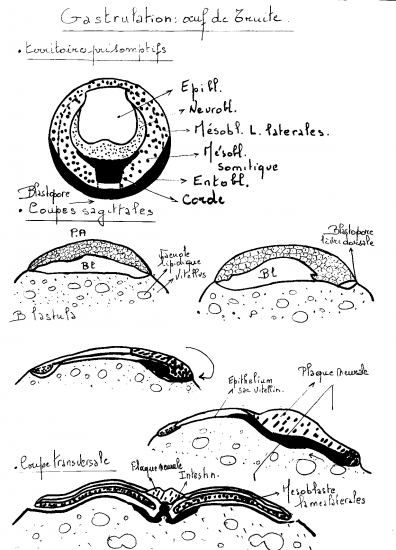
2.4.3 Gastrulation de l’oeuf de Truite
Œuf volumineux, de type télolécithe( 3,5 à 5 mm de diamètre)
Segmentation méroblastique discoïdale
Carte des territoires présomptifs ressemble à celle des amphibiens.
Mouvements de gastrulation similaires à ceux de l’œuf de grenouille ( invagination, élongation, convergence, divergence.).
La présence d’un important vitellus caractérise cependant la gastrulation de l’œuf de truite :
- Invagination des futurs matériaux cordo-mésoblastiques et entoblastique sur tout le pourtour du disque germinatif, avec toutefois une importance variable selon l’emplacement.
- Extension du disque germinatif qui va s’étaler à la surface du vitellus jusqu’à le recouvrir.
Déroulement – phases morphogénétiques
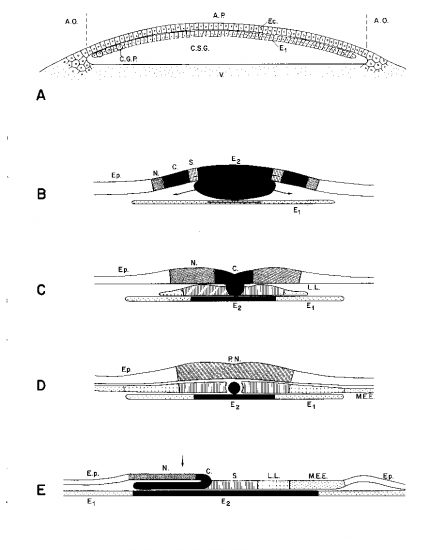
1. Invagination
Apparition d’un point épaissi en bordure du blastodisque, le nœud terminal. C’est la future région médio-dorsale de l’embryon. A ce niveau, l’entoblaste présomptif s’enroule autour d’une sorte de charnière représentée par le bord du blastodisque et s’étale en une lame entoblastique directement à la surface du vitellus. Le futur territoire cordal suit le même mouvement et s’insinue entre l’entoblaste et l’ectoblaste. Le mouvement de gastrulation s’étend latéralement au niveau du matériel somitique puis gagne la partie diamétralement opposée du disque où s’invagine le matériel des lames latérales. Le mouvement d’invagination est maximal au niveau du noeud terminal qui s’allonge progressivement vers l’arrière par convergence du matériel ectoblastique à son niveau, tandis qu’il invagine sous cet ectoblaste, l’entoblaste et la corde.Le nœud terminal constitue donc la zone embryogène qui édifie l’embryon en commençant par la future région céphalique.
2. Extension
Tandis que l’invagination se réalise, le blastodisque s’étend à la surface du vitellus et l’enveloppe progressivement.
Ce bord d’enveloppement constitue donc un véritable blastopore
Qui d’une part enfouit le vitellus dans le germe et d’autre part invagine de façon continue du cordomésoblaste.
Remarque : il n’y a pas formation d’archentéron
2.4.4 La gastrulation aviaire : œuf de poule
oeuf télolécithe;
segmentation partielle, n’affectant que le disque germinal et résultant en la formation d’une discoblastula sur une énorme masse de vitellus.
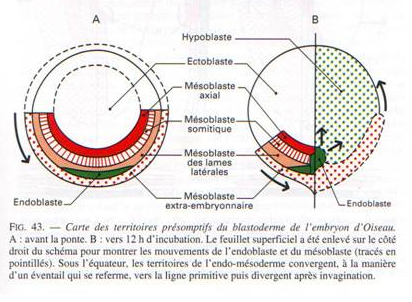
Par délamination, des blastomères du disque germinal migrent dans la cavité sous-germinale et forment l’hypoblaste, les cellules de surface formant l’épiblaste.
Entre l’épiblaste et l’hypoblaste se retrouve le blastocoele.
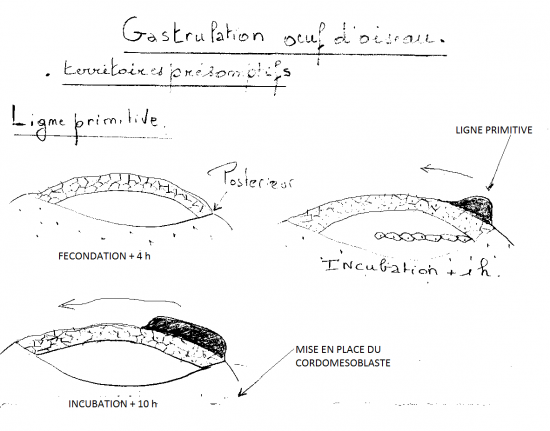
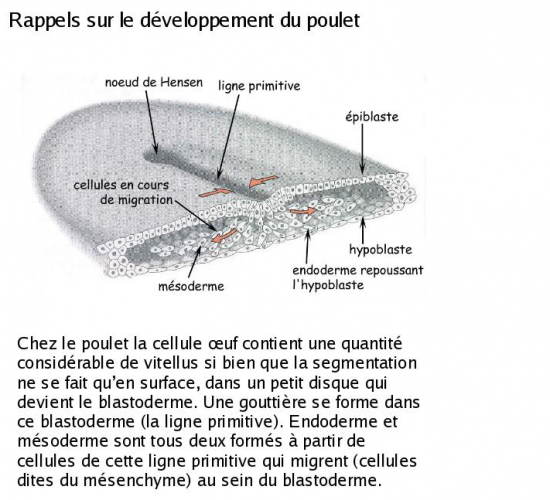
Chez le poulet, la gastrulation commence dès les premières heures d’incubation. Le premier indice en est l’apparition d’un épaississement dans la région postérieure de l’aire
pellucide, qui progresse antérieurement sur la ligne médiane, s’étendant sur 50 à 75% de l’aire pellucide. Cet épaississement témoigne d’une migration convergente des cellules de l’aire pellucide vers le centre postérieur puis vers l’avant, et constitue la ligne primitive, terminée par un renflement antérieur, le noeud primitif ou de Hensen. La ligne primitive marque l’axe antérieur-postérieur de l’embryon. Elle constitue la caractéristique structurale majeure de la gastrulation des oiseaux, comme de celle des reptiles et des mammifères (des amniotes). Comme les cellules de l’aire pellucide convergent pour tracer la ligne primitive, une dépression se creuse dans celle-ci, le sillon primitif. Le sillon primitif sert de blastopore au travers lequel les cellules de l’épiblaste migrent dans le blastocoele. Le sillon primitif des oiseaux, reptiles et mammifères est donc analogue au blastopore amphibien. Comme pour ce dernier, le sillon primitif consiste en une population cellulaire continuellement en changement. Au centre du noeud primitif se creuse pareillement une dépression en forme d’entonnoir et au travers laquelle les cellules de l’épiblaste migrent dans le blastocoele. Le noeud primitif est analogue à la LDB des amphibiens.
Les premiers blastomères de l’épiblaste à migrer dans le blastocoele empruntent le sillon primitif, migrent antérieurement, déplaçant les cellules hypoblastiques de la région antérieure de l’embryon, et formeront une portion du tube digestif, endodermique. Une partie de l’endoderme est maintenant amenée à l’intérieur de l’embryon.
Les prochains blastomères à pénétrer dans le blastocoele le font par le noeud primitif et migrent antérieurement, en demeurant entre l’endoderme et l’épiblaste; ils formeront le mésoderme de la tête et le chordamésoderme, lui aussi maintenant internalisé. La migration antérieure de toutes ces cellules a soulevé la région antérieure de l’épiblaste et résulte en la formation du bourgeon de la tête. Le blastodisque s’allonge.
Les dernières cellules migrant au travers du sillon primitif se séparent en deux courants une fois dans le blastocoele. Un courant migre profondément et déplaçe l’hypoblaste latéralement et postérieurement. Les cellules de ce courant de migration donneront naissance au reste des structures endodermiques embryonnaires et extra-embryonnaires. Les cellules de l’autre courant s’étendent en un feuillet lâche, entre l’endoderme et l’épiblaste et sont à l’origine du reste du mésoderme embryonnaire et extra-embryonnaire.
À 22 heures d’incubation, la majorité des cellules endodermiques présomptives se trouvent à l’intérieur de l’embryon, et des cellules mésodermiques présomptives continuent de migrer pour une période de temps prolongée.
Une seconde phase de la gastrulation s’entame: le sillon primitif régresse petit à petit caudalement, le noeud primitif occupant donc une position de plus en plus postérieure. C’est ainsi que se forme la notochorde, selon un gradient antéro-postérieur, par les dernières cellules mésodermiques à être mises en place. Finalement, en position complètement postérieure, le noeud primitif forme la région anale présomptive, de la façon deutérostome. Ce qui reste de l’épiblaste après ces migrations cellulaires, les cellules de surface, constitue l’ectoderme.
Contrairement à ce observé chez les amphibiens, chez qui des feuillets cellulaires migrent dans le blastocoele, chez les oiseaux ce sont des cellules individuelles qui migrent. À l’intérieur du blastocoele, plutôt que de créer un feuillet dense, elles forment un tissu lâche, particulièrement le mésoderme. Les cellules migrantes se déplacent par la formation de pseudopodes sur un substrat de polysaccharides, notamment l’acide hyaluronique, fabriqué par les cellules épiblastiques dès le début de la gastrulation. Si l’enzyme hyaluronidase est injectée dans le blastocoele, les cellules s’agrègent et ne migrent pas ou peu. L’acide hyaluronique est donc requis pour garder les cellules migrantes séparées les unes des autres.
Chez les oiseaux, le feuillet endodermique ne compose pas de structure tubulaire, comme l’archentéron de l’oursin ou de la grenouille, mais un feuillet plat. Il ne se forme donc pas de véritable archentéron dans la gastrula des oiseaux. Les trois feuillets ne sont pas emboîtés mais superposés.
Une conséquence de la gastrulation en deux étapes des amniotes est l’émergence d’un gradient antéro-postérieur de développement. Tandis que la portion postérieure de l’embryon est encore en gastrulation, la portion antérieure amorce l’étape subséquente de développement, l’organogenèse. La région antérieure de l’embryon sera longtemps plus avancée dans son développement que la région postérieure.
Pendant que se poursuit la gastrulation, des cellules ectodermiques, reliées par des jonctions serrées, entament un mouvement d’épibolie qui les fera entourer le vitellus. Leur surface externe adhère à l’enveloppe de fertilisation et les cellules s’étendent contre elle. Ceci prend 4 jours à s’accomplir et requiert la formation de nouvelles cellules, par mitoses. Finalement, l’endoderme remplace l’hypoblaste autour du vitellus, l’ectoderme entoure incomplètement le vitellus, et le mésoderme extra-embryonnaire se place entre les deux. Le vitellus ainsi entouré des trois feuillets prend le nom de sac vitellin. Les trois feuillets extra-embryonnaires du sac vitellin sont continus avec les trois feuillets embryonnaires. Nous y reviendrons.
Chez les oiseaux, c’est l’hypoblaste de la blastula qui induit la formation de la ligne primitive; l’enlever retarde tout développement subséquent, tant que l’épiblaste n’a pas généré, par délamination, une autre couche hypoblastique. L’hypoblaste dirige la formation et la directionnalité de la ligne primitive.
Résumé gastrulation aviaire
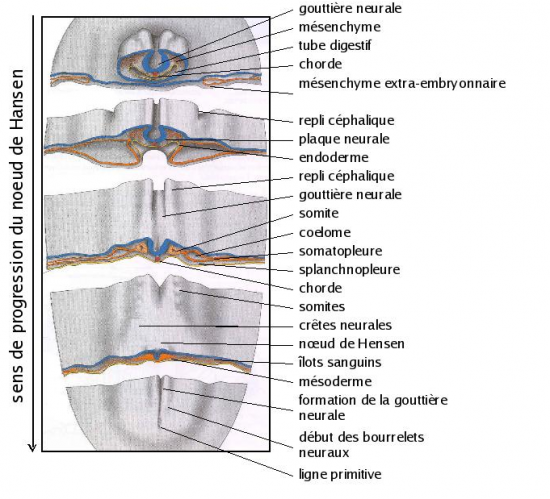
Apparition de la ligne primitive et du nœud de Hensen
Le disque embryonnaire s’allonge suivant l’axe longitudinal. Les blastomères de l’épiblaste convergent vers la région médio-caudale de l’aire pellucide pour y former un bourrelet médian, premier stade de la ligne primitive. Cette ligne primitive s’allonge vers le pôle craniâl au fur et à mesure de l’accumulation des cellules à sa base. Elle marque l’emplacement du futur névraxe (SNC et moelle épinière). L’extrémité craniâle de cette ligne est légèrement renflée et porte le nom de nœud primitif ou nœud de Hensen (figure 3.5).
Formation de l’endoderme et du mésoderme
Au centre de la ligne primitive se creuse un sillon par invagination des cellules épiblatiques : la gouttière primitive. Les cellules de l’épiblaste qui s’invaginent se différencient en cellules mésodermiques et rejoignent la cavité blastocoelique pour constituer une assise cellulaire séparant l’épiblaste de l’hypoblaste. Cette nouvelle assise constitue le mésoderme. Ce feuillet mésodermique s’étale latéralement et antérieurement pour entourer l’extrémité craniâle de la ligne primitive . La cavité blastocoelique disparaît progressivement.
Les cellules mésodermiques qui rejoignent l’hypoblaste le long de la ligne primitive s’insinuent entre les cellules hypoblastiques et les déplacent vers la périphérie de la cavité blastocoelique. Elles se différencient en endoderme embryonnaire. Les cellules hypoblastiques refoulées deviennent l’endoderme extraembryonnaire (figure 3.7).
Régression de la ligne primitive et formation de la notochorde
La ligne primitive cesse de s’allonger par son extrémité craniâle car les cellules épiblastiques qui s’invaginent pour former le mésoderme n’y sont plus remplacées. Le disque embryonnaire, lui, continue de s’étendre si bien que la ligne primitive paraît régresser et le nœud de Hensen recule.
Au cours de ce mouvement, les cellules mésodermiques du nœud de Hensen élaborent, sous l’épiblaste, un axe mésodermique médian qui s’étire par le recul du nœud et l’allongement du disque embryonnaire: la notochorde (figure
La gastrulation aviaire commence quelques heures après l’ovoposition, soit 24 à 30 heures après la ponte ovulaire. La ligne primitive atteint sa longueur maximale (2 mm) 18 heures plus tard et disparaît après 2,5 jours d’incubation.
Lorsque la ligne primitive a complètement régressé et qu’aucune cellule mésodermique n’est plus produite par l’épiblaste, la gastrulation est terminée. Les cellules épiblastiques restées en surface forment l’ectoderme.
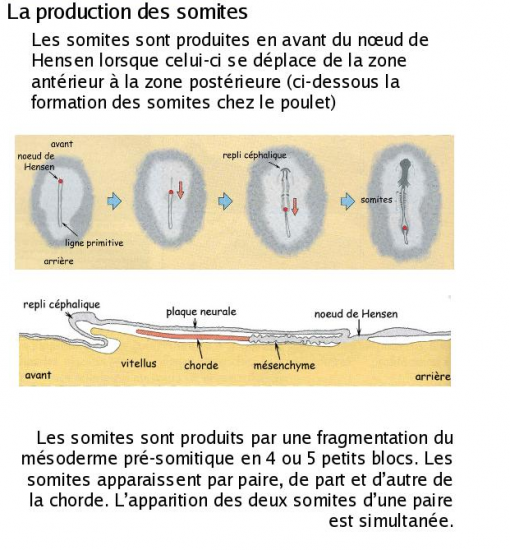
Les marges latérales du mésoderme constituent le mésoderme latéral. Elles s’étendent latéralement et rostralement pour se rejoindre sur la ligne médiane en avant de l’embryon. Ce mésoderme latéral se sépare en deux feuillets : le feuillet pariétal ou somatique et le feuillet viscéral ou splanchnique. Ces deux feuillets délimitent deux nouvelles cavités qui fusionneront par la suite pour constituer le coelome. Le mésoderme latéral participe à la formation des annexes extraembryonnaires ainsi qu’au système musculaire et cutané du fœtus. Les dernières cellules mésodermiques produites demeurent sous l’ectoderme, près de l’axe médian et forment le mésoderme paraxial qui est à l’origine des somites (musculature, squelette, derme). Chaque somite sera relié au mésoderme latéral par un étroit pont mésodermique : le néphrotome. Ce dernier est à l’origine des reins et des gonades.
Date de dernière mise à jour : 30/03/2018
Ajouter un commentaire