- Accueil
- E. Chimie
- I.Chimie générale
- chimie générale 3
chimie générale 3
I.5 DISCONTINUITE DE LA MATIERE. HYPOTHESES MOLECULAIRES ET ATOMIQUES
Jusqu'ici, nous avons simplement signalé des faits et énoncé des lois reposant sur de solides bases expérimentales.
La chimie étudiée de cette manière formerait un ensemble de recettes de cuisine et de lois empiriques, sans lien apparent.
Mais une théorie très féconde est venue imprimer à la chimie un caractère nouveau en y introduisant des représentations, concrètes qui permettent une interprétation aisée des phénomènes et des lois chimiques : c'est la théorie de la structure discontinue de la matière basée sur la représentation atomistique de la constitution des substances.
Ce problème de la structure de la matière hantait déjà les esprits dès l'antiquité avec des partisans d'une structure continue (Aristote) et des partisans d'une structure granulaire ( Démocrite, Epicure )
Nous sentons intuitivement qu'il sera impossible de fragmenter une substance telle la craie, sans que, à partir d'un degré de division ( non réalisable expérimentalement d'ailleurs) elle ne perde ses caractères propres. Le grain ultime conservant les propriétés de la substance a reçu aujourd'hui le nom de molécule
La molécule d'un corps simple ou composé étant la particule ultime de ce corps susceptible d'exister à l'état isolé
Mais à partir du 19ème siècle, à partir des travaux de Lavoisier, Dalton, Proust..., apparaissent des arguments en faveur de la représentation atomistique de la matière.
Ces arguments sont fournis :
- par des phénomènes chimiques
- par des faits expérimentaux relatifs aux propriétés des fluides, notamment la théorie cinétique des gaz.
- par la physique atomique et moléculaire moderne.
A. Les arguments d'ordre chimique
Ils sont essentiellement fournis par les lois de Dalton et Gay-Lussac.
La loi de Dalton dans son énoncé, annonce déjà une quantification de la matière à l'état macroscopique.
On imagine immédiatement que l'hypothèse de l'existence de grains, infiniment petits, indivisibles et identiques entre-eux d'azote et d'oxygène rendraient compte d'une manière aisée de la loi de Dalton.
Des nombres entiers et petits de grains d'azote et d'oxygène s'uniraient pour donner naissance à diverses associations chimiques, les nombres de grains réagissant ne pouvant varier que par bonds de une ou plusieurs unités.
Les loi de Gay Lussac deviennent aussi évidentes moyennant l'hypothèse d'Avogadro, hypothèse selon laquelle une substance pure à l'état gazeux serait constituée de molécules ( ou petites bulles) distribuées au hasard dans l'espace mis à la disposition du gaz, selon Avogadro : "Dans des volumes égaux de gaz parfaits quelconques pris dans les mêmes conditions de température et de pression, il y aurait toujours le même nombre de molécules".
Dès lors imaginons la réaction :
hydrogène + chlore -----------+ chlorure d'hydrogène
et supposons qu'a l'échelle la plus petite, l'on ait :
x balles d'hydrogène +y balles de chlore-------+ z balles de chlorure d'hydrogène
Nous pouvons écrire, en admettant que x=y =1 et z=2
1 balle. hydrogène +1 balle chlore--------+ 2 balles. chlorure d'hydrogène donc ( par Avogadro)
1 vol. hydrogène + 1 vol. chlore-----------+ 2 vol. Chlorure d'hydrogène.
Non seulement , la première loi de Gay-Lussac est vérifiée, mais si l'on pose que les vol. contiennent un nombre pair de grains ( petites bulles) on a :
commes rapports 1/2 et 1/2 qui sont rationnels simples et la deuxième loi de Gay-Lussac est aisément explicitée.
B. Arguments offerts par la théorie cinétique des gaz
Toute substance pure est constituée de particules identiques entre-elles et indivisibles en particules plus petites encore caractéristiques de la substance considérée
1. Hypothèses de la théorie cinétique des gaz :
- Les gaz sont constitués de nombreuses particules massives indépendantes, de forme sphérique, n'interagissant pas entre elles et sont impénétrables.
On peut reconsidérer cette « hypothèse » à la lumière des connaissances modernes. Tout d'abord, les « particules » peuvent être de nature bien différente : il peut s'agir effectivement d'atomes, de molécules, mais également d'objets plus complexes. La théorie cinétique ne se préoccupe pas de ce qu'elles sont exactement. L'existence d'atomes est aujourd'hui avérée — leur forme, en revanche, n'est absolument pas sphérique, et leurs interactions ne sont pas nulles. Elle n'est donc pas en toute rigueur fondée — elle est néanmoins valide pour de basses pressions. Dans la théorie cinétique des gaz, les seules interactions des particules sont leurs collisions
- Les particules subissent uniquement des collisions élastiques. Leur mouvement est galiléen et peut être formalisé par la mécanique newtonienne.Ce mouvement est incessant
Par collision « élastique », on entend qu'il y a conservation de l'énergie. Puisqu'il n'y a aucune interaction en dehors de ces collisions, il n'y a pas d'énergie potentielle : c'est donc l'énergie cinétique qui est conservée. Par mouvement « galiléen », on néglige de fait tous les effets relativistes et quantiques. Par mouvement « réversible », on entend qu'il n'y a aucun effet dissipatif (viscosité...). En conclusion : les particules sont en mouvement permanent, rectiligne en dehors des chocs
- Le récipient est indéformable. Les collisions des particules sur ses parois sont élastiques. Son volume est grand devant la taille des particules.
La théorie cinétique des gaz suppose que le gaz étudié est contenu. En effet, s'il ne l'était pas, les particules n'interagissant pas partiraient et se dilueraient jusqu'à l'infini. On fait, ainsi, naturellement quelques hypothèses sur ce récipient
- Le mouvement des particules est parfaitement chaotique, hasardeux, celles-ci ne sont guidées par aucun déterminisme
Quelques explications :
Pour expliquer la compressibilité différente des gaz et des états condensés, nous devons admettre que les particules d'un gaz sont distribuées dans l'espace de manière à laisser subsister entre elles de grands domaines vides de matière, alors que les états condensés correspondent à un entassement compact des particules.
Pour expliquer l'expansibilité du gaz, on a d'abord pensé à un effet de répulsion entre particules, mais le phénomène s'explique mieux en admettant que les particules sont continuellement en mouvement, leur trajectoire n'étant modifiée que par des chocs mutuels ou sur les parois du récipient. La théorie cinétique des gaz ne se borne pas à donner une représentation de l'état gazeux, mais cherche à déduire de cette image approximative les propriétés de l'état gazeux.
Il existe des développements actuels de la théorie cinétique qui permettent de supposer des hypothèses plus légères. On sait par exemple l'étendre aux gaz denses inélastiques relativistes (et chargés !). Elle reste toutefois la base historique et théorique de ces développements modernes.
Aujourd'hui, la théorie cinétique des gaz n'est plus la description la plus efficace — on lui préfère la thermodynamique qui donne des informations plus utiles, sans se préoccuper de la nature des fluides, et qui regroupe gaz, liquides et solides — et plasmas, et condensats… Néanmoins, les développements de la théorie cinétique des gaz s'appliquent lors de collisions macroscopiques, dans les tas de sable par exemple.
Nous nous contenterons dans cette leçon de présenter les résultats de la théorie cinétique « traditionnelle ».
Née au XVIIIe siècle, la théorie cinétique des gaz est une approche qui vise à comprendre les propriétés des gaz en supposant qu'ils sont constitués de particules en mouvement libre.
Elle amène à la notion élémentaire de « gaz parfait », qui bien qu'incomplète est très souvent suffisante pour décrire l'essentiel des gaz réels. Son développement amena au développement moderne de la thermodynamique statistique.
2. Survol de la théorie
Appliquée à l'étude des gaz parfaits , gaz idéaux dont les particules , assimilées à des points matériels n'exerceraient aucune action les unes sur les autres , la théorie des gaz qui tient compte de l'atomisme ou discontinuité de la matière nous conduit à des déductions qui correspondent à des constats empiriques expérimentaux. Ce qui illustre toute la fécondité de cette manière de considérer la matière.
Lois historiques
2.1 La loi de Boyle Mariotte
Cette loi a été découverte en 1662 par Robert Boyle et plus tard (1679) par l’abbé Edme Mariotte.
La Loi de Boyle Mariotte exprime une relation générale entre la pression et le volume d’une quantité fixée de gaz à une température constante.
Expérience : Matériel = seringue et manomètre (peut être informatisée). On mesure V et p (si l’on procède lentement, on peut admettre que la température reste constante).
Exploitation : le tracé de p = f(1/V) fournit une droite d’où l’on déduit la loi :
p.V = cte à T et N constants.
2.2 Loi de Charles (1787)
Cette loi indique qu’à volume constant, la pression d’une quantité fixée de gaz varie proportionnellement à la température absolue.
p/T = cte à V et N constants.
2.3 Loi de Gay-lussac
Si nous maintenons constante la pression d’une quantité fixée de gaz et que nous faisons varier sa température, nous remarquons que sa variation de volume est proportionnelle à la variation de la température : 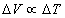 .
.
Plus précisément : ΔV = a V0 ΔT où a est le coefficient de dilatation à pression constante. Ce coefficient est presque le même pour tous les gaz :
a » 0,0037 K-1 = 1/273.
La représentation de V en fonction de T, la pente ΔV/ΔT = a V0 est constante et le graphique est une droite. Le volume d’un gaz est proportionnel à la température absolue.
V/T = cte à p et N constants.
2.4 Loi d'Avogadro-Ampère 1811
Cette année là, Amedeo Avogadro, à qui l’on doit le vocable de molécule affirme le concept moléculaire des gaz et conclut que des volumes égaux de gaz différents, pris dans les mêmes conditions de température et de pression, contiennent le même nombre de molécules
2.5 Modèle théorique du gaz parfait
Un gaz qui suit toutes ces lois est un gaz parfait au sens macroscopique du terme. Cela se traduit par la relation bien connue :
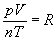 où R = 8,3145 J/(K.mol) apparaît comme la constante molaire des gaz parfaits
où R = 8,3145 J/(K.mol) apparaît comme la constante molaire des gaz parfaits
2.5.1 La pression du gaz
La pression du gaz résulte des chocs élastiques des molécules sur les parois de l'enceinte. Soit N le nombre total de molécules dans l'enceinte (N ~ 1023 molécules/m3).
Fig.1 : Chocs des molécules sur la paroi
- le choc étant élastique, on a :
Fdt = mdv
soit, Fxdt = 2mvx (en projetant sur l'axe x)
or, p = F/S
|
|
|
Les molécules frappant la surface S de la paroi pendant le temps dt sont comprises dans un cylindre de base S et de hauteur vxdt : or statistiquement seulement la moitié de ces molécules se dirige vers la paroi :
- le nombre de molécules frappant la paroi est donc égal à : 1/2 n0Svxdt (où n0 = N/V)
donc, p = F/S = 1/2 n0Svxdt.2mvx/Sdt = n0mvx2.. Or la répartition des vitesses dans l'enceinte est isotrope, on a : vx2 = vy2 = vz2 = 1/3 v2
soit, 1) p = 1/3 n0mv2
où v2 est la vitesse quadratique moyenne des molécules définit par :
<v2> = 1/N å i vi2
On calcule cette vitesse à partir de la loi de distribution des vitesses de Maxwell .
La température absolue du gaz
D'après la théorie cinétique des gaz, la température absolue T est un paramètre qui caractérise l'état thermique du gaz, c.à.d à son degré d'agitation thermique par la relation :
2) 1/2 mv2 = 3/2 kT
où k est la constante de Boltzmann
Si le degré d'agitation est élevé (c.à.d v grand), alors la température et aussi la pression du gaz sont élevées. La relation 2 définit la température absolue en degré Kelvin [K].
2.5.2 Equation d'état du gaz parfait
La pression p peut s'écrire en y introduisant la relation précédente :
p = Nmv2/3V = NkT/V
soit, pV = NkT = nNAkT (1+2)
===>pV = nRT
en posant, n = N/NA et R = kNA
où, n est le nombre de moles, NA est le nombre d'Avogadro et R est la constante universelle des gaz
La dernière relation est l'équation bien connue des gaz parfaits. Comme le nombre de moles est donné par :
n = N/NA = m/M
la loi des gaz parfait peut aussi s'écrire :
- pour une masse m de gaz : pV = mrT 4)
avec, r = R/M désignant la constante individuelle de chaque gaz
Unités
Dans le système international SI ou MKS, les grandeurs de ces expressions s'expriment dans les unités suivantes :
- p = [Pa] ou [N/m2]
- V = [m3] et T = [K]
- R = 8,314 [J/Kmol]
avec la constante de Boltzmann : k = R/NA = 1,38.10-23 J/K
et le nombre d'Avogadro : NA = 6,023.1023 molécules/mole
Autres lois des gaz parfaits.
- pour un gaz parfait les chaleurs massiques sont constantes, l'énergie interne n'est fonction que de T, cette fonction est linéaire en T
- pour un gaz semi-parfait les chaleurs massiques sont fonction de la température, l'énergie interne est fonction biunivoque de T Diagrammes du gaz réel
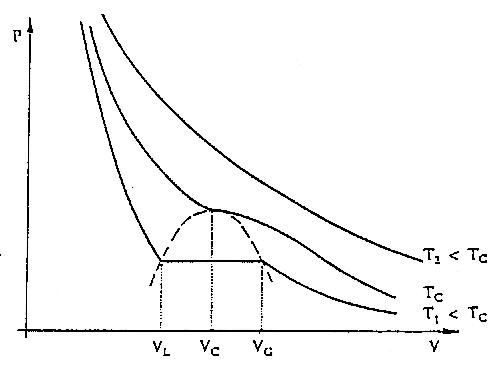
Si on trace expérimentalement les isothermes des gaz réels dans un diagramme de Clapeyron, les allures de ces isothermes sont très différentes de celles du gaz parfait (Fig. 2).
- liquéfiables à une température inférieure à la température critique Tc fonction du gaz
- Loi de Mariotte : à T = cte : p1V1=p2V2
- Lois de Gay Lussac et Charles :
-
- à V = cte : p2/p1 = T2/T1
- à p = cte : V2/V1 = T2/T1
-
2.5.3 Energie interne du gaz parfait
L'énergie interne U est la somme des énergies cinétiques (car Ep = 0) des N molécules constituant le gaz, soit :
U = å i 1/2 mvi2 = 1/2 Nmv2
On obtient finalement :
- pour un gaz monoatomique : U = 3/2 nRT
Lois des mélanges de gaz
Un mélange de gaz est formé de différents gaz (ni, Mi) occupant le même volume V : à l'équilibre thermique ces différents gaz sont à la même température T. On définit alors pour chaque gaz une pression partielle pi telle que la pression totale p du gaz soit :
la loi de Dalton : p = å i pi
soit, pV = NkT = (N1 + N2 + ....)kT = p1V + p2V + ....
d'où, pi = niRT/V4.7)
et on a aussi, pi = ni / å i ni
Diagrammes des gaz parfaits
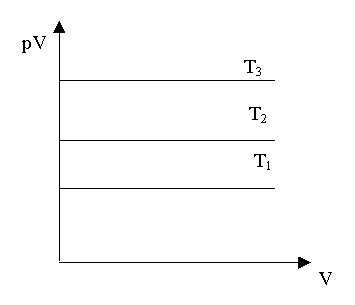
Deux diagrammes sont principalement utilisés pour réprésenter l'état d'un gaz : les diagrammes de Clapeyron (p,V) et d'Amagat (pV,V).
Pour un gaz parfait, les isothermes sont des hyperboles d'équation pV = nRT, voir Fig.
fig 2 Diagramme de Clapeyron du gaz parfait
L'avantage du diagramme d'Amagat suivant est qu'il met bien en évidence les écarts d'un gaz réel par rapport au gaz parfait, surtout aux hautes pressions.
fig 3 Diagramme d'Amagat du gaz parfait
Remarque importante : la distribution des vitesses
Rappelons nous que dans notre modélisation, les chocs étant totalement élastiques contre la paroi ou contre une autre particule, l'énergie cinétique totale est conservée, celle-çi intervenant avec la vitesse au carré, les directions positives ou négatives n'interviennent pas dans les calculs.
Il y a conservation de l'énergie cinétique donc de l'énergie totale du système car l'énergie potentielle est nulle ( pas d'interaction ), il y a donc conservation des vitesses individuelles au carré, des vitesses individuelles et de la vitesse quadratique moyenne définie çi dessus.
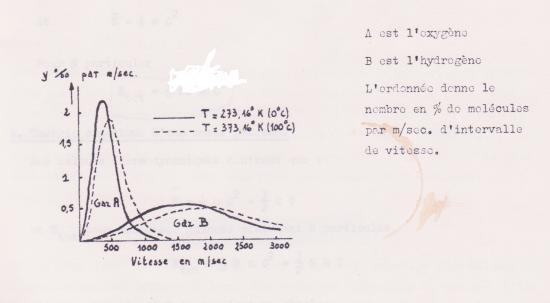
Statistiquement, on peut montrer que dans une masse gazeuse en équilibre thermique, il s'établit une distribution des particules entre les diverses valeurs possibles de la vitesse, distribution qui n'est pas modifiée par les chocs. La courbe de distribution des vitesses reste constante en fonction du temps , et se modifie pour un même gaz avec la température.
Fig 4 : Distribution des vitesses de Maxwell
3. Les gaz réels
Les gaz réels ont un comportement très différent des gaz parfaits. Si la pression augmente la loi des gaz réels s'écarte de celle des gaz parfaits, surtout aux hautes pressions (quelques atmosphères). Les gaz réels sont :
Dans un gaz réel, la distance entre les molécules est grande et donc l'énergie potentielle d'interaction est faible et l'énergie interne se présente alors essentiellement sous forme d'énergie cinétique d'agitation thermique. Dans un gaz parfait, ces distances sont très grandes par rapport aux dimensions de ces molécules (sup.posées ponctuelles) et l'énergie potentielle est nulle.
On distingue alors entre gaz parfait et semi-parfait, satisfaisant à l'equation pV = nRT, mais :
Nous verrons en thermodynamique les modifications qu'il y a a apporter aux différentes expressions pour rendre compte de l'état de gaz réels.
C. Autres arguments
- La théorie cinétique des gaz permet de calculer bien d'autres propriétés encore.Les résultats de ces calculs sont bien confirmés par l'expérience, mais pour éviter de laisser reposer tout ceci sur les bases d'une théorie tout à fait abstraite, on a essayé de vérifier celle-ci expérimentalement.
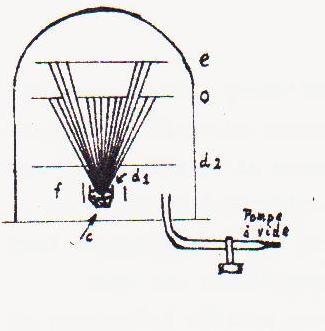
a.Propagation des particules en ligne droite et expansibilité
L'appareil schématisé ci-après consiste en un petit creuset contenant un métal facilement fusible ( Ag) chauffé électriquement. Le tout est surmonté de diaphragmes (d1, d2), d'un écran ( o ) sur lequel une figure quelconque est découpée et enfin d'un écran ( e ) continu en verre ou en métal.
L'ensemble placé dans une cloche où l'on fait un vide poussé et l'on chauffe le métal. On observe bientôt sur e une image de la découpe de o , ce qui montre que les particules d'Ag gazeux émises par la surface du métal fondu se propagent dans la cloche en ligne droite ( pas d'obstacles étant donné le vide poussé).
b.Mouvement brownien
- Si on examine à l'ultra microscope les corpuscules solides constituant la fumée de tabac en suspension dans l'air, on voit que les particules sont dans un état d'agitation continu. Ce phénomène avait été observé pour la première fois en 1827 par Bown sur des grains de pollen en suspension dans un liquide.
- Nous établirons un peu plus loin quelques relations et constantes relatives aux gaz parfaits.
Date de dernière mise à jour : 08/03/2018
Ajouter un commentaire