- Accueil
- E. Chimie
- I.Chimie générale
- Chimie générale 6
Chimie générale 6
Atomistique
ATOMISTIQUE
I. LES HYPOTHESES ET LES LOIS A LA BASE DES MODELES DE L'ATOME
I.A INTRODUCTION
Le modèle de Rutheford, décrit précédemment fût une importante avencée, mais n'a qu'un faible pouvoir explicatif et, rapidement, d'autres modèles plus performants ont été édifiés.
Deux directions sont issues de ce modèle générant deux branches très distinctes de la " science de la matière".
1) La structure du noyau qui est l'objet de la physique nucléaire.Bien qu'il exite une "chimie nucléaire" ( radioactivité, réaction nucléaire, transmutation), la structure du noyau intéresse peu le chimiste car les réactions chimiques ne mettent en jeu que les électrons ( et même certains d'entre eux seulement ).
2) L'organisation du "nuage électronique" , qui relève de la chimie physique ; Sa connaissance est, au contraire, absolument nécessaire pour comprendre la chimie, Ce chapitre la décrit selon le modèle quantique , où modèle de Bohr dans lequel l'électron est considéré comme une particule en mouvement. Ce n'est pas le plus récent des modèles, mais son pouvoir explicatif est déjà intéressant et beaucoup de chimie peut être faite à partir de lui.Plus loin nous envisagerons une atre façon de décrire l'atome, en décrivant l'électron non pas comme une particule, mais comme une onde.
Le principe de la quantification de l'énergie, et la définition des nombres quantiques, seront les deux points les plus importants, il s'agit d'aquis définitifs. Ces deux notions sont en effet conservés dans les conceptions plus modernes de l'atome .
Le modèle très simple de l'atome proposé par Rutheford rend compte de l'existence d'éléments différents et de celle des isotopes d'un éléments . Mais il n'apporte aucune base d'explication pour la diversité des propriétés des éléments ( métaux,non-métaux, gaz inertes,...), ni pour leur valence.En outre, il ne permet pas de justifier les caractéristiques des spectres d'émission des atomes et, historiquement, c'est surtout cette raison qui a conduit à l'élaboration d'un autre modèle.
Bien que la théorie atomique ait des origines assez lointaines, l'étude de la constitution des atomes et leur représentation par des modèles sont, somme toutes, des acquisitions assez récentes.Ces modèles ont été imaginés après toute une série d'hypothèses, de plus en plus complexesqui ont conduit à une représentation qui cadre à merveille avec toutes les données fondamentales vues jusqu'ici.
Encore une fois, c'est grâce à l'étude des milieux homogènes , les gaz, que sont apparues les données de base sur la constitution de l'atome.
I.B DECOUVERTE DE L'ELECTRON , article (Tiré modifié de - Cours de chimie générale 1989 , Professeur C. DECOCK - ( ISIPH CONDORCET BELGIQUE) pour première Candidature ( act 1er bachelier) ingénieur - agronomie et Chimie générale 1995 . Professeur A.DE. HAAN partie chimie physique ( Faculté Polytechnique de MONS) pour 1ère candidature ( act prfemière bachelier )Ingénieur civil
I.B.I ) Electricité-électrolyse
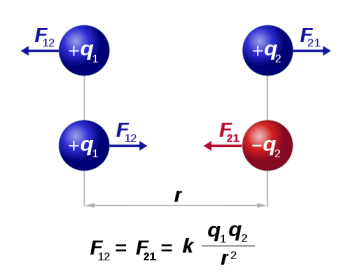
L'électricité est connue depuis longtemps. L'apparition de charges électriques sur des objets tels que le verre et l'ébonite frottés respectivement avec un linge sec une peau de chat avait permis de mettre en évidence l'existence de deux sortes d'électricité, positive et négative.On avait aussi remarqué l'existence entre ces objets chargés , des forces attractives entre charges de signe différents et répulsives entre charges de même signe. La loi de Coulomn régit l'intensité de ces forces.
F = 1/ε . (q.q'/r2)
F = force
ε = constante diélectrique caractéristique du milieu où se trouvent les charges ( ~ 1 pour le vide, l'air, >1 pour les autres milieux, ~ 80 pour l'eau )
q,q' = charges respectives des particules étudiées., sur le scéma ci-dessous q1.q2
r : distance séparant les particules chargées.
L'électrolyse
le phénomène de l'électrolyse, ou décomposition par passage de courant électrique, de composés chimiques dissous ou fondus ne peut s'expliquer que grâce à l'hypothèse de Arrhénius ( voir plus loin ) et selon laquelle les électrolytes se dissocient en particules chargées de signes contraires.
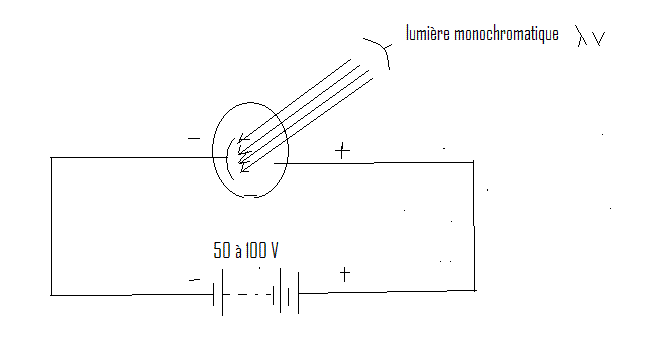
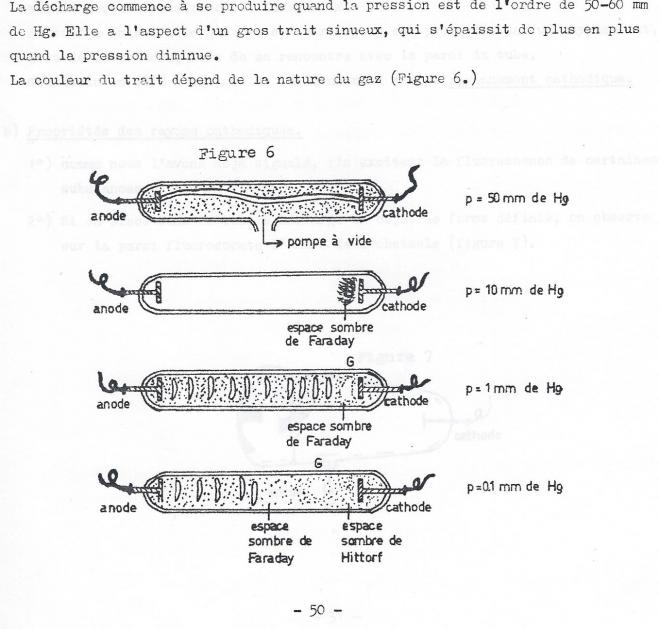
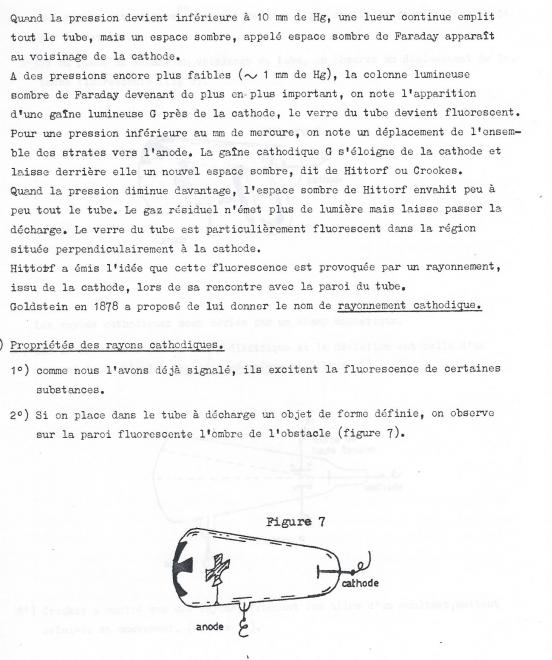
I.B.2 Décharges électriques dans les gaz raréfiés
a) Si l'on applique une différence de potentiel de l'ordre de 50.000 volts entre des électrodes situées aux extrémités d'un tube de verre d'environ 50 cm de longueur on observe aucune décharge électrique aussi longtemps qu'un vide partiel été créé dans le tube. Tout au plus observe-t-on des étincelles crépitentes ramifiées au voisinage des électrodes.
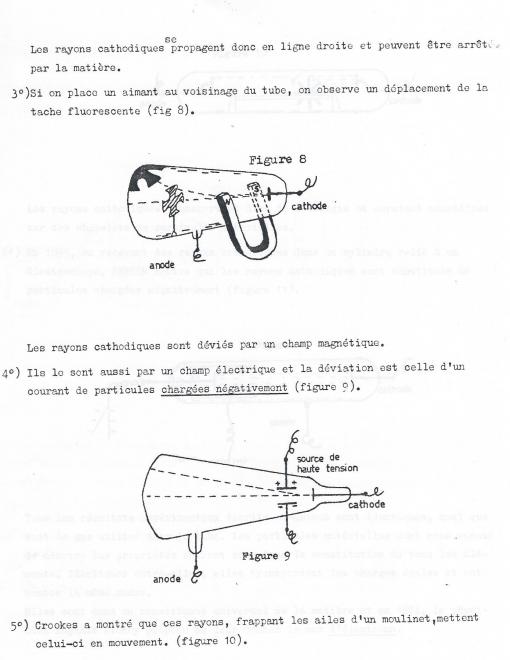



Cette masse est donc très faible et nous pourrons la négliger dans la plupart des calculs .
I.C. ONDES ELECTRO-MAGNETIQUES ET QUANTIFICATION DE L'ENERGIE
a) Le rayonnement électromagnétique
Le rayonnement électro-magnétique dont la lumière est un exemple , est une forme de l'énergie . C'est une onde, c'est à dire un phénomène vibratoire caractérisé par :
+ Une vitesse de propagation c
+ Une fréquence ν ( nombre de vibrations par seconde )
+ Une longueur d'onde λ ( distance parcourue pendant une vibration )
Comme la fréquence est aussi le nombre de longueurs d'onde parcourues pendant une seconde, ces trois grandeurs sont liées par la relation :
c = λ . v
La vitesse de propagation des ondes électro-magnétiques, dans le vide, est toujours la même. C'est une constante universelle qui a été déterminée avec une grande précision et vaut : c = 2,997925 . 108 m/sec .
Par contre la fréquence et par suite la longueur d'onde ( inversément aussi ), peuvent avoir des valeurs diverses, bien qu'il y ait une continuité totale dans les valeurs de λ ( ou de v ), on distingue sur ces bases des domaines particuliers du rayonnement électro-magnétique, comme suit :
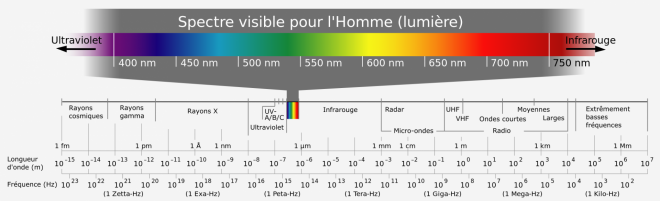
autre image créative common's Wikipedia ; https://upload.wikimedia.org/wikipedia/commons/a/aa/Domaines_du_spectre_%C3%A9lectromagn%C3%A9tique_14122013.JPG
I.C. LES ECHANGES D'ENERGIE ENTRE LA MATIERE ET LE RAYONNEMENT - LA SPECTROSCOPIE ( cours de chimie physique, Paul Arnaud, 3ème édition Dunod, modifié ).
- Emission et absorption du rayonnement par la matière
Il peut se produire des échanges d'énergie entre la matière et le rayonnement, dans deux sens :
- Emission : dans certaines conditions, la matière peut émettre ( produire ) du rayonnement. C'est le cas par exemple de toutes les sources lumineuses ; soleil, ampoules à incandescence, flammes, tubes "fluo", vers luisants, etc ...; les lampes à bronzer émettent du rayonnement ultra) - Absorptionviolet, les antennes de radio ou de télévision, les radars émettent des ondes hertziennes .
- Absorption : L'énergie d'un rayonnement peut être absorbé par la matière ( nous verrons plus loin ce qu'elle devient ). L'échauffement du corps au soleil , l'absorption des rayons X par les parties denses du corps qui apparaissent ainsi en clair sur les " radiographies " , le phénomène de la couleur en sont des exemples. Cette absorption peut avoir des effets chimiques , en déclenchant des réactions photochimiques ( par exemple la photosynthèse ).
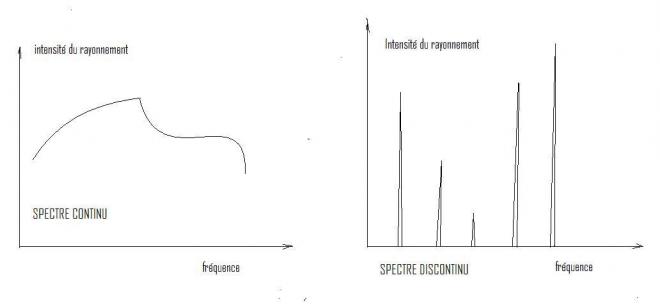
- Analyse spectrale : spectres continus et discontinus
Un rayonnement peut comporter toutes les fréquences ( ou toutes les longueurs d'onde ) dans un intervalle donné, on dit qu'il présente un spectre continu .Ainsi, la lumière solaire présente un spectre continu, de l'ultraviolet à l'infrarouge, en passant par le visible ( la preuve en est donnée par l'arc en ciel , qui contient toutes les couleurs , avec une transition continue entre elles).
D'autres sources émettent un rayonnement à spectre discontinu. Il ne comporte que certaines fréquences ( ou longeurs d'onde ). La lumière émise par la décharge dans un gaz, par une étincelle , ou par un arc électrique est dans ce cas .
Faire l'analyse spectrale d'un rayonnement consiste à rechercher comment se répartit son énergie en fonction de la " fréquence " (ou de la longeur d'onde ) : variation de l'"intensité " d'un spectre continu, valeur des fréquences présentes dans un spectre discontinu.
 On appelle aussi les spectres discontinus spectres de raie. Cette expression a pour origine la technique instrumentale utilisée ( ancienne ) pour faire l'analyse spectrale d'un rayonnement dans le domaine du visible. Le rayonnement est dirigé dans un spectrographe, où il entre dans une fente fine , puis rencontre un prisme . Celui-ci disperse les rayonnement des fréquences différentes, en provoquant une déviation du lumineux d'autant plus grande que la fréquence est plus grande . Après la traversée du prisme les différentes fréquences sont donc séparées et on peut recevoir un écran autant d'images de la fente d'entrée que le rayonnement connaît de fréquences distinctes. Chacune de ces images à l'apparence d'une "raie " , d'où le nom de spectre de raies .
On appelle aussi les spectres discontinus spectres de raie. Cette expression a pour origine la technique instrumentale utilisée ( ancienne ) pour faire l'analyse spectrale d'un rayonnement dans le domaine du visible. Le rayonnement est dirigé dans un spectrographe, où il entre dans une fente fine , puis rencontre un prisme . Celui-ci disperse les rayonnement des fréquences différentes, en provoquant une déviation du lumineux d'autant plus grande que la fréquence est plus grande . Après la traversée du prisme les différentes fréquences sont donc séparées et on peut recevoir un écran autant d'images de la fente d'entrée que le rayonnement connaît de fréquences distinctes. Chacune de ces images à l'apparence d'une "raie " , d'où le nom de spectre de raies .
L'expérience montre que les atome n'émettents un rayonnement que si on les soumet à une excitation. Celle-ci peut se réaliser par chauffage : si on pulvérise une solution de chlorure de sodium dans une flamme, celle-ci se colore en jaune, couleur du rayonnement émis par les atomes de sodium ( la même observation peut être faite lorsque qu'une casserole d'eau salée déborde sur une cuisinière à gaz ). Elle peut aussi se réaliser par l'action d'un champ électrique ( étincelle ente deux électrode, décharge dans un gaz ).
Les specytres obtenus à partir des rayonnements ainsi provoqués sont des spectres de raies . Ils contiennent un ensemble de fréquences caractéristiques de chaque élément. L'examen des spectres d'émission peut ainsi constituer une méthode d'analyse chimique. Les métaux s'y prêtent particulièrement bien , et c'est une méthode d'analyse des alliages . C'est aussi en analysant la lumière reçue des étoiles que l'on peut savoir quels éléments chimiques y sont présents.
les fréquences caractéristiques de chaque élément sont strictement invariables et on les utilise parfois comme étalon pour la définition de certaines unités. Le mêtre est défini comme la longueur égale à 1650763,73 lonugeurs d'onde dans le vide d'une des raies émises par le nucléide 86Kr. La seconde est définie comme la durée de 9192631770 vibrations pour l'une des raies émises par le nucléïde 133Cs.
- Le corps noir ( modifié de Chimie générale T1 chimie physique : A.De Haan, Fpms Belgique )
En physique, un corps noir désigne un objet idéal dont le spectre électromagnétique ne dépend que de sa température.
Le nom corps noir a été introduit par le physicien Gustav Kirchhoff en 1862. Le modèle du corps noir permit à Max Planck de découvrir la quantification des interactions électromagnétiques, qui fut un des fondements de la physique quantique ( tiré de Wikipedia ).
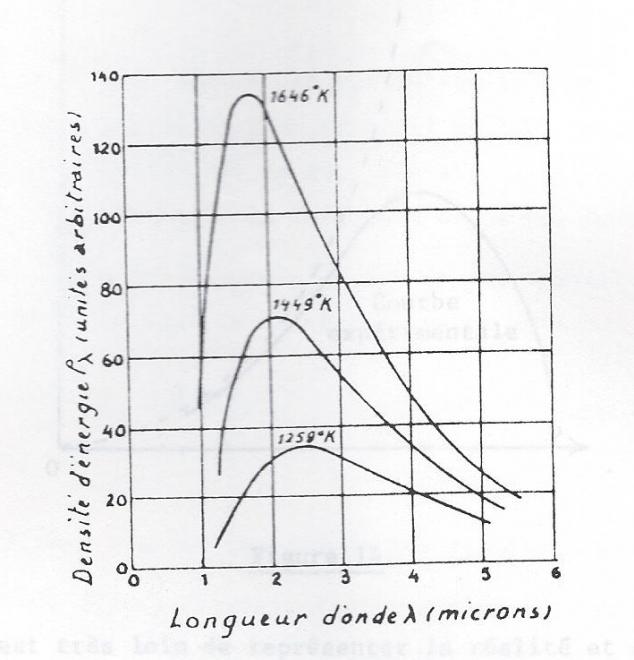
Si un composé à haut point de fusion, par exemple du fer, reçoit de l'énergie thermique, il commence par rougir. Si la quantité d'énergie thermique est suffisante, la lueur vire au jaune et enfin au blanc. Il faut donc d'avantage d'énergie thermique pour porter une substance au blanc qu'au rouge.Or d'après les théories classiques des radiations électromagnétiques, l'énergie d'une onde lumineuse est proportionnelle à son amplitude.
de même, la figure qui suit donne, pour différentes températures , la densité d'énergie ρλ , émise par un corps noir en fonction de sa longueur d'onde. La densité d'énergie ρλ représente la quantité d'énergie recue par intervalle unitaire de longueur d'onde et dans une unité de volume.
Le déplacement des courbes vers les plus hautes fréquences ( plus faibles longueurs d'onde ) correspond au passage du rouge sombre au rouge vif d'un métal que l'on chauffe.
Or tous les raisonnements classiques conduisent, pour la distribution de l'énergie dans le corps noir, à la formule de Raleigh-Jeans :
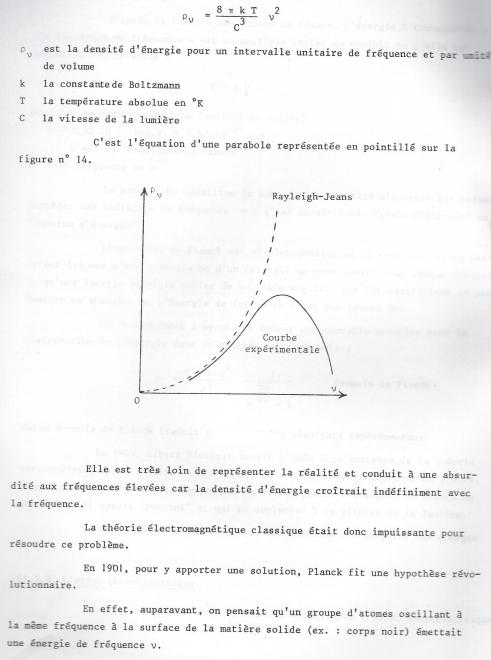
Planck avanca l'hypothèse que l'énergie de ce rayonnement ne pouvait être continue , mais devait être répartie de manière discontinue en quantité élémentaires finies ou "quanta " . D'après cette théorie des quantas de Planck, l'énergie E transportée par une radiation de fréquence v est un multiple entier du produit hv, elle est donnée par la relation :
E = n.h.v
où n est le nombre quantique : positif et entier
h = 6,62.10 -27 erg.se. = 6,62.10-34 J.s. c'est la constante de Planck
v = la fréquence en s-1
Le produit h.v constitue la plus petite quantité d'énergie que puisse posséder une radiation de fréquence v : c'est un véritable " grain d'énergie " ou " quantum d'énergie " .
L'hypothèse de planck est révolutionnaire en ce sens que, si un oscillateur ( atomes d'une molécule ou d'un cristal ) ne peut avoir pour chaque fréquence v, qu'une énergie multiple entier de hv, celà signifie que cet oscillateur ne peut émettre ou absorber de l'énergie de fréquence v que par quanta hv. Cette hypothèse a permis de donner une nouvelle relation pour la distribution de l'énergie dans le spectre du corps noir .
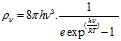
Cette formule de Planck traduit exactement les résultats expérimentaux .
En 1905, Albert Einstein reprit l'idée déjà ancienne de la théorie corpusculaire de la lumière de Newton et, en adoptant les conceptions de Planck, remplaça les corpuscules de Newton par de petits grains d'énergie ou " quanta" de lumière qu'il appela photons et qui se déplacent à la vitesse de la lumière.Chaque photon d'une radiation de fréquence v transporte une énergie E=hv
- L'effet photo-électrique (modifié de Franeau-Physique générale )
Cette conception permit à Einstein d'expliquer l'effet photoélectrique.
L'expérience montre que pour un métal donné, l'absorption d'une lumière de fréquence égale ou supérieure à une valeur déterminée s'accompagne de l'émission d'électrons
Ce phénomène s'explique en considérant que l'énergie nécessaire pour arracher un électron au métal est fournie par l'absorption d'un photon . Si une énergie minimale E0 est requise pour arracher des électrons au métal, cette énergie correspond nécessairement à une fréquence minimale v0 = E0/h caractéristique du métal. Cette énergie minimale correspond au seuil d'excitation ou seuil photo-électrique . Au dessous de ce seuil, il n'y a pas de photo-émission d'électron.
Au delà de cette fréquence, soit si v > v0, l'excès d'énergie est communiqué aux électrons sous forme de'énergie cinétique : Ec = 1/2 mv2 = hv -hv0 .
Conclusion : il apparaît que le caractère ondulatoire de la lumière préside à son comportement dans tous les phénomènes liés à sa propagation.Par contre c'est le caractère corpusculaire qui règle les échanges d'énergie entre atome et rayonnement . On notera que ces deux aspects sont indissociables, en effet, le corpuscule de lumière possède l'énergie d'un quantum hv, où la fréquence v est une grandeur typiquement ondulatoire.
- Le spectre de l'hydrogène
Spectre d'absorption ( Tome 1 chimie générale : chimie physique A De Haan. Fpms Belgique )
L'expérience montre que la lumière est absorbée par les atomes et les molécules, même à des fréquences inférieure à la fréquence v0 qui détermine une photoémission d'électron. Au dessous de ce seuil, un atome ou une molécule donnée n'absorbe que certaines fréquences lumineuses. L'ensemble des fréquences absorbées correspond au spectre d'absorption . Il est spécifique de chaque atome ou molécule et constitue donc un procédé d'identification.
L'hydrogène, qui est le plus léger et le plus simple des éléments, n'échappe pas à cette règle
Son spectre d'absorption est représenté sur la figure suivante :
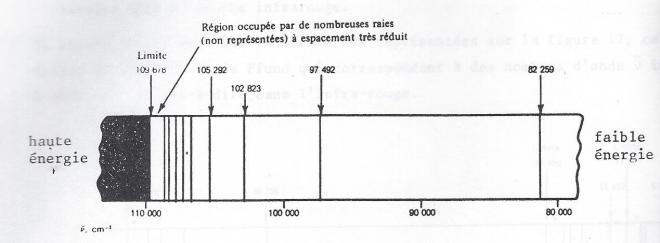
On y constate une série de raies d'absorption dont la moins énergétique correspond à un nombre d'onde de 82.259 cm-1 et la limite la plus énergétique se situe à 109.678 cm-1
Au delà de cette limite, il se produit une photo-émission de haute énergie et tous les quantas lumineux sont absorbés. Notons également que la distance entre les raies d'absorption diminue à mesure que le nombre d'onde et donc l'énergie augmentent .
Spectre d'émission
Le spectre d'émission de l'hydrogène présente un grand nombre de raies dans l'ultraviolet, le visible et l'infrarouge .Il a été montré empiriquement par les spectroscopistes que les fréquences de ces raies sont données par la relation : v = R.c.( 1/n12 - 1/n22 ) où R est la constante de Rydberg ( R = 1,097373 . 107 m-1 ) , c la vitesse de propagation de la lumière, n1 et n2 des nombres entiers ( n1 = 1,2,3,...) etc ; ( n1 + 1, n1 + 2, ...) etc .... L'ensemble des raies correspondant à une valeur donnée de n1, n2 prenant par ailleurs les valeurs n1+1, n1 +2 ,... Ces séries portent les noms des physiciens qui les ont étudiées : Lyman ( n1 = 1), Balmer ( n1 = 2 ), Paschen ( n1 = 3), Bracket (n1 = 4 ) Pfund (n1 = 5) ( modifié de " cours de chimie physique de Paul ARNAUD - ed-Dunod ).
Autrement dit :Si les atomes ou les molécules recoivent une forte énergie , sous forme thermique par exemple , il se produit une émission de lumière à certaines fréquences bien déterminées. Par exemple les atomes d'hydrogène émettent une lumière rouge par chauffage.
Chaque atome ou molécule présente un spectre d'émission caractéristique qui est spécifique de sa nature. Le fait remarquable est que seul des photons d'énergie déterminée soient émis .
La figure qui suit ( 17 sur l'original pII,19 du syllabus de chimie physique pour 1ère *ex candidature ingénieur Faculté polytechnique de Mons - prof DE-HAAN ) reprend une partie du spectre d'émission de l'hydrogène atomique. Il présente plus de raies que le spectre d'absorption .
Les raies pour lesquelle le nombre d'onde est supérieur ou égal 82.259 cm-1 se retrouvent dans les deux tyzpes de spectres mais :

I.D LE NOYAU modifié de chimie générale tome 1- C.De Cocq Isiph Condorcet/1989 )
L'atome dans son ensemble étant neutre , nous devons y trouver, à côté, des particules négatives que sont les électrons , des particules positives. Comment des expériences réalisées part Rutheforsd qui ont mis en évidence l'existence d'un noyau , positif, où la matière de l'atome est concentrée dans un volume infiniment plus petit que son volume global.
On est arrivé à déterminer approximativement les dimensions des molécules en mesurant l'épaisseur de la paroi d'une bulle de savon jusque l'éclatement . On peut supposer qu'elle est formée d'une seule couche moléculaire et elle a une épaisseur de 5.10-7 cm environ.
Les dimensions varient bien entendu avec les espèces moléculaires et en admet que les dimensions des atomes sont de l'ordre de l'Angström (Å) = 10-8cm.Celà a d'ailleurs déjà été vérifié par des expériences sur la compressibilité des gaz.
Rutheford bombarde une feuille métallique très mince avec un faisceaux de particules α très rapides. ( ces particules, comme nous le verrons plus loin sont émises par des éléments radioactifs ).
Il observe la direction des particules qui ont heurté cet ensemble d'atomes en les accueillant sur un écran au sulfure de Zincqui scientille sous leur impact.
Si l'atome était compact, toutes les particules α rebondiraient . Or la plupart traversent le métal sans pratiquement subir de déviation. Ainsi si la feuille a une épaisseur de 5000Å, soit environ mille couches d'atomes , une particule sur 100.000 est déviée d'un angle supérieur à 90°.Si on double l'épaisseur de la feuille, deux fois plus de particules sont déviées.
Pour expliquer ces résultats expérimentaux , il faut admettre que la majeure partie de l'atome est concentrée en une particules très petite, appelée noyau atomique, chargée positivement, puisqu'elle repousse les particules α et qui a une masse assez forte pour supporter le choc de ces particules.
Si on admet la variation linéaire du nombre de particules déviées et si 1000 couches atomiques devient une particule sur 105, une couche atomique déviera une particule 108 . Le volume du noyau est donc de l'ordre de 10-8 celui de l'atome, son diamètre sera donc de 10-4 fois celui de l'atome ( environ 1 Å = 10-8 cm) soit d'neviron 10-12 cm.
Le noyau est lui-même une structure discontinue. Il résulte de l'association de particules plus simples, les nucléons parmi lesquels nous retiendrons que deux sortes de particules stables :
a) Les protons, qui sont des noyaux du plus simple des atomes, l'hydrogène. Ils sont chargés d'électricité positive. Leur charge en valeur absolue est égale à celle des électrons : 4,8.10-10 u.e.s CGS de charge.
Leur masse est sensiblement celle de l'atome d'hydrogène , soit environ 2000 fois celle de l'électron.
b) Les neutrons, associés aux protons dans les neutrons ont une masse sensiblement égale à celle du proton, mais ils ne portent aucune charge électrique. Les autres particules constitutives des noyaux , positons, mésons et neutrinos font l'objet d'étude de la radiochimie et actuellement d'études approfondies en physique des particules ( physique atomique, sub-atomique ,... avec notamment le paradigme du "modèle standart des particules"
Voiçi un résumé des particules fondamentales de la matière et de leur caractéristiques de base
Le nombre de protons est noté Z, le nombre de neutrons est noté N, celà nous donnera un noyau de charge +Z et de masse voisine de Z+N ( voir tableau final du point I.B.2), que l'on appelle nombre de masse de l'élément , la masse des électrons étant pratiquement négligeable.
Défaut de masse des noyaux et énergie de cohésion : Si nous considérons les masses atomiques rigoureuses des particules fondamentales :
Neutron : 1, 00897 ou 01n
Proton : 1,00759 ou 11p
Electron : 0,00549 ou -1e
On peut s'attendre à ce que la masse atomique d'un élément caractérisé par un nombre quantique Z et un nombre de masse N soit :
(M-Z) . 1,00867 + Z . 1,00759 + Z . 0,000549.
Il en est bien ainsi dans le cas de l'hydrogène léger, dont le noyau est constitué d'un seul proton, mais pour tous les autres noyaux , la masse trouvée est inférieure à cette somme.
Le phénomène est général, on obtient un défaut de masse, Δ M lequel mesure l'énergie de cohésion du noyau :
ΔE = Δm . c2
énergie qui est la manifestation du caractère exothermique des phénomènes d'association des particules fondamentales lors de la formation des noyaux. Cettev énergie rapportée au nucléon est très faible pour les atomes légers. Elle passe pour un maximum pour Z + N = 65 et décroît ensuite lentement. Elles est donc très faible et dans la plupart des calculs nous pourrons
Isotopie : Comme nous allons le voir, un élément sera essentiellement caractérisé chimiquement par le nombre d'électrons qui gravitent autour de son noyau, donc par son numéro atomique Z.
On appellera isotopes d'un même élément, des atomes caractérisés par une même valeur de Z qui diffèrent par leur nombre de masse, donc par le nombre de noyaux contenus dans le noyau. Les propriétés chimiques de ces atomes seront les mêmes ; les différences essentielles portant sur les propriétés physiques liées à la masse.
Comme en représentant un élément par son symbole avec en indices les valeurs de Z et A = Z+N :
AZ Symbole
On aura pour les isotopes d'un même élément :
11H: 1 électron - noyau = 1 proton
:12H: 1 électron - noyau = 1 proton + 1 neutrons
: 13H: 1 électron - noyau = 1 proton + 2 neutrons
: 816O: 8 électrons - noyau = 8 protons + 8 neutrons
Le phénomène d'isotopie est général, et la plupart des éléments naturels se présentent sous la forme d'un mélange d'isotopes. Notons qu'il est possible de préparer des isotopes artificiels ( radiochimie ). En général, la composition isotopique d'un même élément est indépendante de son origine.
Sa masse atomique caractéristique est donc une moyenne, ce qui explique certains écarts importants par rapport à des valeurs entières . Les masses atomiques des différents isotopes sont déterminés par spectrométrie de masse.
Par exemple : la masse atomique moyenne du chlore est 35,43. Les isotopes naturels sont : 1735Cl et 1737Cl
ainsi soit x = pourcentage de 1735Cl et y pourcentage de 1737 Cl , on a alors
x+y = 1
x . 35 + y . 37 = 35,453
(1-y).35 +y.37 = 35,443
35 - 35 y + 37 y = 35,443
2y = 0,443 et y = 0,2215 : y = 22,15 % et x = 77,85 %
La radioactivité : Dans le noyau, les protons et les neutrons ne sont pas distribués au hasard et on a remarqué la stabilité de certains groupements de nucléons. Certains groupements, au contraire, sont instables et évoluent au cours du temps en donnant naissance à des groupements plus stables , le nombre atomique Z pouvant être conservé ou modifié. C'est BECQUEREL qui découvrit par hasard, lors de l'étude de fluorescence sur des sels d'uranium, que ces derniers étaient capables d'émettre , sans insolation préalable des rayonnements. Rutheford soumis plus tard ce faisceau de rayons à l'action d'un champs magnétique et il observa que le rayonnement émis par certains corps , appelés radioactifs , pouvait présenter 3 aspects différents :
Les rayons β, déviés comme les rayons cathodiques, qui ont été identifiés à un faisceau d'électrons
Les rayons α, chargés positivement , qui ont été identifiés à des noyaux d'hélium , porteurs de deux charges positives
Les rayons γ , non déviés, très pénétrants et de nature assez semblable aux rayons X
La radioactivité a donc été définie comme la propriété de certains substances d'émettre spontanément un rayonnement accompagné de la désintégration de l'élément qui rayonne.
Les éléments radioactifs naturels sont des éléments de numéro atomique assez élevé ( Z>88). D'autres éléments radioactifs peuvent prendre naissance par action des particules sur le noyau d'un élément ( radiochimie ). Exemples :
511H + 24He ===> 11H + 614C* ( réaction α,p).
510B +11H ===>47Be* + 24He (réaction p,α).
Date de dernière mise à jour : 29/11/2018
Ajouter un commentaire