- Accueil
- E. Chimie
- I.Chimie générale
- Chimie générale 9
Chimie générale 9
I.V INTRODUCTION CONCEPTUELLE AUX LIAISONS CHIMIQUES
1) La notion de rayon atomique
Lorsque l'on discute de la " grosseur " des atomes et de ses variations en fonction du numéro atomique, on admet implicitement qu'ils ont une forme spécifique . Leur grosseur est donc définie par la valeur de leur rayon.
Mais il est difficile de définir de façon précise ce que l'on entend par volume, ou rayon d'un atome. Un atome est surtout fait de vide , il n'a pas de limite précise dans l'espace, ne possède pas de surface, ni par conséquent de volume défini !
Dans le modèle de Bohr, on pourrait considérer comme rayon de l'atome celui de la plus grande trajectoire électronique ; tous les électrons seraient à l'intérieur de la sphère fictive possèdant ce rayon. Mais dans le modèle ondulatoire de l'atome , on ne peut pas attribuer une trajectoire précise à l'électron. On connait seulement la probabilité de leur présence dans une région donnée de l'espace autour du noyau ; elle diminue quand la distance au noyau augmente. Mais ne devient strictement nulle qu'à l'infini. Le volume d'un atome isolé, tout comme son rayon, est donc une notion dénuée de signification physique.
Mais l'expérience montre que les atomes se comportent pourtant les uns envers les autres comme s'il étaient des sphères compactes impénétrables les unes aux autres. Lorsque deux atomes se rapprochent , ils se manifestent aux très courtes distances, des forces de répulsion électrostatique.entre leurs électrons et entre leurs noyaux . Ces forces sont telles que dans certaines conditions détrminées , la distance des noyaux de deux atomes non liés ne peut devenir inférieure à une certaine valeur, variable selon la nature de ces atomes . Dautre part, on constate que la distance entre les centres d'atomes liés ( dans une molécule ou dans un cristal par exemple ), n'est pas quelconque.
Le rayon que l'on peut ainsi attribuer aux atomes, à partir de la plus grande proximité possible de ses voisins, n'est pas le même dans toutes les circonstances ; on est ainsi conduit à attribuer plusieurs rayons à un même atome. Par exemple le rayon du Sodium n'est pas le même selon qu'il s'agit de vapeur monoatomique, de sodium métallique solide ou d'un composé comme le chlorure de sodium. Dans ce chatitre sont envisagés le cas des atomes non liés et celui des atomes liés dans une molécule . Dans le chapitre suivant sera défini le rayon ionique.
1.1 Le rayon de Van Der Waals et le rayon de covalence
Le rayon de Van Der Waals est une mesure de la distance minimale à laquelle peuvent s'approcher deux atomes de cet élément quand ils ne se lient pas . C'est, par exemple le cas, de deux atomes d'un même élément appartenant à deux molécules distinctes , lorsque celle-ci viennent " au contact" l'une de l'autre dans un choc.
Le rayon de Van Der Waals est une mesure de l'encombrement d'un atome, vis à vis de ceux qui peuvent s'approcher de lui. Ce qui suit contient les valeurs du rayon de Van Der Waals de quelques éléments.

1.2 La longueur des liaisons
On appelle longueur de liaison la distance entre les centres ( noyaux ) de deux atomes unis par une liaison chimique.
La longueur d'une liaison symétrique, entre deux atomes identiques, est par définition égale au double du rayon de covalence de l'élément.
Dans le cas d'une liaison mixte, entre deux atomes différents, les rayons de covalence des deux atomes sont additifs, avec une bonne approximation par rapport aux valeurs expérimentales des longueurs des liaisons. On peut donc calculer, au moins approximativement , la longueur d'une liaison quelconque en faisant simplement la somme des rayons de covalence des deux atomes qu'elle unit.
Exemple : la longueur de la liaison H-Cl ( distance entre les deux noyaux dans la molécule H-Cl) est égale à la somme du rayon de covalence de H ( défini à partir de la molécule de H2 ), soit 0,037 nm, et du rayon de covalence de Cl ( défini à partir de la molécule Cl2 ), soit 0,099 nm, elle vaut donc 0,037+0,0pp = 0,136 nm ( valeur expérimentale : 0,127 nm ).
2) Variation du rayon atomique avec le numéro atomique
La figure qui suit représente les variations de covalence en fonction du numéro atomique des éléments. Les tendances qui étaient déjà observables sur les données partielles des tableaux précédents se confirment et se généralisent :
- le rayon atomique diminue du premier au dernier élément d'une période ( mis à part quelques irrégularités pour les éléments des blocs d et f ), puis augmente brusquement au début de la période suivante.
- le rayon des éléments d'une même colonne augmente avec Z ( voir, par exemple, les séries Li,Na,K,Rb,Cs ou F,Cl,Br,I).
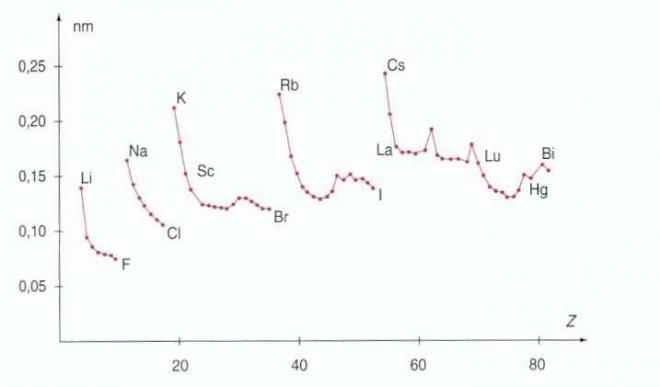
Soit, le rayon atomique diminue en traversant une période de gauche à droite(excepté quelques irrégularités pour les éléments des blocs d et f).Cela vient du fait que l'augmentation systématique de la charge nucléaire en traversant la période contracte les orbitales électroniques. Le noyau pour un nombre de couches égales, exercera un attraction d'autant plus forte (notamment sur les électrons de valence), qu'il y aura d'électrons. Le rayon atomique augmente avec Z dans une même colonne.Ceci est dû à l'accroissement de la fonction radiale lorsque l'on descend un groupe provenant de l'augmentation du nombre quantique principal n. Les électrons évoluent plus loin du noyau quand le nombre quantique principal de la couche à laquelle ils appartiennent est grand.
Chaque électron est attiré par le noyau mais repoussé par les autres électrons. En conséquence, l'attraction réellement "percue" par un électron, est inférieure à celle qu'il "percevrait s'il était seul. On dit que les autres électrons font écrans entre lui et le noyau. Afin de tenir compte de cet effet d'écran, on définit pour le noyau, une charge nucléaire effective ( c'est à dire produisant un " effet" ) différente de sa charge réelle +Z.
3) La charge nucléaire effective
Tout se passe donc en définitive, comme si la charge du noyau était inférieure à sa charge réelle de + Z, on appelle charge nucléaire effective Z* ( C.N.E ) la charge d'un noyau fictif qui exercerait sur un électron, en l'absence des autres la même influence que l'ensemble noyau réel + autres électrons.
On obtient la valeur de la CNE, pour un électron particulier, en retranchant de la valeur réelle Z une quantité calculée par addition de contributions individuelles dues à à chacun des autres électrons, conformément aux règles suivantes :
1) Ecrire la configuration électronique de l'élément en formant des groupes d'électrons comme indiqué ci-après par les parenthèses ( 1s),(2s,2p),(3s,3p),(3d),(4s,4p),(4d),(4f), etc...
2) Les électrons appartenant à un groupe situé à droite de celui de l'électron considéré n'apportent pas de contribution à l'effet d'écran exercé sur celui-ci.
3) Les autres électrons du même groupe apportent chacun une contribution égale à 0,35.
4) Pour calculer la contribution des électrons appartenant à un groupe situé à gauche de celui de l'électron considéré, deux cas sont à distinguer :
- L'électron considéré de nombre quantique principal n, se trouve dans un groupe (s,p) : les électrons de la couche précédente ( n-1) apportent alors chacun une contribution de 0,85 et ceux des couches plus interne ( ( n-2,n-3,...) une contribution de 1,00
- L'électron considéré est dans un groupe (d) ou (f) : chacun des électrons de tous les groupes situés à gauche de celui-ci apporte une contribution de 1,00.
Pour un même atome, la charge nucléaire effective peut donc être différente selon l'électron considéré.
Exemple : Pour un électron externe s ou p de l'oxygène ( Z=8), de configuration ( 1s2) , ( 2s2, 2p4 ) , l'effet écran est exercé par 5 électrons du même groupe (s,p) et deux électrons der la couche précédente. Donc : Z* = 8 - [(5 x 0,35 ) + ( 2 x 0,85)] = 4,55.
4) Rayon atomique et classification périodique
Dans une colonne du tableau périodique ( par exemple la série Li, Na,KRb,Cs ) , chaque élément possède une couche électronique de plus que celui qui est au-dessus de lui. D'autre part, bien que la charge réelle Z du noyau augmente sensiblement d'un élément suivant, la C.N.E augmente peu. Le volume atomique augmente donc régulièrement.
Dans une période ( par exemple, la série Li,...Ne), le nombre de couches est constant, mais la C.N.E augmente régulièrement , les rayons atomiques diminuent donc de la première à la dernière colonne.
Quand on passe du dernier élément d'une période au premier de la période suivante, une nouvelle couche reçoit un premier électron et simultanément la C.N.E.diminue fortement.En effet, les électrons qui sont externes à la fin d'une période deviennent alors internes et exercent un effet d'écran plus fort. Ceci explique la brusque augmentation du rayon atomique .
Date de dernière mise à jour : 29/11/2018
Ajouter un commentaire




