- Accueil
- E. Chimie
- I.Chimie générale
- Chimie générale 8
Chimie générale 8
III. CLASSIFICATION PERIODIQUE DES ELEMENTS
A. HISTORIQUE
Au début du 19è siècle, au fur et à mesure de la découverte des éléments et devant leur diversité , les chimistes remarquant que certains d'entre-eux présentent des analogie de propriétés chimiques, tentèrent d'élaborer une classification rendant compte de ces analogies. Immédiatemment après leur découverte, les masses atomiques furent prises comme critère de classement, par valeurs croissantes.Après plusieurs tentatives, notamment par Chancourtois, Lotar, Mayer, Newland, Mendeléev aboutit en 1871 à l'établissement d'un tableau où les éléments de propriétés analogues apparaissent dans une même colonne verticale.Pour ce, il classait les éléments ( connus ) par ordre de masse atomique croissante,en allant à la ligne chaque fois qu'il rencontrait un élément présentant des analogies avec un élément plus léger ( actuellement, nous dirions chaque fois que l'on rencontre un gaz rare ).
Il arriva ainsi à un tableau de 8 colonnes où les propriétés des éléments varient de manière régulière dans les lignes horizontales ( périodes ) et sont semblables dans une même colonne verticale. Cette classification donna lieu à de nombreuses contraoverse.
Ses détracteurs lui reprochaient un certain caractère arbitraire, vu l'obligation de permuter certains éléments ( K,Ar ; Ni,Co ; Te,I) pour rendre compte des analogies, l'obligation de créer une colonne supplémentaire lors de la découverte des gaz rares et surtout à cause de la présence de nombreuses cases vides.
Mais Mendeléev triompha car sa classification lui permet de confirmer certaines masses atomiques , d'en faire réviser d'autres et surtout de prédire 6 éléments nouveaux ( Se,Ga,Ge,Tc,Rh,Po) en prévoyant avec une étonnante précision les propriétés de ces éléments.
Les seuls inconvénients persistants ( inversions ) disparurent lors de la découverte des nombres atomiques qui furent pris comme critères de classification. Ils s'interprétèrent d'ailleurs par la notion d'isotopie .
B. ETUDE DE LA CLASSIFICATION
La classification par numéros atomiques montre une périodicité des propriétés des propriétés des éléments en fonction de la charge du noyau, ou plus exactement du nombre d'électrons, Nous remarquons en effet, à l'examen, que les éléments se polacant dans les colonnes verticales présentent des analogies de structure de la couche électronique externe ( électrons de valence ).
Plusieurs projets de tableaux ont été présentés, nous en retiendrons essentiellement deux :
1. Une forme courte
Caractérisée par l'existence de sous groupes A et B dans les 7 premières colonnes, chaque période se terminant par un gaz rare.
tableau 1
Cette forme représente un inconvénient , les éléments de transition ( correspondant au remplissage des couches d ) se placent dans les mêmes colonnes que les éléments des familles principales. On pourrait être tenté de déduire des analogies marquées des propriétés de ces éléments alors que, alors qu'en réalité, le seul caractère vraiment commun est l'état d'oxydation maximum ( Ex Mn et Halogènes ). Caractérisée par l'existence des sous-groupes A et B dans les 7 premières colonnes, chaque période se terminant par un gaz rare.
2. Une forme longue.
qui comporte 18 colonnes.
Les sept périodes d'inégales longueurs, contenant respectivement 2,8,8,18,18,32 et 17 éléments , la dernière est incomplète. Cette forme présente divers avantages. Elle fait mieux ressortir les familles d'éléments et mets bien en évidence les éléments dits " de transition " et "subtransitoires "
De plus comme nous allons le voir, elle traduit mieux que la forme courte la structure électronique des éléments successifs.
C. RAPPORT ENTRE LA STRUCTURE ELECTRONIQUE DES ELEMENTS ET LEUR POSITION DANS LE TABLEAU PERIODIQUE
Essayons de reconstituer le tableau périodique en tenant compte des ordres de remplissage des états, par énergies croissantes. Nous allons ainsi faire apparaître la périodicité des structures électroniques.
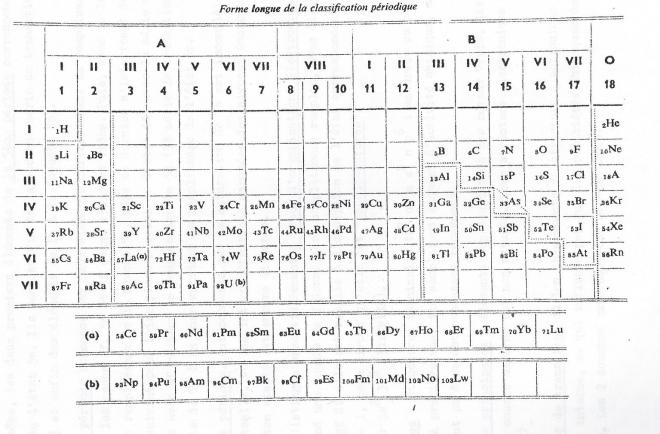 tableau2
tableau2
La connaissance de la structure des atomes isolés permet de constater que le remplissage successif des coques extérieures conduit à une périodicité dans la structure électronique. On observe en effet ue l'arrangement de chaque coque externe est toujours répété lorsque l'on augmente progressivement le nombre atomique.
La première période correspond au remplissage de la couche K ( état 1s) ne comprendra que les deux éléments H et He, c'est la première coque.
La seconde période correspond au remplissage de 2s et 2p, soit 8 éléments supplémentaires, cette seconde période commence avec le Lithium comportant 3 électrons qui démarre la seconde période avec remplissage progressif 1s2 2s1 La suite se fait avec le Bérylium Z = 4 (...) 2s2, Le Bore ( Z=5) correspond au début du remplissage de la coque 2p ==> 2p1 , le carbone : 2p ==> 2p2, et ensuite l'azote possède 3 électrons sur 2p, l'oxygène 4 électrons sur 3p, le fluor 5 et le néon 6.
La troisième période commence avec le Sodium qui comporte 11 électrons et se poursuit avec 7 éléments qui rempliront les couches 3s et 3p, ce qui porte à 8 le nombre d'éléments de la coque 3. A ce stade de remplissage du niveau M, on pourrait envisager le remplissage du niveau d avec 10 électrons , mais en fait la couche 4s est plus stable on la remplit donc par 1 électron en 4s du potassium ( K) et 2 électrons au niveau de la coque 4s du Calcium ( Ca ) dont le nombre atomique est 20, ceci étant fait, on commence alors avec le remplissage de la couche 3 d ( Sc , Z = 21 ) et ses 5 cases quantiques ( 10 électrons, ce sont les 10 éléments de transition du niveau 4 ou N)arrivant au Zn (Z = 30).
La quatrième période : Enfin, la couche 4 continue à se remplir avec le Ga ( Z = 31) en sa sous-couche 4 p soit 6 électrons, cette période comporte 18 éléments et se termine avec le Krypton ( Z = 36 ). On se retrouve dans une situation similaire à la précédente, tenant compte du fait que la couche 5s est plus stable que la couche 4d ; c'est donc par 5s que continue le remplissage.
La cinquième période .L'orbitale 5s est alors remplie par les structures du Rubidium et du strontium. suivant une nouvelle série de transition ( remplissage de 4d de Y à Cd ) de 10 éléments de 4d et enfin des éléments de la couche 5p ( In à Xe ).
La sixième période commence par deux éléments correspondant au remplissage de la couche 6s, les cases 4f,5d, et 5f étant toujours vides. Puis avec le lanthane commence le remplissage de la couche 5d, mais ce dernier s'interrompt déjà à l'élément suivant pour faire place à celui de l'état 4f, avec la série des lanthanides, puis avec Hf reprend le remplissage de 5d ( 3ème série de transition ). Enfin, les éléments de Tl à Rn, correspondent au remplissage de l'état 6p.
La septième période qui commence avec la saturation de l'état 7s est incomplète et actuellement, vu les interpénétrations marquéesdes niveaux électroniques, des difficultés subsistent quant à sa configuration exacte.
On distingue essentiellement 4 types d'organisation électronique
Quand un couche de N donné sera complètement remplie, nous dirons qu'elle est saturée. Si elle est remplie à l'exception de l'état correspondant à l'état maximum de l, nous dirons qu'elle est pseudo-saturée ex, 3s2 3p6 ( 3d vide)
1. Gaz rares : structures terminales 1s2 ou ns2 np6 : saturées ou pseudo-saturées. A première vue dénuées d'activité chimique , mais des composés ont pu être obtenus.
2. Familles principales : éléments représentatifs des métaux vrais, des non-métaux. Seule leur couche externe est non saturée. Leur structure électronique va de ns1 à ns2 np5. orbitales d remplies, absentes ou vides
3. Eléments de transition où les changements de structure électronique qffectent une couche interne , ce qui influencera peu sur les propriétés chimiques comme nous le verrons . Les deux couches externes sont non saturées.orbitales d partiellement remplies, orbitales f soit absentes, soit vides, soit remplies, orbitales p vides
4. Les éléments subtransitoires : lanthanides et actinides : les 3 couches externes ne sont ni saturées ni pseudo-saturées. orbitales f partiellement remplies .
Pour trouver la structure de la coque valencielle d'un élément, sans chercher celle du coeur , il suffit de localiser l'élément dans le tableau . Le période donne immédiatemment la nature des orbitales à considérer. Le numéro d'ordre dans la période donne le nombre d'électrons à répartir . Ainsi, le sélénium étant le 16ème élément de la 4éme période , la coque valencielle comporte une orbitale 4s, 5 orbitales 3d et 3 orbitales 4p entre lesquelles il y a 16 électrons à répartir . Ceci conduit à 4s2 . 3d 6. 4p4.
En tenant compte de ces faits, on comprend que les éléments d'un même groupe , figurant dans une même colonne du tableau, ont des coques valencielles très semblables : elles comportent le même nombre d'électrons répartis sur des orbitales de même forme .
Ainsi la coque valencielle des éléments du groupe Ia peut être représentée par la formule générale ns1. Celle du groupe IVb par ns2 nd2 et celle du groupe VIIa par ns2 np5. De la même coque valencielle des éléments " inertes" à l'exception de l'Helium aura le structure ns2 np6.
D. EVOLUTION PERIODIQUE DES PROPRIETES
Historiquement parlant, c'est suite à une observation d'analogies de propriétés physiques et chimiques d'éléments connus que sont apparues les idées de famille, de classification et de périodicité dans cette classification. Les raisons de cette périodicits dans cette classification, comme nous venons de le montrer, elles résident essentiellement dans la distribution des électrons autour du noyau, et plus exactement dans le renouvellement périodique de la constitution électronique externe qui entraîne une périodicité des propriétés,tant physiques que chimiques.
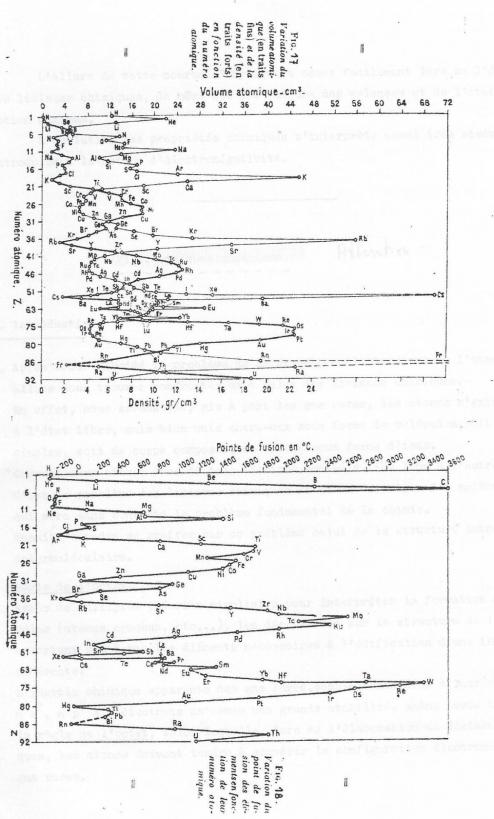
A titre d'exemple, les figures qui suivent nous donnent les variations du volume atomique, de la densité et de la température de fusion des éléments en fonction du numéro atomique.
On obtiendrait une courbe ayant même allure pour le potentiel de permière ionisation ( énergie nécessaire à l'arrachement d'un premier électron ).
Rappelons que :
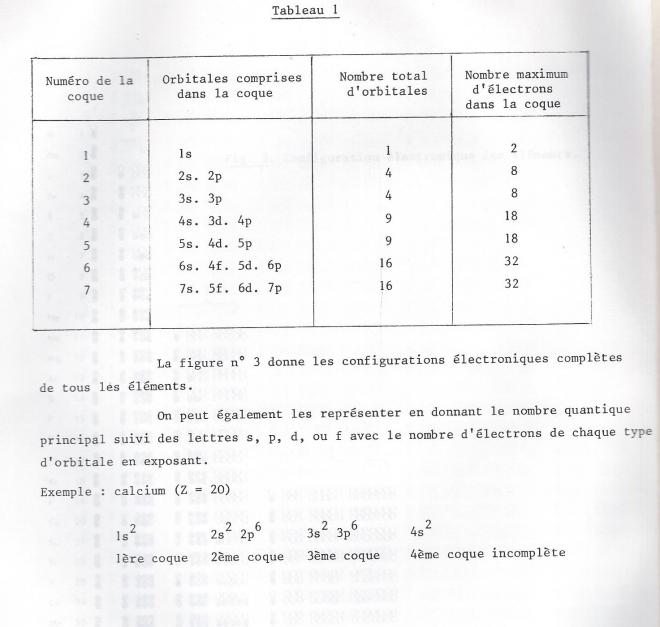
- La capacité maximale de chacune des coques et des niveaux électroniques de l'atome est indiquée dans ce petit tableau
- Aucune orbitale p ne contient d'électron avant que le niveau s immédiatemment supérieur ne soit rempli. Par conséquent, il n'y a jamais plus de 8 électrons dans la coque externe d'un atome .
- Le niveau d commence toujours à se remplir dès que le niveau s immédiatemment supérieur a été rempli. Les éléments correspondant au remplissage de ces niveaux d sont les éléments transitoires.
- Les orbitales 4f ne contiennent jamais d'électrons avant que les niveaux 5s, 5p, 6s ne soient remplis et qu'un électron et qu'un électron ne se trouve sur le niveau 5d . De même que le niveau 5f ne se remplit que lorsque les niveaux 65,6p, et 7s sont pleinset que deux électrons se trouvent sur le niveau 6d, par conséquent, il n'y a jamais plus de 18 électrons dans l'avant dernière coque électronique.
Les électrons de la couche de nombre n le plus élevé dans l'état fondamental jouent le rôle principal dans les réactions chimiques . Ce sont eux , en particulier qui participent à la formation des liaisons . On appelle cette couche couche externe , ou couche périphérique , ou encore couche de valence
Compléments : tableau 3
 L'existence, dans cette couche , de doublets, d'électrons impairs, ou de cases vides détermine dans une mesure importante les propriétés chimiques. C'est l'information la plus importante dans une configuration électronique.
L'existence, dans cette couche , de doublets, d'électrons impairs, ou de cases vides détermine dans une mesure importante les propriétés chimiques. C'est l'information la plus importante dans une configuration électronique.
Dans la pratique il existe une certaine ambigüité à propos de la définition de la "couche de valence" et des " électrons de valence " .
Les éléments de transition ( remplissage de la couche d ) possèdent une sous-couche ( n-1)d ( n étant le nombre quantique principal ) incomplète , dont les électrons peuvent participer aussi à l'ionisation et aux réactions chimiques . On considère donc parfois aussi ces électrons d comme des " électrons de valence " .
D'autre part, dans l'état fondamental, les électrons de la couche de nombre le plus élevé sont uniquement des électrons s ou p . Mais on est amené, pour justifier la formation de certains composés , à considérer des "états" de valence dans lesquels certains de ces électrons sont placés dans des cases d .
Evolution périodique des propriétés
Historiquement parlant, c'est suite à l'observation d'analogies de propriétés physiques et chimiques d'éléments connus que sont apparus les idées de famille, de classification et de périodicité dans cette classification. Les raisons de cette périodicité ne sont apparues que plus tard , comme nous venons de le montrer , elles résident essentiellement dans la distribution des électrons autour du noyau , et plus précisément dans le renouvellement périodique de la constitution électronique externe, qui entraîne une périodicité des propriétés tant physiques que chimiques.
A titre d'exemple , les deuxième et troisième figure qui suivent nous donnent les variations du volume atomique, de la densité et de la température de fusion des éléments en fonction du numéro atomique.
On obtiendrait une courbe de même allure pour le potentiel de première ionisation ( énergie nécessaire à l'arrachement d'un premier électron ).

tableau 4
 tableaux 5 et 6
tableaux 5 et 6
L'allure de ces courbes s'expliquera assez facilement lors de l'étude des liaisons chimiques , de même que les valeurs des valences et de l'état d'oxydation maximum. L'évolution des propriétés chimiques s'interpréte aussi aisément en introduisant la notion d'électronégativité.
Date de dernière mise à jour : 29/11/2018
Ajouter un commentaire


