- Accueil
- E. Chimie
- I.Chimie générale
- Chimie générale 7
Chimie générale 7
II. LE MODELE ATOMIQUE DE BOHR
II.1 STRUCTURE ATOMIQUE DE L'ATOME. ORGANISATION DU NUAGE ELECTRONIQUE
1.Le modele de Rutherford
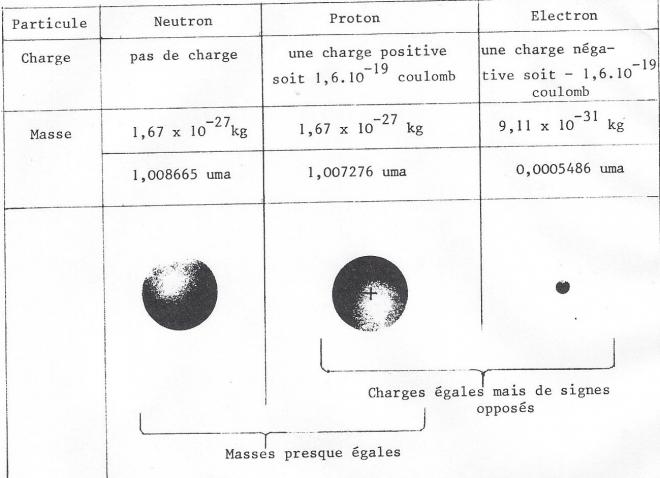
Un atome quelconque, résulte, comme nous venons de le dire, de l'association d'un noyau de charge + Ze avec Z électrons de charge élémentaire - e.
Nous devond forcément admettre que cette coexistence repose sur un état dynamique. En effet, si les électrons étaient fixes, attirés par la charge positive du noyau, ils tomberaient sur celui-ci.
Pour que l'ensemble soit mécaniquement possible, il faut admettre que les électrons parcourent des orbites autour du noyau avec une vitesse suffisante pour que la force centrifuge à laquelle ils sont soumis compense la force attractive du noyau.
Rutheford propose donc cette représentation de l'atome : un noyau central positif autour duquel gravitent à grande vitesse des électrons, en nombre égal à la charge de l'atome ( atome planétaire).
2. L'atome de Bohr
Le modèle de Rutherford s'il donna le signal des recherches en matière de la structure de l'atome ne résista pas longtemps, incapable de donner des explications satisfaisantes de certains phénomènes observés.
Ainsi, si l'électron, particule chargée, tourne autour du noyau,il doit émettre de l'énergie lumineuse ( rayonnement électro-magnétique ). C'est donc qu'une partie de son énergie de liaison est transformée en énergie lumineuse. Dans ces conditions, l'énergie du système doit diminuer , donc l'électron doit se rapprocher insensiblement du noyau et finira par tomber sur celui-ci.
D'autre part, l'énergie de l'électron variant de façon continue , le spectre d'émission devrait être continu; ce qui est contradictoire avec l'expérience . On sait que si l'on relève les raies émises par une décharge électrique dans l'hydrogène, on constate qu'elles correspondent à des longueurs d'ondes bien déterminées, le spectre d'absorption étant identique au spectre d'émission.
Niels Bohr , pour répondre à ces observations, propose un autre modèle de l'atome en se basant sur les hypothèses fondamentales suivantes ( nous utilisons ainsi les conceptions établies ci-avant dans le chapitre atomistique ):
- L'électron qui gravite autour du noyau échappe aux lois de la mécanique classique et peut rester sur certaines orbites priviégiées sans rayonner. Son énergie restera donc une constante aussi longtemps qu'il restera sur cette orbite.
- Cette seconde hypothèse est basée sur la théorie des quanta, introduite par Planck vers 1900 : selon lui, l'énergie rayonnante a aussi une structure discontinue. Selon lui elle a aussi une structure discontinue . Elle est formée par accumulation d'un certainnombre de "grains d'énergie ou quanta.Dans ces conditions, la cession d'énergie par un atome au milieu extérieur ne peut se faire que par l'intermédiaire de "quanta" d'énergie lumineuse. Cette seconde hypothèse de Bohr dit que cette cession d'énergie se fait par transfert d'un électron de l'atome d'une orbite stationnaire où son énergie est E2 à un autre orbite stationnaire où son énergie est E1, avec émission d'un quantum d'énergie Q .
Dès lors : E2 - E1 = Q = hν
où h est une constante et ν la fréquence de la radiation émise, car l'énergie d'une radiation de longueur d'onde λ est poportionnelle à sa fréquence ν .
Il y a émission quand l'électron s'approche du noyau, absorption quand il s'en éloigne.
Si un électron est déplacé dans un atome par rapport à son état fondamental , on dira que l'atome est "excité".
Si l'électron est complètement séparé de l'atome, on dit que celui-ci est " ionisé "
Voiçi , concernant les hypothèses de Bohr, un certain nombre de calculs qu'il est avantageux de comprendre.
a) Mouvement circulaire de l'électron autour du noyau


b) Fin sur l'hypothèse du mouvement circulaire des électrons ( aspect mécanique ) et début sur la quantification du moment cinétique de ceux ci


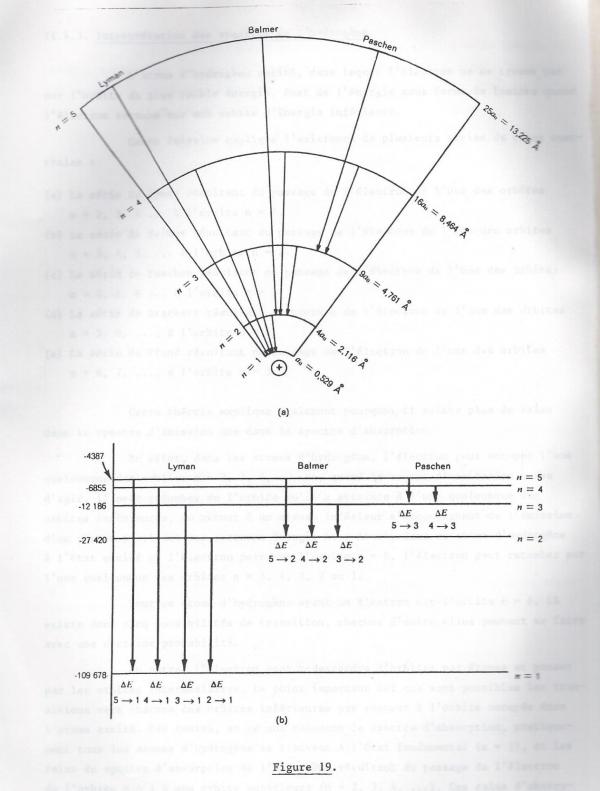
c) Interprétation des spectres de l'hydrogène



Revenons à Bohr, on a conservé ses principes fondamentaux et ses explications qualitatives ;
1) Nombre quantique principal
Il définit à cette fin 7 niveaux énergétiques différents dans les atomes, qu'il désigne par les lettres K,L,M,N,O,P,Q, K étant le plus proche du noyau ou par des valeurs numériques allant de 1 à 7. Cette valeur numérique de la situation énergétique du niveau électronique supposé sphérique de Bohr, est appelé nombre quantique principal : n
Nous constaterons plus loin, comme nous l'avons évoqué, déjà, que la différence d'énergie entre deux niveaux successifs diminue rapidement avec l'augmentation de n.
2) Nombre quantique secondaire ou azimutal
Il a été établi qu'un niveau électronique de nombre quantique principal n donné, se subdivise en n-1 sous niveaux caractérisés par un nombre secondaire ou azimutal l qui peut prendre toutes les valeurs entière de 0 à n-1. : 0≤ 1≤ n-1
Ces faits avaient d'ailleurs été mis en évidence expérimentalement, grâce aux perfectionnements apportés aux spectroscopes, ceux-ci, permettant une plus grande dispersion du spectre avaient montrés qu'une raie correspondant à une transition électronique de la couche K à la couche L est double , une raie correspondant à un saut d'électron de K à M est triple , etc ... Ces faits prouvent bien que les niveaux L et M ne sont pas définis par une seule valeur d'énergie mais respectivement par deux et trois valeurs très voisines.
Ainsi, selon Sommerfeld , chaque niveau énergétique a plusieurs orbites privilégiées, non circulaires, qui différent par leur énergie et par leur forme ( on a montré que n caractérise len grand axe de l'ellipse, l le petit axe ) quel que soit la valeur de n, les orbites de même l auront même forme.
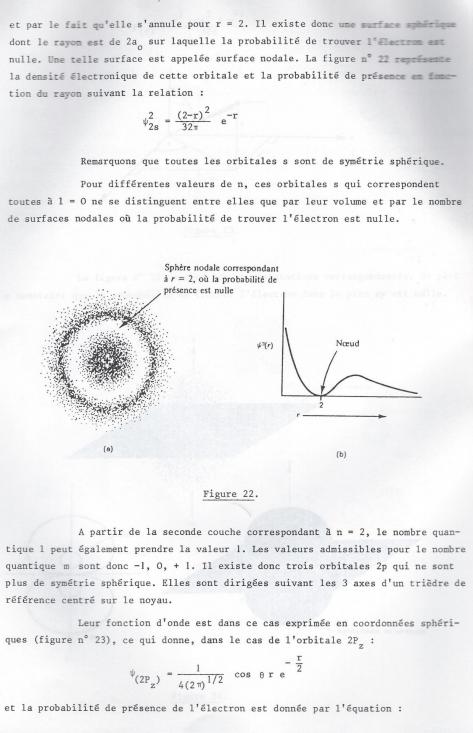
On pourrait noter ces trajectoires par les 2 paramètres n et l mais la tradition veut que l'on utilise un système où l'on fait suivre le nombre quantique principal d'une des lettres s,p,d,f,... celles ci corrrespondant à l = 1,1,2,3...
3) la quantification dans l'espace. Le nombre quantique magnétique .m.
Nous ne nous sommes pas jusqu'à présent préoccupés de l'orientation dans l'espace des trajectoires décrites par l'électron. Cette étude confirmée mathématiquement, a été réalisée mathématiquement, en étudiant le spectre d'un atome plongé dans un champs magnétique. On constate que certaines raies se démultiplient, ce qui montre que l'influence du champ sur des orbitales de même l n'est pas la même pour toutes. Autrement dit, ces orbitales diffèrent par leur orientation dans l'espace. L'orientation d'une orbitale, ou son comportement dans un champ magnétique donné sera définie par un troisième nombre quantique m, magnétique. La mécanique quantique a montré qu'il peut prendre toutes les valeurs entières comprises entre -l et +l
-l ≤ m ≤ +l
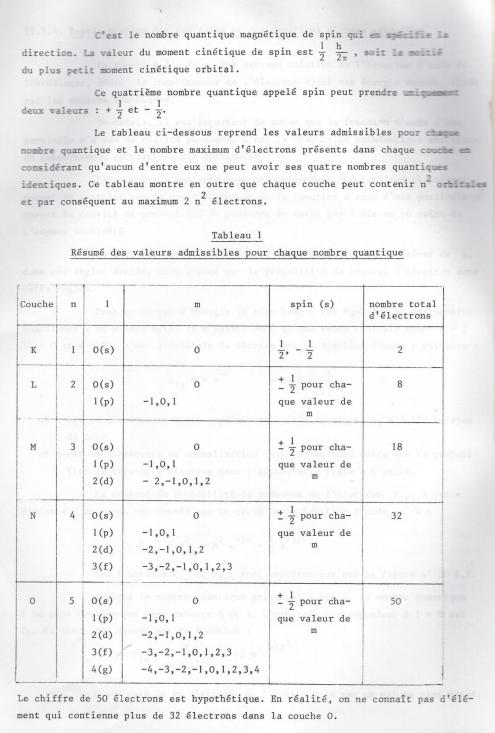
4) Le nombre quantique de spin : s
L'existence de ce quatrième nombre quantique a été mise en évidence grâce à l'étude du spectre de sodium avec un spectrographe assez dispersif. Le spectre observé en l'absence de tout champs magnétique montre en effet un dédoublement de raies, mais les longueurs d'ondes sont si proches que les transitions énergétiques correspondantes sont trop faibles pourqu'on puisse les attribuer à des changements des paramètres n ou l.
C'est Goudsmit et Uhlenbeck qui ont émis l'hypothèse que,outre les diverses dépendances définies ci-dessus, l'électron est en outre capable de tourner sur lui-même. Cette rotation est aussi quantifiée et on donne au nombre quantique de spin qui la caractérise la valeur +/- 1/2.
En résumé
n : nombre quantique principal définit l'ordre de grandeur du niveau énergétique . Il peut prendre toute valeur entière positive entre 1 et 7.
l : nombre quantique secondaire ou azimutal va définir l'énergie de l'orbitale au sein du niveau ainsi que la forme de l'orbitale
0 ≤ l ≤ n-1
m : nombre quantique magnétique, détermine l'orientation de l'orbitale au sein de l'atome
-l ≤ m ≤ + l
s : nombre quantique de spin définit le sens de rotation de l'électron sur lui-même
s = +/- 1/2
5) Structure périnucléaire de l'atome
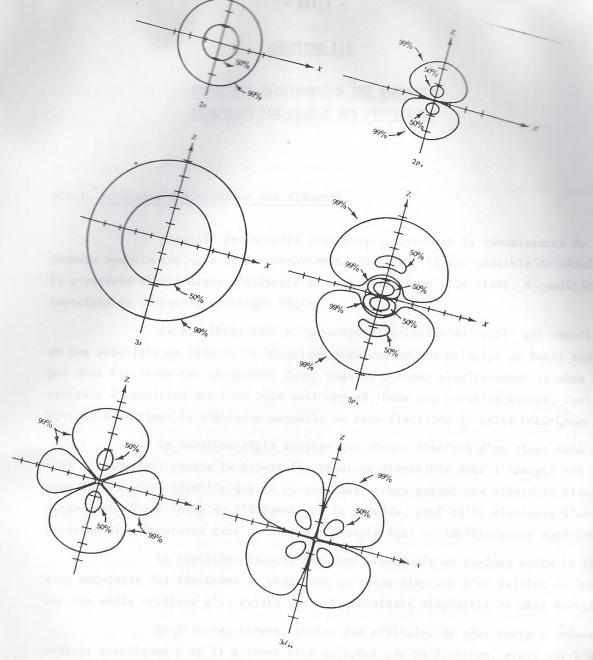
a) Sur la base des données précedentes, nous allons imaginer quelles peuvent être les différentes cases quantiques ou orbitales possibles dans chacun des principaux niveaux énergétiques.Nous verrons qu'une orbitale représente la zone de probabilité de présence d'un électron d'état quantique déterminé.
Si n = 1 :
l = 0 ==> m = 0 : 1 orbitales, en tout 1 orbitale
Si n = 2 :
l = 0 ==> m = 0 : 1 orbitale s , ou
l = 1 ==> m = -1,0,1: 3 orbitales p, en tout 4 orbitales
Si n = 3
l = 0 ==> m = 0 : 1 orbitale s
l = 1 ==> m = -1,0,1: 3 orbitales p
l = 2 ==> m = -2,-1,0,1,2 : 5 orbitales d, en tout 9 orbitales
De même pour n = 4 nous aurions :
1 orbitale s
3 orbitales p
5 orbitales d
7 orbitales f , en tout 16 orbitales
A l'heure actuelle, on ne connaît aucune orbitale de nombre quantique secondaire supérieur à 3
Le nombre total d'orbitales dans un niveau énergétique de nombre quantique principal n est égal à n2 ( règle de Hund ou Storner )
Les formes des orbitales, définies par la valeur du nombre quantique l sont représentées schématiquement ci-après.
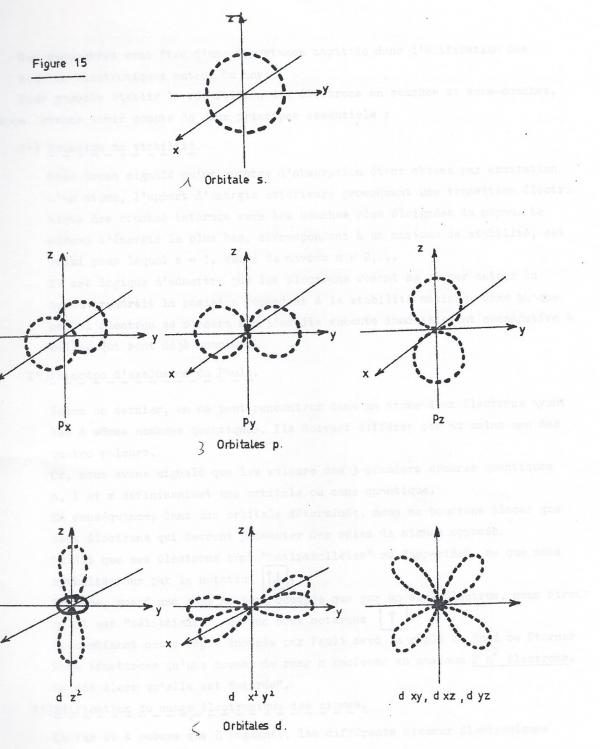 Ces paramètres vont être d'une importance capitale dans l'édification des couches électroniques autour du noyau.Pour pouvoir établir la répartition des électrons en couches et sous-couches, nous devrons tenir compte de deux principes essentiels :
Ces paramètres vont être d'une importance capitale dans l'édification des couches électroniques autour du noyau.Pour pouvoir établir la répartition des électrons en couches et sous-couches, nous devrons tenir compte de deux principes essentiels :
1° Principe de stabilité
Nous avons signalé qu'un spectre d'absorption étant obtenu par excitation d'un atome, l'apport d'énergie extérieure provoquant une transition électronique des couches internes vers les couches plus éloignées du noyau. Le niveau d'énergie le plus bas, correspond, correspondant à un maximum de stabilité, est celui pour lequel n 1, suivi du niveau n = 2,...
Il est logique d'admettre que les électrons venant venant se placer autour du noyau prendrait la position répondant à la stabilité maximum, donc chaque nouvel électron se placera sur l'orbite vacante immédiatemment consécutive à celles qui sont déjà occupées.
2° Principe d'exclusion de Pauli
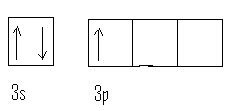
Selon ce dernier, on ne peut rencontrer dans un atome deux électrons ayant les 4 mêmesnombres quantiques , ils doivent différer par au moins une des quatre valeurs. Or, nous avons signalé que les valeurs des 3 premiers nombres quantiques n, l et m définissaient une orbitale ou case quantique.En conséquence, dans une orbitale déterminée , nous ne pourrons que placer deux électrons qui devront présenter des spins de signes opposés. On dit que ces électrons sont "anti-parallèles" ou appariés,
ce que nous symboliserons par la notation :
De même lorsqu'une case ne sera occupée que par un seul électron, nous dirons qu'il est célibataire, ce que nous noterons :
En combinant cette règle énoncée par Pauli avec celle énoncée par avec Hund ou Storner, nous admettrons qu'une couche de rang n admet au maximum 2 n2 électrons
On dit alors que cette couche est saturée
3° Edification du nuage électronique des atomes
Au fur et à mesure que Z augmente, les différents niveaux électroniques vont se remplir dans l'ordre des énergies croissantes, nous admettrons que les orbitales caractérisées par une même valeur des nombres n et l ont même énergie. Il importe donc maintenant de connaître l'ordre de classement des différents niveaux électroniques par énergie croissante.
Nous noterons une couche par la valeur de n suivie d la lettre s,p,d, ou selon que l = 0, 2, ou 3.
Exemple : 1s, 4p,5d
On serait tnté d'admettre que les niveaux se saturent dans l'ordre des n croissants, et pour n donné, dans l'ordre s,p,d,f. Dans ces conditions, nous rencontrerions pour les éléments connus actuellement 5 périodes de respectiveme,1, 2,8,18,32,50 éléments.
Or, l'examen du tableau de Mendelejeff nous montre qu'il n'en est pas ainsi. Comme nous le verrons plus loin, la première anomalie se produit avec le potassium, pour lequel commence le remplissement de la couche 4s alors que la 3d est encore vide, les interactions entre électrons, sont à l'origine de cette " anomalie " . Nous retiendrons l'ordre de remplissage de la manière suivante :

4) Multiplicité maximum
Le dernier problème restant à élucider, concerne la répartition des électrons dans les cases. La règle qui régit cette distribution est souvent appelée règle de multiplicité maximum ( Hund ).
Quand plusieurs électrons sont à placer dans les différentes cases d'un même état, on occupera le plus grand nombre possible de cases par un électron célibataire avant qu'il y ait éventuellement formation d'un doublet.
Ainsi, 4 électrons dans les 3 cases d'un même état p prendront la disposition :
5) Formules électroniques des atomes
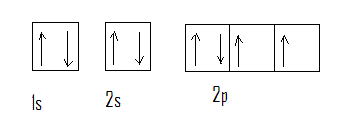
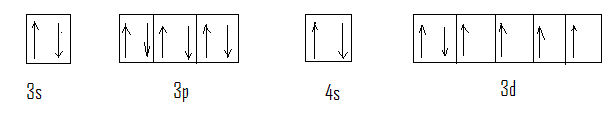
En nous basant sur les règles précédentes, représentons à titre d'exemple la structure électronique de l'oxygène ( Z = 8)
Nous aurons dans les orbitales :
1s : 2 électrons
2s : 2 électrons
2p : 4 électrons
ce que nous représentons par la formule électronique suivante, où les nombres d'électrons dans chaque orbitale sont indiqués en exposants :
1s2, 2s2, 2p4
Ou encore en détaillant les cases :
La répartition tenant compte de la règle de multiplicité maximum pourra être donnée par une formule plus précise :
1s2, 2s2,2p2x 2p1y 2p1z ,
De même, pour l'aluminium ( Z = 13 ) nous aurons sur le niveau énergétique le plus éloigné du noyau ( couvche périphérique ).
6 Chevauchement des niveaux électroniques en fonction de la charge du noyau
Lorsque Z, augmente, l'attraction du noyau pour les couches électroniques s'accroît du fait de l'augmentation de sa charge. Vu le remplissage par des nombres d'électrons différents , les couches électroniques subissent des attractions différentes et, comme le montre le diagramme qualitatif suivant, les couches électroniques se replacent dans un ordre normal en fonction des valeurs de n et l.
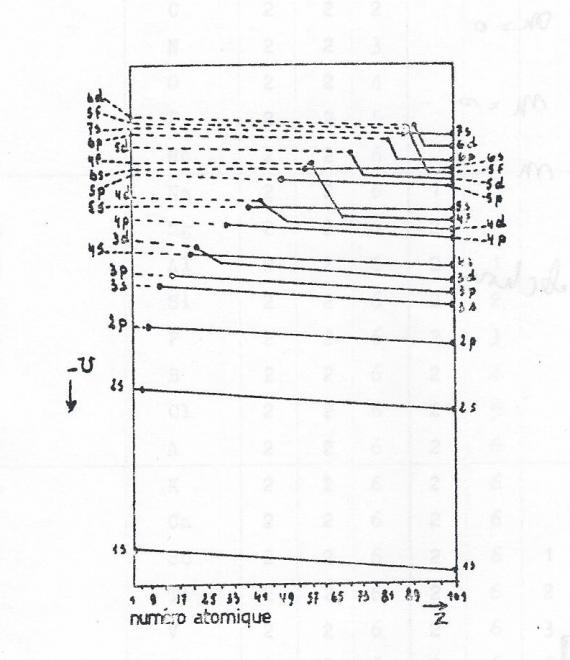
Voir le tableau ci-après de la configuration électronique des éléments
Pour comprendre ce tableau, il faut tenir compte des remarques suivantes :
- Remplissage par ordre d'énergie minimal
Au delà de Z=18, la configuration d'énergie électronique minimale peut comporter des inversions dans l'ordre de remplissage des sous-couches par rapport à leur niveau d'énergie . Ceci est du au fait que le critère de stabilité maximale est la valeur minimale de l'énergie totale de l'atome , et qu'elle ne se réduit pas à la somme des énergies "individuelles" des électrons ; il s'y ajoute des terme traduisant des interactions entre électrons
- Remplissage selon la règle de Klechkowski
- Règle de multiplicité maximum.
-En définitive, il existe cependant un grand nombre d'exceptions . Il s'agit d'éléments dont le niveau d est incomplètement rempli , et dont les atomes trouvent une énergie électronique totale plus faible dans une configuration dfifférente de celle que laissent prévoir les règles ci-dessus.



Base quantique développée par place








Date de dernière mise à jour : 29/11/2018
Ajouter un commentaire