- Accueil
- E. Chimie
- I.Chimie générale
- chimie générale 13
chimie générale 13
8. Edifices covalents
Nous avons déjà signalé, lors de la discussion au sujet des édifices ioniques la possibilité de coexistence dans les réseaux cristallins de plusieurs types de liaisons .
L'étude des édifices covalents montre l'existence, à côté des forces de liaisons covalentes intramoléculaires, de liaisons intermoléculaires, plus faibles que les précédentes, qui sont de deux types :
- Les liaisons de Van der Waals
- Les liaisons hydrogène
Leur étude fera l'objet des paragraphes suivants :
Propriétés physiques des édifices atomiques .
La liaison covalente est assez forte, mais ce caractère n'est pas général.
Propriétés mécaniques : elles sont variables. Ainsi, la dureté de la blende est faible ( 3,5 ) tandis que celle du diamant est très élevée.
La blende est facilement fusible , le diamant ne fond qu'au delà de 3000°C
Propriétés électriques : les cristaux atomiques ne contenant ni électrons ni ions mobiles ( sauf C graphite ) sont des isolants et le restent à l'état fondu.
Propriété optiques : Elles sont également très diverses .
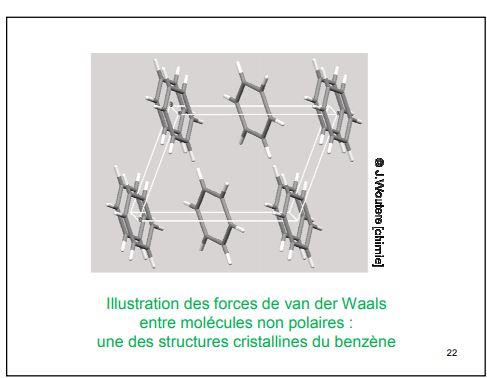
D. Les liaisons de Van der Waals.
Il s’agit d’une liaison de type intermoléculaire qui s’exerce entre les molécules d’une substance (contrairement aux liaisons de covalence qui sont des liaisons intramoléculaires car elles s’établissent entre les atomes d’une même molécule).
Cette liaison est plus précisément une interaction électrique de faible intensité qui s’exerce entre les molécules présentant un moment dipolaires.
Par définition ces molécules sont globalement neutres mais présentent un pôle positif (centre des charges partielles positives localisées sur les atomes les moins électronégatifs) et un pôle négatif (centre des charges partielles négatives). Il s’exerce une force électrique globalement attractive entre les pôles de signes opposés des différentes molécules.
1. L'existence de ces liaisons intermoléculaires à permis d'expliquer les écartsdes gaz réels par rapport à l'état parfait.
Elles sont essentiellement dues à des effets électriques résultant de la possibilité d'existence de "dipôles" dans les molécules.
Dans une molécule électriquement neutre, suite à la présence de liaisons ioniques ou covalentes polarisées peuvent exister des charges + et - . Si les centre de gravité des charges positives +q ne coïncide pas avec le centre de gravité des charges négatives -q, l'ensemble constitue un dipôle dont le moment électrique ( dipolaire) est p = q . l ( l = distance des deux centres de charges ).
Les dipôles créent dans l'espace qui les environne à une distance r un champs électrique E proportionnel à 1/r3
Si r >> 1 , l'action de E est ^pratiquement négligeable .
Ces forces intermoléculaires seront donc "à faible rayon d'action"
Les forces de Van der Waals peuvent être dues à 3 effets distincts

a) interaction dipôle - dipôle ( ou force de Keesom ou d'orientation )

On étudie l'interaction entre deux dipôles de moments dipolaires permanents respectifs  et
et  éloignés d'une distance moyenne
éloignés d'une distance moyenne  . En l'absence d'autres forces extérieures, les dipôles s'alignent pour minimiser l'énergie, comme le feraient deux aimants. Néanmoins, en raison de l'agitation thermique, ils ont également tendance à se désaligner. Il existe donc un degré de liberté angulaire à prendre en compte à l'aide de la statistique de Boltzmann. L'énergie potentielle
. En l'absence d'autres forces extérieures, les dipôles s'alignent pour minimiser l'énergie, comme le feraient deux aimants. Néanmoins, en raison de l'agitation thermique, ils ont également tendance à se désaligner. Il existe donc un degré de liberté angulaire à prendre en compte à l'aide de la statistique de Boltzmann. L'énergie potentielle 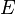 qui s'ensuit a la forme :
qui s'ensuit a la forme :

Avec :
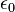 , permittivité relative ou constante diélectrique du vide (8,854.10−12 C2.J−1.m−1)
, permittivité relative ou constante diélectrique du vide (8,854.10−12 C2.J−1.m−1)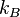 , constante de Boltzmann (1,381.10−23 J.K−1)
, constante de Boltzmann (1,381.10−23 J.K−1) , température absolue (K)
, température absolue (K)
En calculant la dérivée de l'énergie par rapport à la distance moyenne r, on peut remonter à l'expression de la force de Keesom :
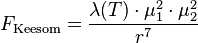
où  est une fonction de la température.
est une fonction de la température.
On remarque que les forces de Keesom s'atténuent très vite avec la distance (inversement proportionnelles à la puissance 7 de la distance). Notons en outre que les forces de Keesom sont liées à l'arrangement moléculaire et donc à la température. Quand cette dernière augmente, les forces de Keesom faiblissent.
L'énergie de ce genre de liaison varie entre 0,5 et 3 kJ/mol.
b Interaction par dipôle induit ( force de polarisation ou de Debye )


Elle se manifeste entre une molécule de moment permanent p et une autre symétrique ( sans moment )
Le champ E dû au dipôle permanent créé dans la molécule initialement non dipolaire un dipôle induit ( il la polarise ) d'orientation telle que l'effet est toujours attractif. Cet effet est pratiquement indépendant de la température.
On démontre que la force de Debye vaut, dans le système CGS :
f = -30 a p2 1/r7
a = polarisabilité de la molécule pi = a . E
pi = moment induit
E = champ polarisant
c) Effet de dispersion ( force de dispersion ou de London )

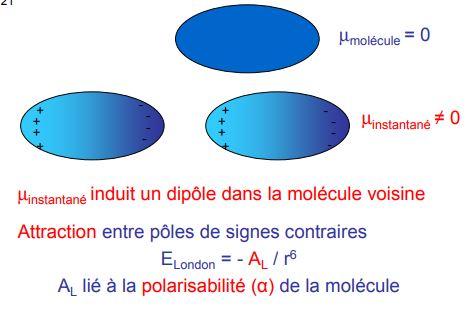 Si les deux molécules dont on envisage l'interaction ont un moment permanent nul, on pourrait s'attendre à n'observer aucun effet. En réalité, l'équiulibre des électrons étant dynamique , des moments instantannés peuvent apparaître, causant des dipôles induits et une force résultante attractive, qui sera elle aussi pratiquement indépendante de la température.
Si les deux molécules dont on envisage l'interaction ont un moment permanent nul, on pourrait s'attendre à n'observer aucun effet. En réalité, l'équiulibre des électrons étant dynamique , des moments instantannés peuvent apparaître, causant des dipôles induits et une force résultante attractive, qui sera elle aussi pratiquement indépendante de la température.
Elle vaut :
f = 9/2 . h. u . a2 . 1/r7
En conclusion les forces de Vander Waals, proportionnelles à 1/r7 ne se manifesteront que pour de faibles distances intermoléculaires.
2. Propriétés physiques des édifices moléculaires
a) Propriétés mécaniques et thermiques
Vu la faiblesse des liaisons de Van der Waals, les cristaux moléculaires seront tendres, relativement compressibles, leur température de fusion sera basse, de même que leur énergie de sublimation.
b) Propriétés optiques et électriques.
Ne comportant pas de charges mobiles, les cristaux moléculaires seront des isolants électriques. Ils le resteront à l'état liquide.
Ils peuvent devenir conducteurs en solution si leurs molécules sont ionisées.
Les propriétés optiques, qui sont celles des molécules restent les mêmes pour les 3 états physiques .
 b) Avec l'oxygène : les molécules d'eau s'associent de même
b) Avec l'oxygène : les molécules d'eau s'associent de même
Avec l'azote :
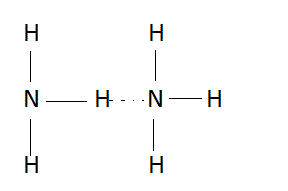
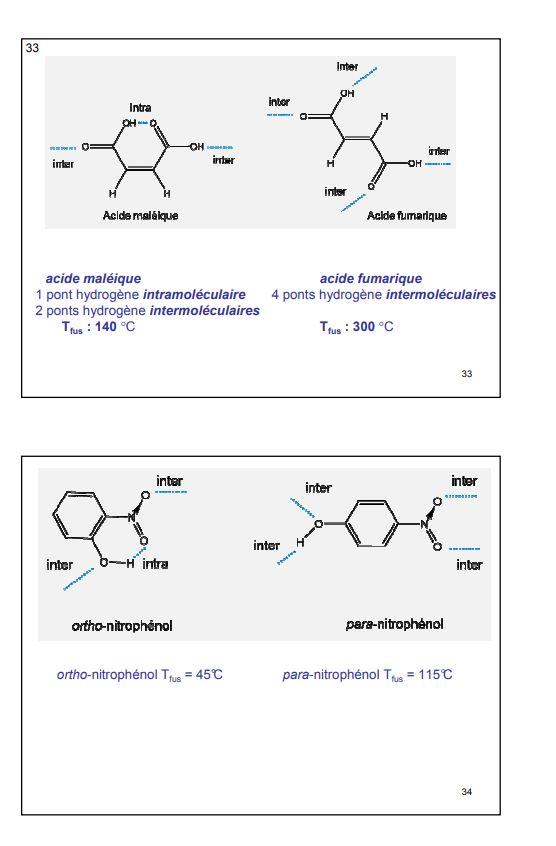
3. Liaisons intra-mpléculaires ( chélation )
Ce genre de liaison hydrogène se produit essentiellement chez les dérivés disubstitués du benzène avec des groupements en ortho :
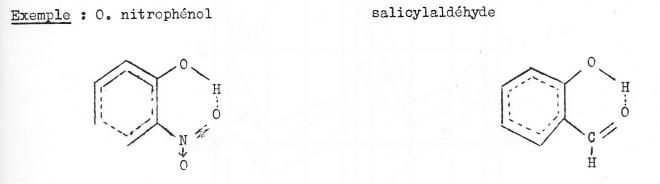 4. Liaisons hydrogène intermoléculaires.
4. Liaisons hydrogène intermoléculaires.
Elles se manifestent surtout chez de nombreux composés organiques comportant de l'hydrogène et de l'oxygène dans leurs groupements fonctionnels.
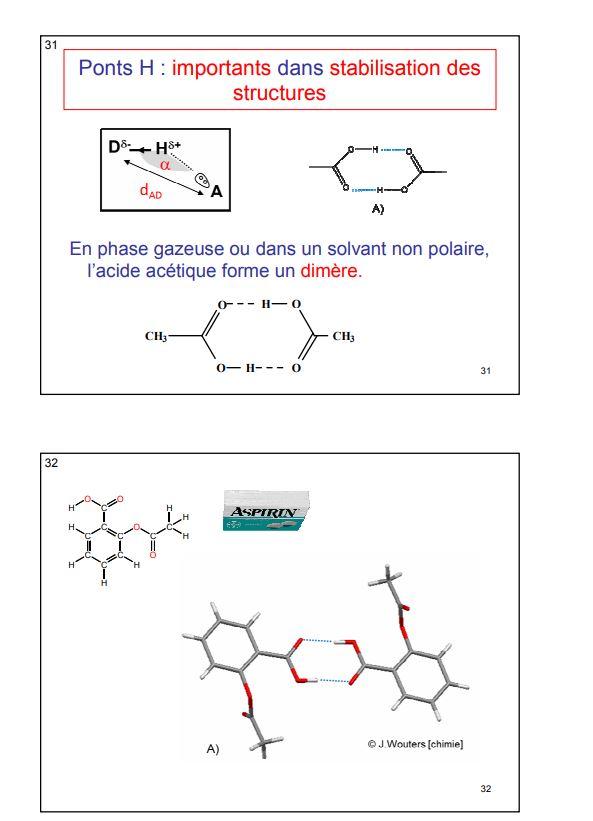
Ainsi, les monoacides carboxyliques formeront des dimères stables à l'état solide et à l'état liquide.
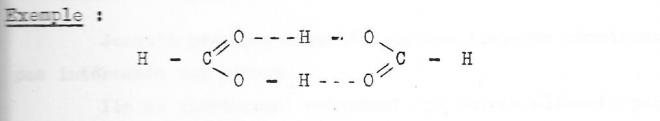 il en sera de même pour l'acide acétique, l'acide benzoïque etc ... De même, les alcools cristallisés tendront à se polymériser.
il en sera de même pour l'acide acétique, l'acide benzoïque etc ... De même, les alcools cristallisés tendront à se polymériser.
5. Influence des liaisons de vanderwaals sur les propriétés physiques
5.1 sur les temératures de changement d'état
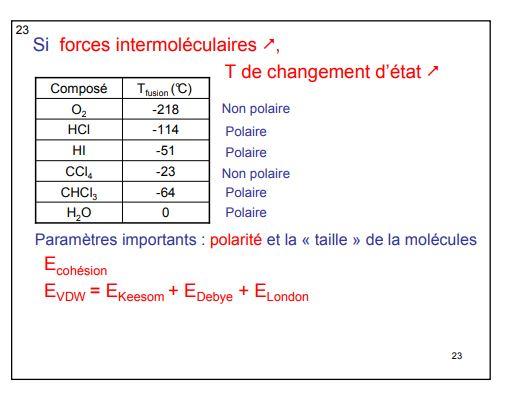
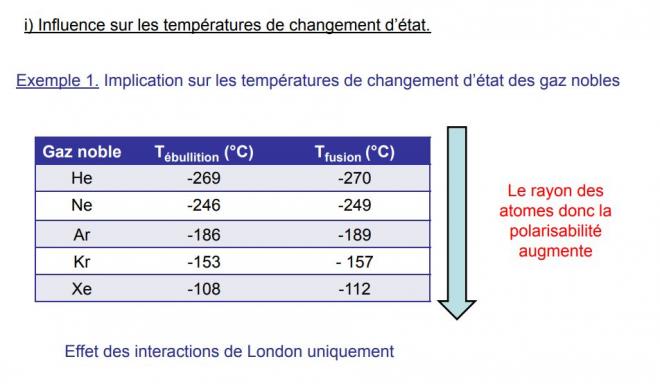
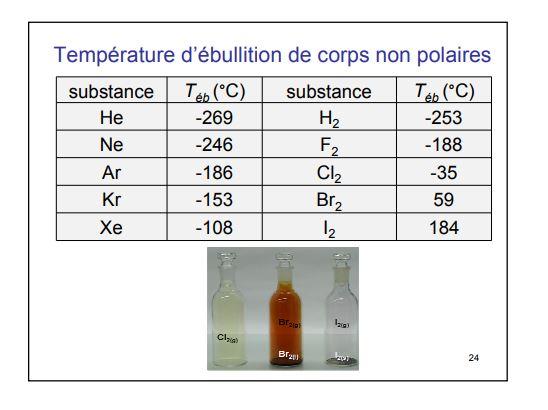
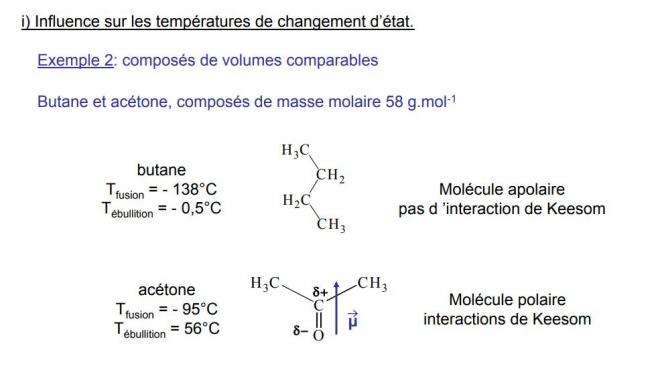
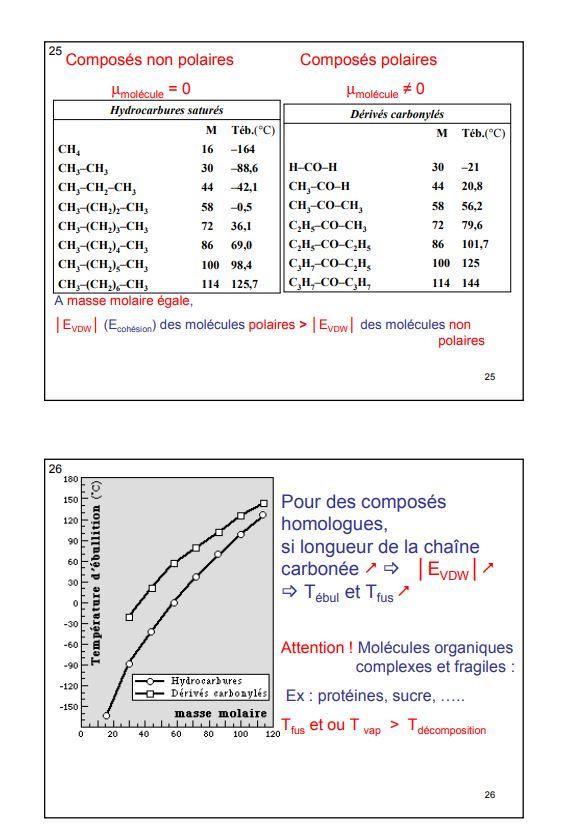
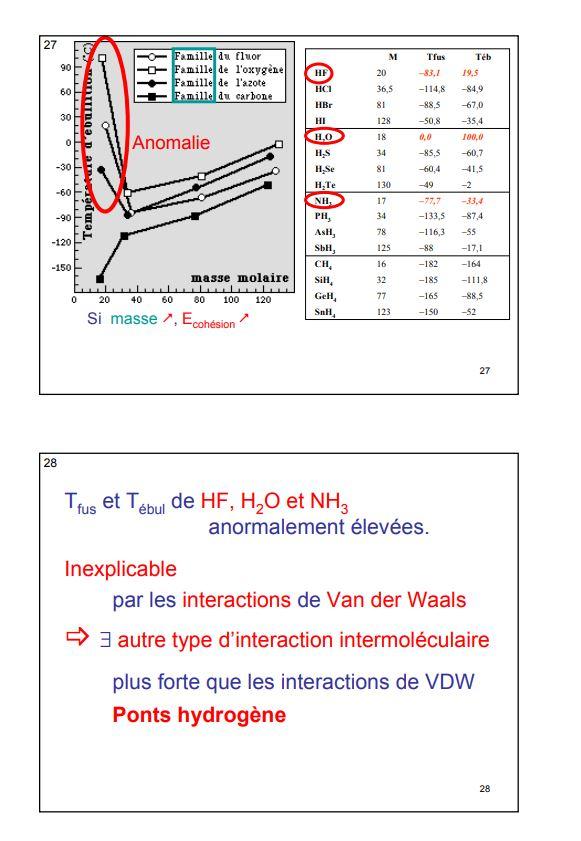
E. Les liaisons par "pont hydrogène".
1. Généralités
Nous avons défini au paragraphe précédent ce que nous entendions par dipôle moléculaire et moment électrique . Les molécules présentant des dipôles permanents sont dissymétriques et présentent deux " régions " distinctes portant des charges de signes contraires.
Nous verrons plus loin que de telles molécules pourront se fixer par attraction électrostatique sur certains ions ( solvatation et formation de complexes ), mais il est un cas particulierement de liaison dipôle-dipôle : celui des molécules contenant de l'hydrogène uni à un élément fortement électronégatif.
Les dipôles moléculaires, de moment électrique élevé, manifestant une nette tendance à l'association : c'est la liaison par "pont hydrogène" ou "liaison hydrogène" . Ces liaisons sont nettement moins fortes que les liaisons covalentes ( 25 fois plus faibles qu'une liaison O - H) . Leur stabilité décroît avec l'électronégativité du partenaire de l'hydrogène.
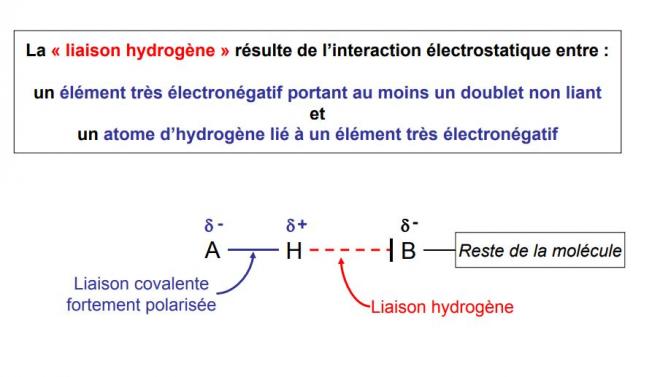
2. Exemples

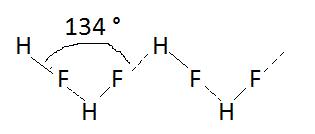
a) avec le fluor : la molécule de HF présente une nette délocalisation des charges, le fluor étant fortement polarisé négativement et l'hydrogène positivement.
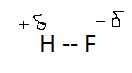 Les molécules vont s'associer pour former des chaînes en zig-zag avec alternance de laiasons covalentes et de liaisons hydrogène ( traits tiretés)
Les molécules vont s'associer pour former des chaînes en zig-zag avec alternance de laiasons covalentes et de liaisons hydrogène ( traits tiretés)
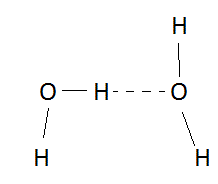
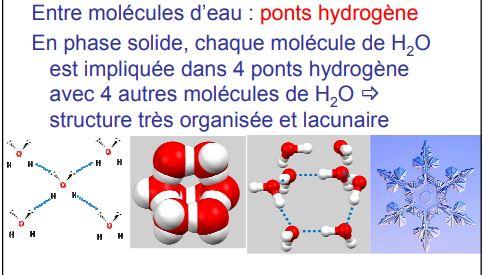
b) Molécule d'eau
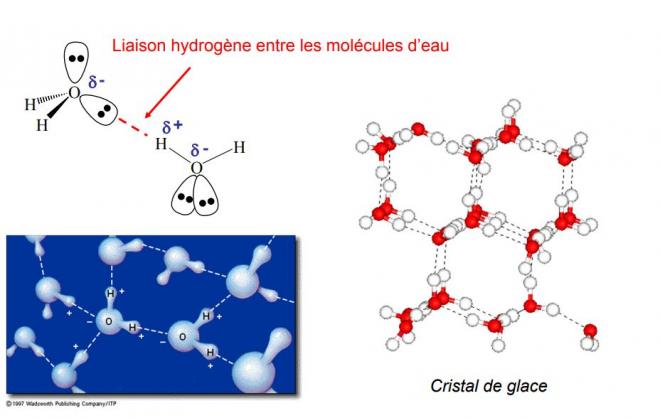 c) Stabilisation des structures
c) Stabilisation des structures
d. Bases azotées des acides nucléiques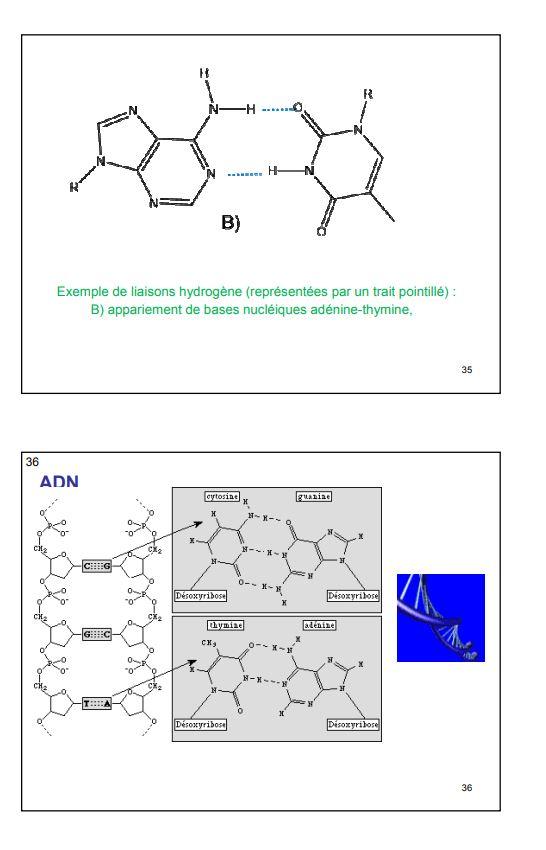
e. Protéines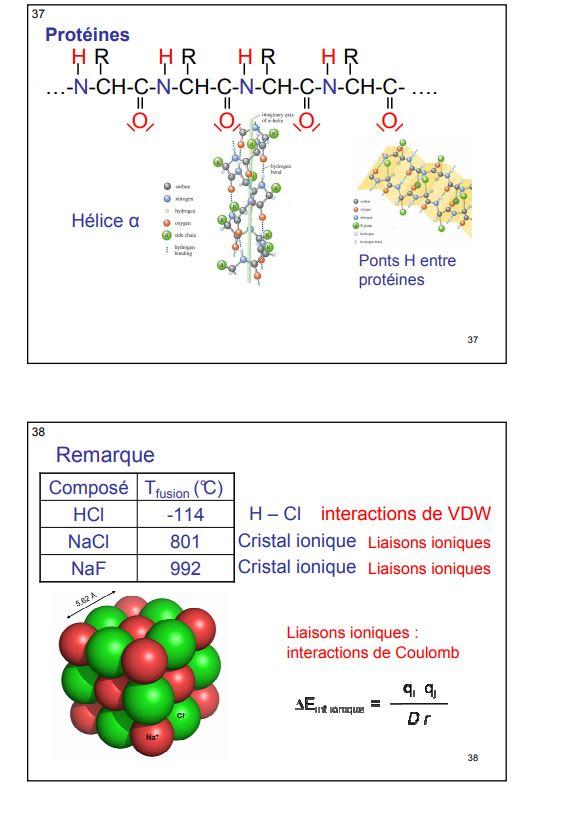 6. Influence de la liaison hydrogène sur les propriétés physico-chimiques.
6. Influence de la liaison hydrogène sur les propriétés physico-chimiques.
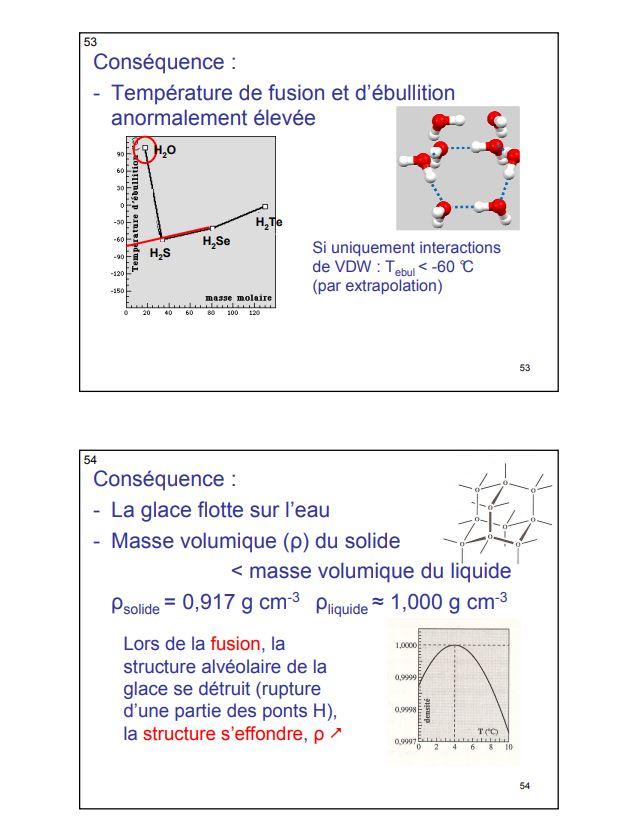
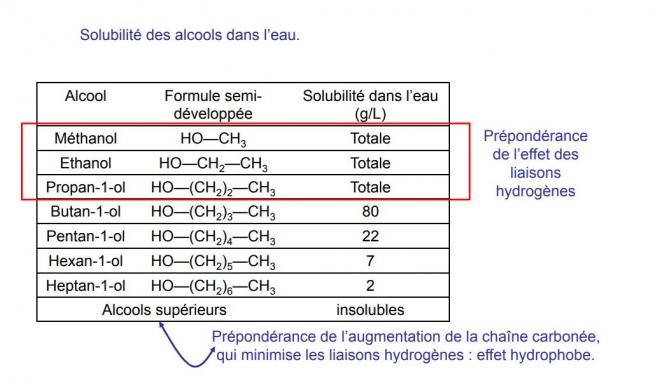
En plus du changement de solubilité cité pour la chélation, il faut citer les anomalies de températures de fusion et d'ébullition , anormalement élevées pour HF, H2O et NH3
Les électrons ne sont pas localisés, mais circulent à peu près librement entre les ions, cette résonance s'étendant aux trois dimensions du cristal assurant une grande stabilité .
La liaison métallique est donc une liaison ion-électron délocalisée, les électrons prouvant être considérés comme libres.
L'existence de ces électrons de valence sera élevé , plus la résonance sera marquée, plus l'édifice sera stable et sa dureté élevée ( métaux à 18 électrons ). Les électrons libres restent à l'intérieur du métal car pour en sortir ils doivent franchir une barrière de potentiel, l'excédent de charge positive les retenant.
toutefois, à haute température, l'énergie d'agitation thermique est telle que les électrons peuvent être animés d'une vitesse suffisante pour sortir du métal ( effet thermoélectrique ).
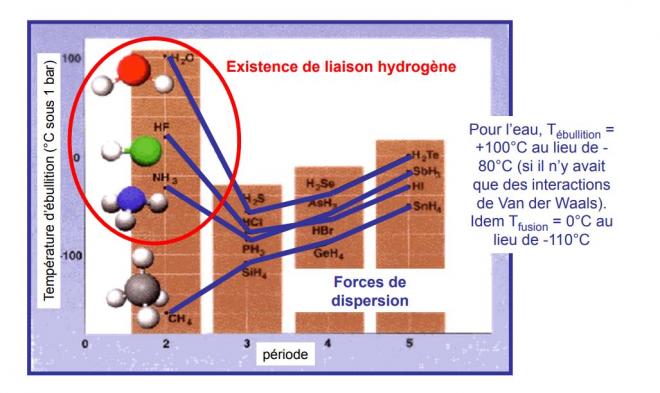

7. Forces intermoléculaires en général et influence sur les propriétés physicochimiques
SOLUBILITE ET MISCIBILITE
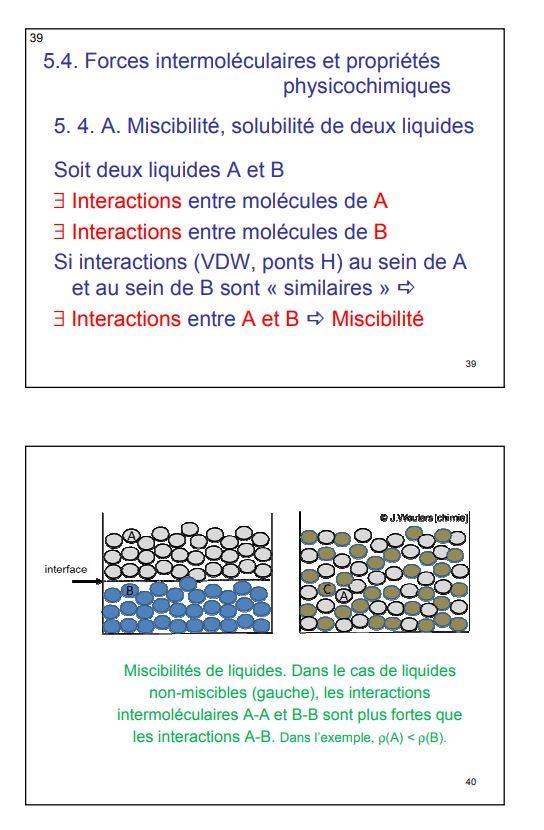



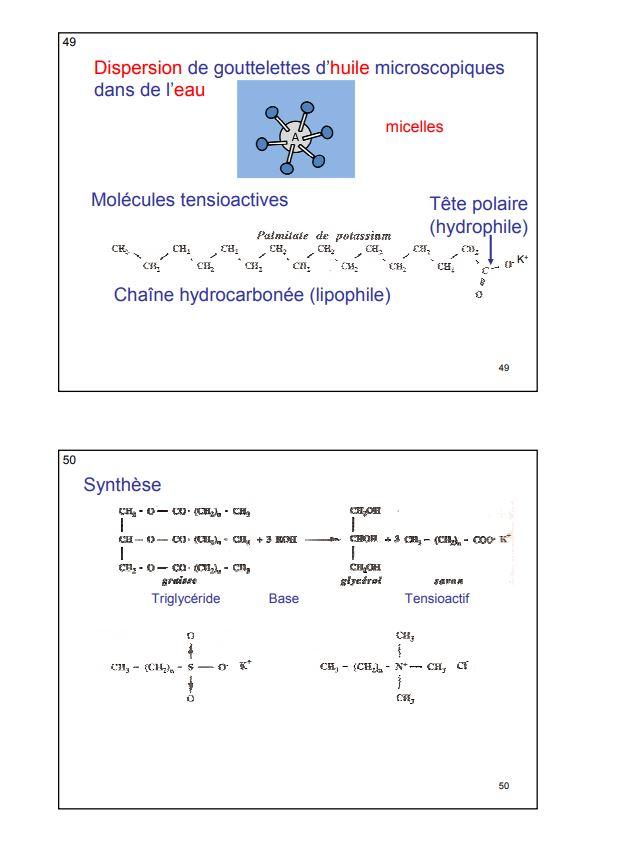
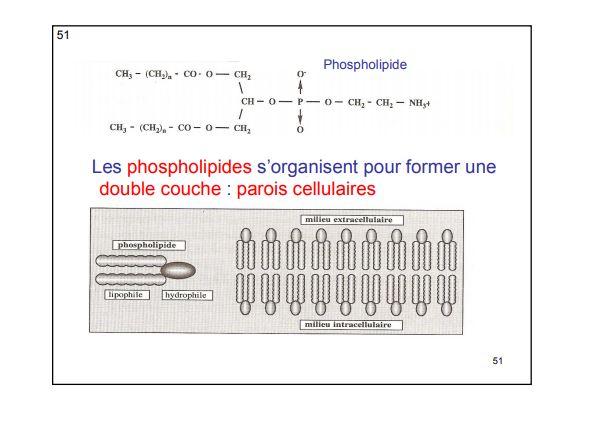 STRUCTURE ET PROPRIETES DE L'EAU
STRUCTURE ET PROPRIETES DE L'EAU
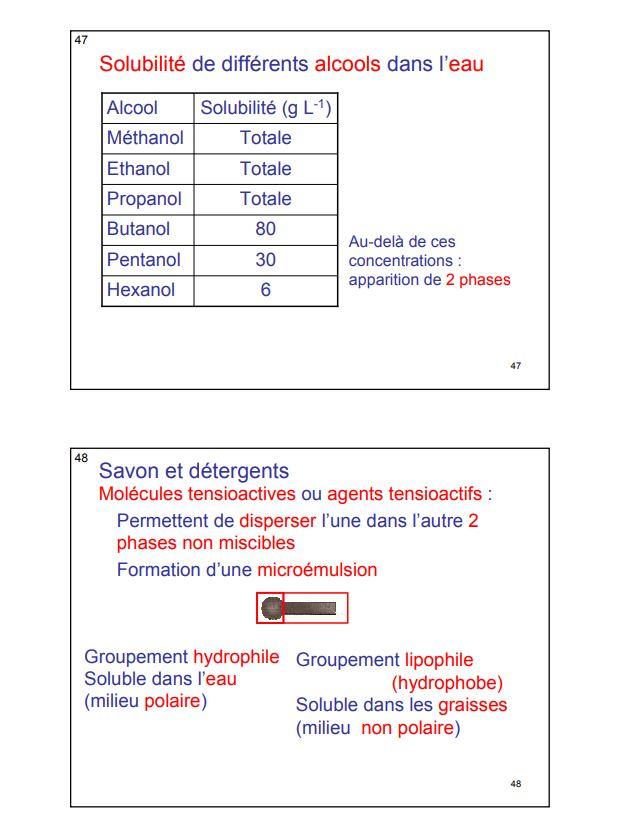
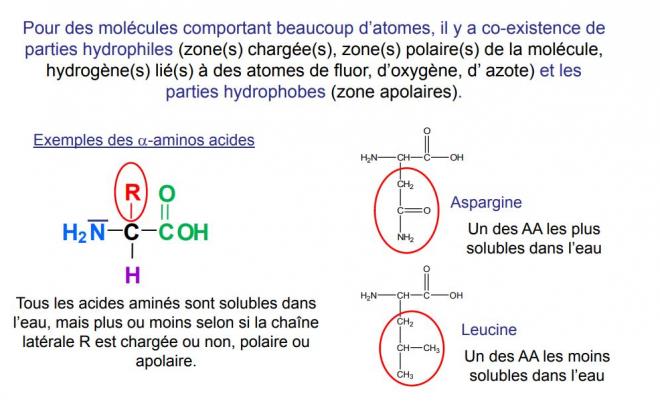
 HYDROPHYLIE/HYDROPHOBICITE
HYDROPHYLIE/HYDROPHOBICITE
Date de dernière mise à jour : 02/12/2018
Ajouter un commentaire

