- Accueil
- E. Chimie
- I.Chimie générale
- Chimie générale 12
Chimie générale 12
6. Energie des liaisons covalentes
Comme nous l'avons signalé, lors de l'élaboration d'une liaison double ou triple entre deux atomes, les liaisons pi correspondent à un recouvrement latéral des orbitales atomiques seront moins énergétiques que les liaisons Sigma.
Ces faits sont vérifiés expérimentalement .
Dans un composé come C2H6 , où les deux carbones ne sont unis que par une liaison sigma, la distance entre les noyaux est de 1,54 Angström et l'énergie de liaison C - C est de 83 Kcal.
Alors qu'on devrait dans ces conditions avoir une énergie de 166 Kcal pour une liaison double , l'expérience donne 146,4 Kcal.
La liaison pi est donc beaucoup plus faible que la liaison Sigma.
Son énergie n'est que : 146,4 - 83 = 63,4 Kcal.
Ceci explique la fragilité des liaisons doubles et la facilité des réactions d'addition des composés éthyléniques.
Pour une liaison triple l'énergie est de 199,8 Kcal, donc la seconde liaison pi aura une énergie de : 199,8 - 146,4 = 53,4 Kcal.
Ce qui confère aux composés acétyléniques une fragilité encore plus grande que celle des éthyléniques.
Les distances C - C deviennent de plus en plus courtes :
1,34 et 1,20 Angström.
On appelle énergie de liaison d'un composé covalent l'énergie qu'il faut fournie pour le former à partir d'atomes libres et non à partir de molécules .
Ainsi l'énergie x de formation de l'eau ( sous forme de vapeur ) correspond à la réaction :
2H + O--------> H2O
et pas à :
H2 + 1/2 O2 -----------> H2O
Pour laquelle Delta U = 58 Kcal/môle ( réaction exothermique ).
On peut calculer l'énergie x en utilisant d'autres données expérimentales.
H2 -----> 2H - 103 Kcal
O2 -----> 2O - 118 Kcal
En appliquant le premier principe de la thermodynamique, nous aurons
58 = - 103 -118/2 + x ======> x = 220 Kcal
Le composé formé sera donc plus stable que le système des composants de départ.
7. Phénomène de résonnance ou mésomérie.
En appliquant les principes vus jusqu'à présent à la représentation de molécules, nous allons rencontrer une dernière difficulté.
En effet pour certaines molécules covalentes, à une position déterminée des noyaux atomiques pourront correspondre plusieurs possibilité de configurations électroniques.
a) Ainsi, dans le cas de la molécule de disoxyde de carbone CO2 , la représentation la plus simple serait :
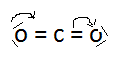 (I)
(I)
avec une distance C=O analogue à celle rencontrée dans les cétones , soit 1,22 Agström. Son énergie de formation serait de 346 Kcal.
Or l'expérience signale que , si la molécule de CO2 est linéaire, symétrique et ne présente pas de moment dipolaire , la distance C - O y est égale à 1,15 Agström et l'énergie de formation vaut 382 Kcal.
En nous référant au strict point de vue de l'échange de doublets électroniques de liaison, nous aurions également put donner les représentations suivantes, obtrenues par migration des doublets suivant les flèches indiquées en (I).
Pour le calcul des charges , on se base sur l'écart de composition électronique par rapport à l'état fondamental.
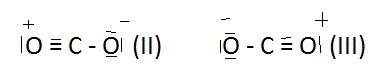 Les distances théoriques C - O et
Les distances théoriques C - O et ![]() sont respectivement 1, 43 Angström et 1,10 Angström, aucune ne correspondant donc à la valeur réelle. Les énergies de formation correspondant à (II) et (III) seraient de 348 Kcal.
sont respectivement 1, 43 Angström et 1,10 Angström, aucune ne correspondant donc à la valeur réelle. Les énergies de formation correspondant à (II) et (III) seraient de 348 Kcal.
On est donc conduit à admettre que la molécule réelle ne correspond à aucune de ces représentations, appelées formes limites . On dit que la structure réelle est un hybride de résonnance entre les différentes formules limites .
Il importe de ne pas confondre ce phénomène de résonance , aussi nomé mésomérie avec le phénomène d'isomérie qui consiste lui, en une répartition différente des noyaux de la molécule.
Insistons sur le fait qu'aucune des formules limites n'a de réalité, même dans un temps très bref.
La molécule réelle ne correspond donc pas à un équilibre entre les différences représentations . On ne représentera donc la résonance entre les différentes formes par une flèche à double pointe.
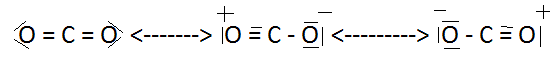 Cette conception peut sembler assez imprécise, mais elle a été vérifiée par les théories de la mécanique ondulatoire . Si à chacune des formules I,II et III peut être associée une fonction d'onde F, la molécule réelle correspondra à une valeur minimale de :
Cette conception peut sembler assez imprécise, mais elle a été vérifiée par les théories de la mécanique ondulatoire . Si à chacune des formules I,II et III peut être associée une fonction d'onde F, la molécule réelle correspondra à une valeur minimale de :
F = C1 F1 + C2 F2 + C3 F3
combinaison linéaire des trois fonctions précédentes, qui va, comme nous l'allons montrer, correspondre à un accroissement de stabilité.
b) Energie de résonnance
Les écarts entre les énergies de formation théorique des liaisons entre carbone et oxygène et l'énergie de formation de la molécule réelle de CO2 montrent bien que la résonance accroît la stabilité de la molécule.




Date de dernière mise à jour : 02/12/2018
Ajouter un commentaire

