- Accueil
- E. Chimie
- I.Chimie générale
- Chimie générale 14
Chimie générale 14
VI LES ETATS DE LA MATIERE
VI.1. L'état gazeux
VI.1.1 L'équation d'état des gaz. Gaz parfait et gaz réel
V.1.1.1 Les lois du gaz parfait
Le comportement physique des gaz obéit à des lois simples, tant qu'on peut leur appliquer l'approximation du gaz parfait. Ce gaz parfait n'existe pas, c'est un modèle théorique idéal qui suppose notamment que les molécules sont sans interactions les unes sur les autres ( elles " s'ignorent" totalement ) et qu'elles n'ont pas de volume propre. Il n'en est pas ainsi dans la réalité , les atomes, donc les molécules , ont un volume, et il existe entre les molécules des interactions diverses.
Cependant, dans de nombreux cas , le comportement des gaz réels s'écarte assez peu de celui du gaz parfait. Pour cette raison et compte tenu également de la simplicité remarquable des lois du gaz parfait, celles-ci sont souvent appliquées aux cas réels.
- Les variables d'état d'un gaz
Un échantillon d'un gaz n'a pas de volume défini ; il occupe toujours la totalité du volume qui lui est offert, si grand soit-il. Un gaz est expansible sans limite , et cette expansion est spontannée ( une odeur , due à la présence dans l'atmosphère d'un gaz odorant , se répand dans toute une pièce.
Un gaz peut aussi être comprimé , de façon à occuper un plus petit volume qu'au départ. Il est compressible , mais la compression n'est pas spontanée ( pour gonfler un pneu , on comprime l'intérieur , en dépensant de l'énergie , un volume d'air , pris dans l'atmosphère , plus grand que le volume intérieur du pneu ).
On ne peut donc pas parler du "volume d'un gaz" , car il n'est pas défini, contrairement à celui d'un liquide ou d'un solide . Mais on peut parler du volume occupé par un gaz , dans des conditions déterminées. Dans des conditions données de température et de pression , une masse donnée d'un gaz occupe un volume bien déterminé. Ainsi à 0°C et à la pression atmosphérique de 1,013 . 105 pascals , 10 gr de dihydrogène occupent 0, 112 m3 ( ou 112 l ). Si on offre à ce dihydrogène , sans modifier sa température , un volume plus grand, il l'occupera, mais alors sa pression sera inférieure à la pression initiale. On peut donc dire aussi qu'une masse donnée d'un gaz occupant un volume donné à une température donnée , se trouve sous une pression bien déterminée.
Quantité de matière, volume, pression et température sont les variables d'état d'un échantillon de matière à l'état gazeux; leurs valeurs définissent l'état dans lequel il se trouve .
Pour imaginer commodément l'état d'un gaz et ses modifications on a souvent recours à un artifice. On suppose que le gaz sur lequel on raisonne est contenu dans un cylindre , fermé par un piston mobile , de masse négligeable et de surface S . La pression est créée par une action exercée sur le piston , par exemple en y posant des masses . On peut d'autre part chauffer ou refroidir le cylindre , pour fixer la valeur de la température.
 Enfin, on peut imaginer si nécessaire que le piston puisse être bloqué, si l'on veut maintenir constant le volume du gaz , quoiqu'il arrive . Par exemple , si l'on chauffe le cylindre le piston étant libre , le gaz se dilate . Le volume augmente et le piston s'élève , mais la pression reste constante. Si le piston est bloqué, la pression augmente , mais le volume ne varie pas.
Enfin, on peut imaginer si nécessaire que le piston puisse être bloqué, si l'on veut maintenir constant le volume du gaz , quoiqu'il arrive . Par exemple , si l'on chauffe le cylindre le piston étant libre , le gaz se dilate . Le volume augmente et le piston s'élève , mais la pression reste constante. Si le piston est bloqué, la pression augmente , mais le volume ne varie pas.
A)- L'équation d'état d'un gaz parfait
Les variables d'état d'un gaz ne sont donc pas indépendantes et, depuis très longtemps ( XVIIè siècle ) on a cherché les lois qui traduisent leur dépendance réciproque. On peut fragmenter ce problème en prenant ces variables deux à deux ( relation entre pression et volume, entre pression et température, etc ), les deux autres variables restant constantes. Ce fut la démarche historique , qui aboutit à la formulation d'un certain nombre de lois particulières, étudiées plus loin.
Mais il existe une relation unique , simple, qui fait en quelque sorte la "synthèse" des résultats obtenus ainsi. Cette relation est l'équation d'état du gaz parfait ( on dit aussi loi du gaz parfait ) :
P . V = n . R . T
P : pression ; V : volume ; n : quantité de matière ( moles ) ; R : constante du gaz parfait ; T : température absolue ( échelle Kelvin ).
La seule difficulté dans l'utilisation de cette relation est le choix correct des unités utilisées pour P et V et de la valeur de la constante R , qui en dépend. En unités S.I., la pression s'exprime en pascals ( Pa ), le volume en mètres-cubes ( m3 ) et la constante R vaut 8,344 j . mol-1 . K-1 ( n est toujours exprimé en moles ).
On peut vouloir exprimer la pression en atmosphères ( 1 atm = 1,013 . 105 pascals ) et le volume en litres ( 1 l = 10-3 m3 ), car ce sont des unités plus familières, souvent utilisées en chimie et en thermodynamique . En ce cas , R vaut 0,0821 . atm . mol-1 . K-1. On verra plus loin qu'il est facile de retrouver la valeur correcte de R en fonction des unités choisies.
La température doit toujours être exprimée en Kelvin ( K ) c'est à dire dans l'échelle de " températures absolues ", qui est décalée de 273,15 degrés par rapport à l'échelle Celsius : T(K) = t(°C) + 273,15.
B - Le volume molaire et la loi d'Avogadro
Le volume occupé par un gaz parfait vaut V = nRT/P . A pression et à température fixées, il dépend du nombre de moles n, mais aucunement de la nature du gaz. Ce résultat peut également se formuler d'une autre façon : des volumes égaux de différents gaz, dans les mêmes condition de température et de pression, contiennent le même nombre de moles . Cet énoncé constitue la loi d'Avogadro.
Des volumes égaux de gaz différents contiennent donc aussi le même nombre de molécules ( produit du nombre de moles par le nombre d'Avogadro = 6,02 . 1023 ). C'est un résultat très fondamental , mais très surprenant. On aurait pu supposer, en effet , que le volume occupé par un nombre donné de molécules serait d'autant plus grand que ces molécules sont plus grosses. Il n'en est rien : 1 litre de dihydrogène ( M = 2 ) et 1 litre de Fréon CF2Cl2 ( M = 121 ) contiennent, dans les mêmes conditions, le même nombre de molécules.
Le volume occupé par une mole de n'importe quel gaz, à 273,15 K ( soit 0°C ), et sous une pression de 1,013 . 105 Pa ( soit 1 atm ) est 0,022414 m3 ( ou 22,414 l ). C'est le volume molaire gazeux normal.
Il suffit de connaître la valeur et la définition du volume molaire normal pour retrouver, si nécessaire, la valeur de la constante R à utiliser en fonction des unités de pression et de volume choisies. En effet, on peut écrire, pour une mole de gaz :
R = P . V/n . T = Pression atmosphérique normale x volume molaire normal / 1 x 273,15.
C - Relations particulières entre variables d'état
Lorsque l'état d'un gaz évolue , les variables qui le définissent ne sont pas nécessairement modifiées toutes en même temps . Il est intéressant d'expliciter la façon dont chacune des variables P,V et T varie lorsqu'une seule des deux autres est modifiée.
LA RELATION PRESSION-VOLUME OU LOI DE BOYLE-MARIOTTE
Si n et T sont fixés, la loi du gaz parfait se réduit à P V = constante . Depuis longtemps ( Boyle, 1627-1691, Mariotte , 1620-1684 ) on a en effet mis en évidence expérimentalement que pression et volume sont, à température constante, inversément proportionnels. On peut le vérifier facilement à l'aide du dispositif décrit plus haut : si on double ou triple la pression exercée sur le piston, le volume du gaz devient deux fois ou trois fois plus petit.
Cette loi particulière ( loi de Boyle-Mariotte ) se traduit graphiquement par une hyperbole appelée isotherme du gaz parfait ( une transformation isotherme est une transformation qui se produit à température constante , ce qui est bien le cas içi ).
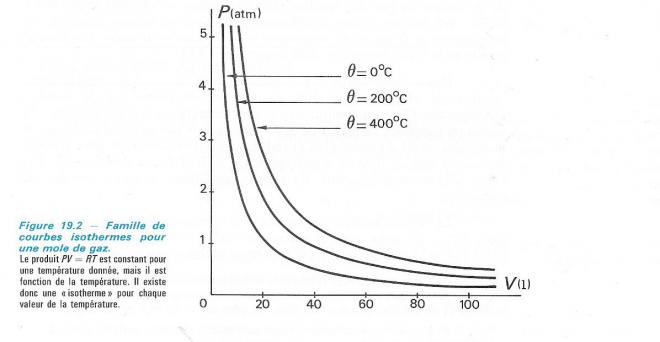
LA RELATION VOLUME-TEMPERATURE OU LOI DE CHARLES
Comme tous les corps, un gaz se dilate lorsqu'on élève sa température. Si au cours de l'échauffement , la pression reste constante , le volume varie linéairement en fonction de la température . Ce résultat établi dès 1787, constitue la loi de Charles ( physicien français, 1746-1823). La vérification expérimentale peut, par exemple se faire à l'aide du sispositif décrit plus haut, le piston étant libre de se déplacer et supportant une masse constante.
La droite V = f(T) est une isobare ( une transformation isobare est une transformation qui s'effectue à pression constante comme c'est le cas içi ) . Il y a une isobare pour chaque valeur de la pression, de pente égale à nR/P
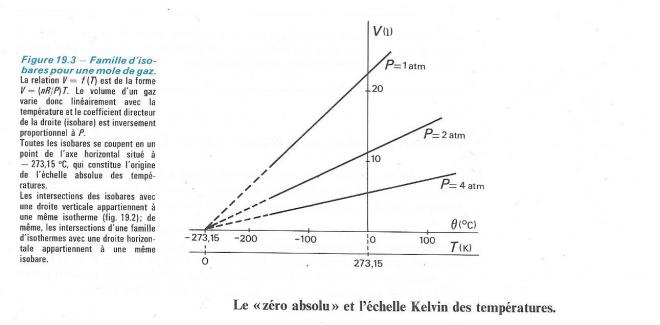 Les isobares extrapolées vers les basses températures, se coupent toutes en un point situé sur l'axe horizontal et correspondant à une température de - 273,15 °C. Pour des températures inférieures à cette valeur, le volume dugaz serait négatif, ce qui n'a pas de sens . La température de - 273,15 °C représente une limite inférieure absolue : il ne peut pas exister de température inférieure à cette valeur .
Les isobares extrapolées vers les basses températures, se coupent toutes en un point situé sur l'axe horizontal et correspondant à une température de - 273,15 °C. Pour des températures inférieures à cette valeur, le volume dugaz serait négatif, ce qui n'a pas de sens . La température de - 273,15 °C représente une limite inférieure absolue : il ne peut pas exister de température inférieure à cette valeur .
Ce point constitue donc l'origine d'une échelle absolue des températures , ou échelle Kelvin. On passe de l'échelle Celsius à l'échelle Kelvin en ajoutant 273,15 aux températures Celsius , et inversément. L'unité de cette échelle absolue est le Kelvin, de symbole K. Onni le mot " degré" ni le symbole °. Exemple : " une température de 298 K", ce qui se lit " une température de 298 Kelvin". Dans tous les calculs utilisant la loi du gaz parfait, la température doit être exprimée en Kelvin.
Au " zéro absolu " des températures, le volume de gaz parfait est nul, quel que soit le nombre de moles présent. C'est une limite que l'on ne peut pas atteindre expérimentalement , mais on peut s'en approcher beaucoup ; on sait obtenir des températures de l'ordre de 10-3 K
Une relation V = f(T) peut être établie en se référant aux températures Celsius. Elle permet d'exprimer la valeur du volume à une température T(°C) quelconque ( VT) en fonction de celle du volume à 0°C (V0)
T1 et T2 étant deux températures absolues quelconques , et V1 et V2 les volumes correspondants , la loi du gaz par fait PV = nRT permet d'écrire : V/T = constante ===> V1/T1 = V2/T2 donc : V2 = V1 . T2/T1
par conséquent VT = V0 . ( T( °C) +273)/273 = V0 (1 + (1/273) T) = V0(1 + aT).
a est appelé coefficient de dilatation des gaz( en fonction de la température à pression constante ). On peut vérifier que l'on retrouvera bien VT = 0 pout T = - 273°C ( c'est à dire K).
RELATION PRESSION TEMPERATURE OU LOI DE GAY-LUSSAC
Si on chauffe un gaz sans laisser varier son volume ( piston bloqué ), sa pression augmente linéairement avec la température ( Loi de Gay-Lussac, physicien français , 1778-1850).
P et V occupent des positions identiques dans la relation PV = nRT. Les variations de P en fonction de T , V étant constant, sont donc décrites par un diagramme identique au précédent. Les droites P = f(T) sont des isochores ; comme les isobares, elles passent toutes par le point d'abscisse - 273,15 °C, sur l'axe des températures.
D - Mélanges de gaz. La pression partielle
La loi du gaz parfait s'applique à n'importe quel gaz, quelle que soit sa nature, dans la mesure seulement où on convient de le considérer comme " parfait" . Dans le cas d'un mélange de plusieurs gaz, considérés chacun comme parfait, le volume total du mélange , sa pression globale et le nombre total de moles qu'il contient satisfont à la relation PV = nRT, comme lorsqu'il s'agit d'un gaz pur.
On peut alors considérer que la pression totale sous laquelle se trouve le mélange est la somme de contributions dues à chacun de ses constituants. Chacun d'eaux , par sa présence , crée une pression partielle et la pression totale est la somme des pressions partielles de tous les constituants ( Loi de Dalton ).
La pression partielle d'un gaz dans un mélange peut être définie comme la pression qui existerait si ce gaz occupait seul le même volume que le mélange ( la température étant la même dans les deux cas ).
Plus précisément, chaque constituant d'un mélange gazeux apporte à la pression totale une contribution proportionnelle à la fraction ( en moles ) du mélange qu'il représente . Si ni est le nombre de moles du constituant et nT le nombre total de moles dans le mélange , la pression partielle Pi de ce constituant est liée à la pression totale PT par la relation :
Pi = ni/nT = xi . PT
xi = ni/nT est appelé fraction molaire du constituant i dans le mélange.
On peut vérifier facilement que la somme des pressions partielles est bien égale à la pression totale :
n1/nT PT +n2/n2 PT +... + ni/nT PT = (n1 + n2 +...+ni)/nT) . PT =( nT/nT) PT = PT
La loi du gaz parfait s'applique tout à la fois au mélange , tous constituants confondus , et à chacun des constituants , pour chacun d'eux on peut écrire une équation d'état de la forme : piV : niRT
V.1.1.2 Le comportement des gaz réels
Les gaz réels ont des comportements qui s'écartent toujours plus ou moins de ceux du gaz parfait, ou " idéal". On peut donc se demander s'il est vraiment utile , et intéressant d'étudier une théorie qui ne s'applique pas aux situations réelles.
En fait, dans beaucoup de cas, et notamment dans les conditions usuelles, lorsque la pression est voisine de la pression atmosphérique , les écarts entre la théorie et l'expérience sont assez faibles ( de l'ordre de 1%). Pour cette raison, et compte tenu de la remarquable simplicité de la loi du gaz parfait, on fait très couramment l'approximation qui consiste à attribuer aux gaz réels le comportement du gaz parfait.
La "non idéalité " des gaz réels se manifeste de diverses façons . D'une part, leur volume molaire normal n'a pas exactement la valeur théorique de 22,414 litres :
dihydrogène 22,424 l
diazote 22,401 l
dioxygène 22,393 l
dioxyde de carbone 22,263 l
ammoniac 22,083 l
monochlorométhane 21,878 l
D'autre part, les relation de proportionnalité entre les variables d'état, qui caractérisent le gaz parfait, ne sont pas exactement vérifiées. Par exemple , la variation du volume par augmentation de la pression n'est pas le même selon que la pression passe de 1 à 2 atmosphère ou de 100 à 200 atmosphères, alors que dans les deux cas , il devrait être réduit exactement de moitié . Ce type d'écart est d'autant plus important que la pression est plus élevée.
Enfin, les familles d'isothermes et d'isobares des gaz réels ont des allures très différentes de celles que nous ont montré les figures précédents . Le gaz parfait, quells que sont les conditions reste un gaz ; ni sous une très forte pression , ni à une très basse température , il ne se condense en un liquide . Mais les gaz réels par compression et/ou refroidissement se liquéfient, et les liquides formés peuvent à leur tour , se solidifier à température encore plus basse.
Diagramme P = f(V)
L'isotherme (b) de la figure ci-dessous est l'isotherme critique et M est le point critique . Au dessus de la température à laquelle correspond cette isotherme ( appelée température critique ), le gaz ne se liquéfie pas , quelle que soit la valeur de la pression . Les isothermes situées au dessus de l'isotherme critique ont donc leur allure normale , à ceci près qu'elles ne correspondent pas exactement à l'hyperbole qu'elles devraient être ( tracés (a) et (a') de la figure).
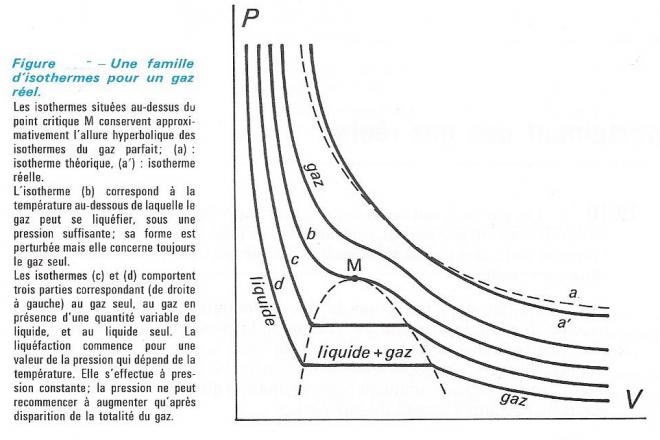
Pour des températures inférieures à la température critique, les isothermes présentent un palier horizontal, correspondant à la liquéfaction . Celle-ci s'effectue en effet à pression constante . Les branches "hautes" des isothermes appartiennent en fait au diagramme P = f (V) du liquide ; leur pente très forte traduit le fait que les liquides sont très peu compressibles.
Diagramme V = f (T)
Les isobares des gaz réels suivent approximativement les isobares théoriques dans les domaines des températures supérieures au point de condensation ( ou d'ébullition du liquide, Téb ).Elles en diffèrent par contre totalement au-dessous de cette température ( voir figure ci-dessous )
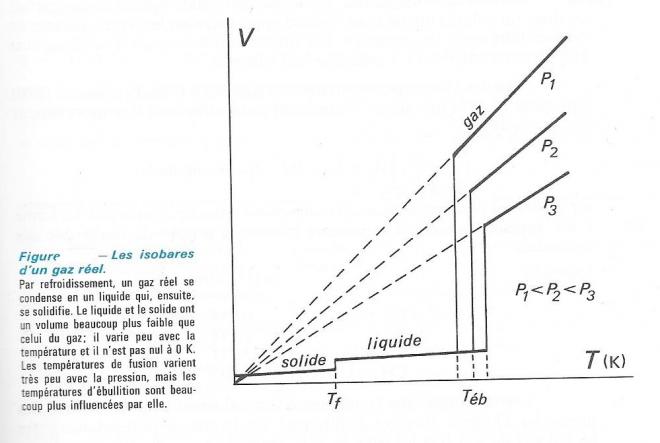 LES ORIGINES DES ECARTS OBSERVES
LES ORIGINES DES ECARTS OBSERVES
Tous les écarts de comportement des gaz réelspar rapport au gaz parfait ont les mêmes origines, qui se résument ainsi :
- Les molécules ne sont pas des masses ponctuelles ; elles ont un volume propre. Le volume dont elles disposent est donc inférieur au volume apparent du gaz. Une molécule ne peut pas réellement se trouver " n'importe où" par rapport aux autres, et le désordre de l'état gazeux réel n'est pas parfait.
- Les molécules ne sont pas indépendantes les unes des autres . Il existe entre elles des interactions : forces de Van der Waals, éventuellement liaisons hydrogène. Ces forces d'attraction réciproques expliquent que ( sauf cas particulier , comme celui du dihydrogène ) le volume molaire normal soit inférieur à 22,4 litres. Les molécules se rapprochent en effet un peu plus les unes des autresque si elles étaient indépendantes. Elles ont aussi pour effet que la pression exercée par un gaz réelsur les parois est inférieure à celle qu'exerceraitun gaz parfait, toutes choses égales par ailleurs. En effet, la pression est crééepar les chocs des molécules sur les parois et, lorsqu'une molécule arrive à proximité d'une paroi, elle ne peut être entourée d'autres molécules que du côté opposé à celle-ci. Les forces d'attraction qui s'exercent ainsi dissymétriquement sur elle réduisent la force de son impact sur la paroi.
UNE EQUATION D'ETAT POUR LES GAZ REELS
Dans le cas d'un gaz réel, le volume qui vérifierait la loi du gaz parfait est donc inférieur au volume apparent ; c'est le vrai volume de l'espace libre entre les molécules . Par contre la pression qui la vérifierait est une pression supérieure à celle que l'on observe .
Van der Waals ( physicien néerlandais, 1837-1923, prix Nobel 1910 ) a proposé en 1873 une autre "équation d'état", décrivant le comportement des gaz réels.
(P + a/V2)(V - b) = RT ( pour une mole).
où a ( en l2 . atm ) et b ( en l ) sont des termes constants , caractéristiquesde chaque gaz. Le terme b est appelé covolume ; il présente le volume propre de l'ensemble des molécules.
He : a = 0,034 l2 . atm ; b = 0,024 l
Xe : a = 4,194 l2 . atm ; b = 0,051 l
CH3Cl : a = 7,471 l2 . atm ; b = 0,065 l
CH3 - CH2OH : a = 12,02 l2 . atm ; b = 0,084 l
On remarque que b augmente normalement avec le volume des molécules . On peut observer d'autre part une bonne correspondance entre les valeurs de a et de b et les facteurs qui contribuent à créer des interactions entre les molécules ; valeur plus élevée pour Xe que pour He ( volume de l'atome, polarisabilité ) ; valeur élevée pour CH3Cl qui est une molécule polaire, et encore plus élevée pour CH3 - CH2OH qui donne lieu à une liaison hydrogène .
Ces observations permettent de définir les conditions physiques dans lesquelles les gaz réels auront un comportement proche de celui du gaz parfait :
- faible masse molaire, molécule non polaire et faible polarisabilité.
- grand volume offert au gaz, et donc pression faible. Ainsi les molécules sont très distantes les unes des autres et leurs interactions négligeables. On peut noter, du reste , que si, dans l'équation de Van der Waals, V est grand, le terme a/V2 devient négligeable devant P, et b de même devant V. On tend alors vers la relation PV : RT , c'est à dire le comportement d'un gaz parfait
- Température éloignée du point de condensation.
CONSTRUCTION DE LA LOI DES GAZ PARFAITS

1° Loi de Boyle-Mariotte
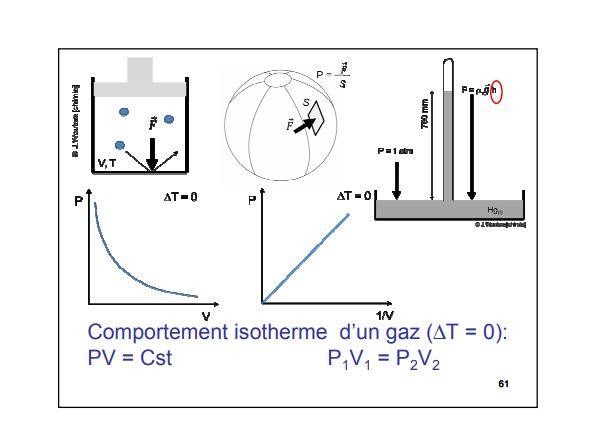
La loi de Boyle-Mariotte s’applique aux gaz à condition que:
- leur température ne varie pas
- leur quantité de matière (nombre de moles) reste constante.
Si ces conditions son respectées alors la loi de Boyle-Mariotte indique que:
Le produit de la pression d’un gaz par son volume reste constante.
Ce qui peut se traduire par la formule:
P.V = constante
Cette relation indique que si l’une des grandeurs augmente alors l’autre diminue:
- si la pression augmente alors le volume diminue
- si la pression diminue alors le volume augmente
- si le volume diminue (lors d’une compression par exemple) alors la pression augmente
- si le volume augmente (lors d’une détente par exemple) alors la pression diminue
2° Loi de Charles

Le volume d'un gaz augmente donc lorsque sa température en degrés Celsius augmente. On peut expliquer cette variation à l'aide de la théorie cinétique des gaz. Selon cette théorie, une augmentation de température résulte en une augmentation de l'énergie cinétique des particules. Le risque de collisions est donc plus probable, ce qui provoque un changement de pression. Afin de maintenir la pression constante, le volume doit augmenter. Cependant, cette relation n'est pas directement proportionnelle puisque la droite obtenue ne passe pas par l'origine. Si la droite passait par l'origine, cela indiquerait qu'aucun gaz n'existe à une température de 0°C, ce qui n'est heureusement pas le cas.
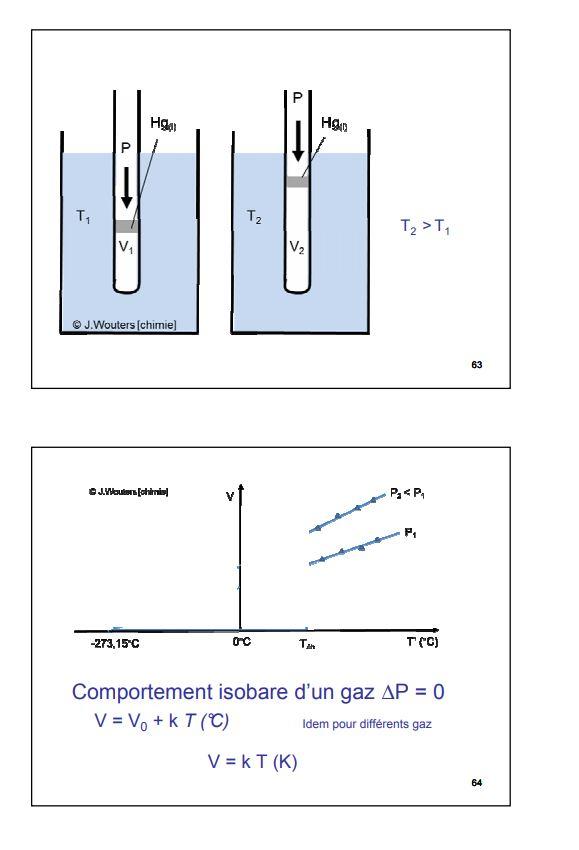

Piégé par cette évidence mathématique où la température la plus basse correspond à une valeur négative (absence d’énergie cinétique), Lord Kelvin (1824-1907) proposa une nouvelle ?échelle de température, soit celle des degrés absolus. Selon cette nouvelle échelle, le zéro absolu correspondrait à - 273,15 °C. Afin de transformer des degrés Celsius (ºC) en kelvins (K) ou degrés absolus, il s’agit d’utiliser les relations mathématiques suivantes :
T°C+273,15=TK T°C+273,15=TK
ou
TK−273,15=T°C TK−273,15=T°C
En utilisant l'échelle des kelvins plutôt que l'échelle des Celsius, la relation entre le volume et la température absolue devient directement proportionnelle puisque la droite passe alors par zéro. Cela signifie donc que si la température augmente, le volume augmente d'un facteur égal et vice versa. Mathématiquement, on peut écrire cette relation comme suit:
V∝T ou VT=constante
Comme la division du volume par la température est égale à une constante, on peut comparer deux situations pour le même gaz, en autant que la quantité de gaz et la pression ne varient pas. Il en résulte la relation suivante:
V1T1=V2T2
V1 représente le volume initial (en mL ou L)
T1 représente la température initiale (en K)
V2 représente le volume final (en mL ou L)
T2 représente la température finale (en K)

suite
script async src="//pagead2.googlesyndication.com/pagead/js/adsbygoogle.js">
Date de dernière mise à jour : 03/12/2018
Ajouter un commentaire
